生防菌剂多黏类芽胞杆菌对辣椒根际土壤细菌群落的影响
2020-06-08韩永琴陈新建罗路云
韩永琴 陈新建 罗路云


摘要 多黏类芽胞杆菌对辣椒疫病有较好的防治效果, 本文重点研究了其对辣椒根际细菌微生物的影响。收集了109 cfu/g多黏类芽胞杆菌WP、25%嘧菌酯SC、68%精甲霜·锰锌WG及对照处理后的辣椒根际细菌, 通过高通量测序分析了根际细菌种群多样性和群落结构。多黏类芽胞杆菌处理后的辣椒根际细菌多样性最高, 化学药剂处理后的辣椒根际细菌多样性也均高于对照。通过分析高通量测序结果, 发现辣椒根际细菌包括变形菌门Proteobacteria、奇古菌门Thaumarchaeota、酸杆菌门Acidobacteria、绿弯菌门Chloroflexi、放线菌门Actinobacteria等13个门。变形菌门的丰度在对照(JD)中高达70.65%, 而在嘧菌酯(JA)、精甲霜·锰锌(JB)和多黏类芽胞杆菌(JC)的处理中分别降至24.41%、25.64%和34.95%, 但仍然是各处理的优势菌群。在化学药剂和多黏类芽胞杆菌的3种处理中酸杆菌门和绿弯菌门菌群的丰度远高于对照, 特别是奇古菌门菌在化学药剂处理中的丰度极显著高于多黏类芽胞杆菌和对照处理。经多黏类芽胞杆菌处理后发现芽单胞菌门和芽单胞菌属远高于对照, 分别为7.35%(JC)、0.11%(JD)。研究结果表明: 施用多黏类芽胞杆菌不仅可以有效防治辣椒疫病, 还可以改变辣椒根际土壤微生物区系, 提高土壤中细菌种群的多样性。
关键词 辣椒疫病; 多黏類芽胞杆菌; 微生物群落结构; 微生物多样性
中图分类号: S476 文献标识码: A DOI: 10.16688/j.zwbh.2018463
Abstract Bacillus polymyxa showed high activity in controlling pepper blight. The effect of the strain on bacterial microbes in the rhizosphere of pepper was studied. The rhizosphere bacteria of pepper treated by B. polymyxa 109 cfu/g WP, azoxystrobin 25% SC, metalaxyl-M· mancozeb 68% WG and the control were collected, and the diversity and community structure of the rhizosphere bacterial population were analyzed by Illumina Miseq sequencing technology. The diversity of rhizosphere bacteria of the pepper treated with B. polymyxa was the highest, and the diversity of rhizosphere bacteria of the pepper treated with chemical agents was also higher than that of the control. The bacterial populations included 13 phyla such as Proteobacteria, Thaumarchaeota, Acidobacteria, Chloroflexi and Actinobacteria. Proteobacteria was the most dominant phylum. The abundance of Proteobacteria was as high as 70.65% in the control (JD), but decreased in the treatments of azoxystrobin (JA), Metalaxyl-M mancozeb WG (JB) and B. polymyxa (JC), which was 24.41%, 25.64% and 34.95%, respectively. In the three treatments of chemical agent and B. polymyxa, the abundances of Acidobacteria and Chloroflexi were much higher than that of the control. In particular, the abundance of Thaumarchaeota in the treatment with chemical agent was extremely higher than that with B. polymyxa and the control. After treatment with B. polymyxa, the abundance of Gemmatimonadetes was 7.35% higher than that of the control. B. polymyxa as a biological pesticide can improve bacterial species abundance in plant rhizosphere soils and make a great contribution to the prevention of Phytophthora blight.
Key words pepper Phytophthora blight; Bacillus polymyxa; microbial community structure; microbial diversity
辣椒疫病是由辣椒疫霉菌Phytophthora capsici引起的土传性病害[1], 该病害可造成辣椒成片死亡, 甚至绝收[2-3]。我国是辣椒生产大国[4], 辣椒疫病的发生, 严重影响了辣椒的产量及品质, 制约了经济的发展[5]。辣椒疫病的传播途径多样, 在高温高湿条件下暴发尤为严重, 传统的化学药剂防治难以奏效, 使用多样化的防治方法才能从根本上解决问题。结合目前国内外研究发现, 防治辣椒疫病的主要措施包括改良传统的辣椒栽培方式[6-7];改良肥料、灌溉方式、栽培措施、种植结构等以提升辣椒的抗病性, 抑制病原菌的传播繁殖, 促进辣椒的生长, 以达到减少或推迟病害发生的目的。
相对于传统的化学药剂防治, 生物防治可以有效地控制辣椒疫病的发生[8], 并且污染小甚至无污染, 具有广阔的发展前景。目前已知部分真菌[9-10]、细菌[11-12]、放线菌[13-14]及植物提取物[15]等对辣椒疫病具有有效的拮抗作用。微生物农药是生物防治的主力军, 随着我国科研水平的不断发展, 越来越多的微生物农药被应用于防治辣椒疫病。本研究的多黏类芽胞杆菌Bacillus polymyxa是一种产芽胞的G+细菌, 对人或动物没有致病性并可以产生多肽抗生素、拮抗蛋白、酶、絮凝剂、植物激素等多种活性物质, 既有生物农药又有生物菌肥的功效, 已广泛应用于农业[16]、工矿业[17]、废水处理[18]等多方面。文鳳云等通过筛选获得的一株具有广谱抗菌活性的多黏类芽胞杆菌Dw-6[19]。伍明俊等发现,多黏类芽胞杆菌JW-725菌株的发酵液具有很强的抗真菌活性[20]。周华强等采用加热法从多黏类芽胞杆菌LM-3菌株的发酵液中纯化到一个极端噬热多肽(APPLM3), 它对稻瘟病菌表现出很强的拮抗活性[21]。以上研究表明多黏类芽胞杆菌能分泌大量的活性物质, 对许多细菌和真菌有抑制活性, 可以提高植物的抗病能力,促进生长,提高产量, 是行之有效的生防菌。
土壤微生物与作物之间存在着相互作用, 根际土壤中的微生物受到根系的影响在数量、种类方面均有不同, 反之根系的生长发育也会受到根际土壤微生物的影响。本文通过对辣椒根际土壤微生物的16S rDNA进行测序, 探究多黏类芽胞杆菌对辣椒疫病的防治效果以及多黏类芽胞杆菌对辣椒根际细菌的影响, 有助于明确根部病害与微生物生态的关系, 为进一步研究多黏类芽胞杆菌对辣椒疫病的抗病机制提供新的研究思路。
1 材料与方法
1.1 供试材料
供试辣椒品种为‘湘研15。供试药剂: 25%嘧菌酯悬浮剂由江苏龙灯化学有限公司提供,109 cfu/g多黏类芽胞杆菌可湿性粉剂由浙江省桐庐汇丰生化化工有限公司提供,68%精甲霜·锰锌水分散粒剂由先正达(中国)投资有限公司生产。
1.2 试验方法
1.2.1 试验地点
试验于2017年5-9月在湖南省长沙市长沙县廊梨镇花园村进行, 试验田常年种植辣椒,且辣椒疫病发生严重,平均发病率高达50%以上。
1.2.2 试验设计
试验共设置4个处理: 25%嘧菌酯SC、68%精甲霜·锰锌WG、109 cfu/g多黏类芽胞杆菌WP和对照(CK)。每处理4次重复, 共计16个小区, 每小区种植辣椒60株, 完全随机区组排列, 试验小区面积为24 m2,日常浇水量每株约为300 mL且各处理不施肥。各处理用药量:25%嘧菌酯SC 60 mL/667 m2, 68%精甲霜·锰锌WG 110 g/667 m2,109 cfu/g多黏类芽胞杆菌WP 560 g/667 m2。
2017年5月13日辣椒(苗期)定植后采用灌根法施药,每株浇药液约300 mL, 药剂浓度:25%嘧菌酯SC 0.12 mL/L,68%精甲霜·锰锌WG 0.22 g/L,109 cfu/g多黏类芽胞杆菌WP 1.12 g/L。6月20日上午采集辣椒(始花期)根际土壤样品, 每处理4次重复使用五点取样法随机选取采样点,将辣椒整株铲起,利用抖土法采集根际土样, 混匀, 放入无菌自封袋中, 放置在冷藏箱中, 立即带回实验室, 放入-80℃冰箱保存。
1.3 样品处理
以FastDNA SPIN Kit for soil试剂盒(MP Biomedicals, 美国), 提取样品总DNA。使用1%琼脂糖凝胶电泳检测土壤样品总DNA, 样品浓度和纯度采用NanoDrop 2000 (Thermo Scientific, 美国)测定, 纯度A260/A280值在1.8~2.0之间, -20℃冰箱保存。以样品DNA为模板, 利用细菌16S rDNA基因的通用引物515F(5′-GTGCCAGCMGCCGCGGTAA-3′)和806R (5′-GGACTACHVGGGTWTCTAAT-3′)PCR扩增V4区。反应体系等参考文献[22],PCR纯化产物送至安诺优达公司进行后续高通量测序。
1.4 病害调查
施药后每日观察辣椒疫病的发病情况,观察叶片是否有明显病斑或植株是否猝倒, 15 d后对辣椒疫病进行病害调查并分级, 计算发病率和病情指数[23]。
每小区随机调查5个点,每点调查5株,记录病株数、死株数或明显枯萎的植株数。调查时,发病程度分级标准 (按症状类型分级,以每株辣椒叶片为计量单位)如下,0级:健康无症;1级:地上部仅叶、果有病斑;3级:地上茎、枝有褐腐斑;5级:茎基部有褐腐斑;7级:地上茎、枝与茎基部均有褐腐斑,并且部分枝条枯死;9级:全株枯死。
病情指数=[∑(各级病株数×相对级数值)/(调查总株数×最高级数值)]×100;
相对防效=(空白对照病情指数-处理病情指数)/空白对照病情指数×100%。
1.5 数据分析
通过Galaxy平台及其集成软件(http:∥rccc.ou.edu)完成对数据的原始分析。用FLASH程序(version 1.0.0)[24]对所有序列进行拼接, 通过bracode标记将序列分配到单独样品中。采用U-chime(version USEARCH 5.2.3)[25]去除嵌合序列。用UPARSE[26]程序划分OTU, 在序列相似度水平97%下对序列进行整合。通过RPD-Classifer软件完成样品序列的分类注释, 置信度参数设为50%。一般认为遗传距离小于3%的序列对应微生物属于同一物种。用Mothur软件构建稀释曲线评估各样品间的测序强度的差异。通过Chao1、香农指数多样性(Shannon index)、辛普森指数多样性(Simpson index)评估序列文库的多样性。通过非参数检验方法Adonis以及PCoA等分析不同处理间辣椒根际细菌群落结构的差异性。
2 结果与分析
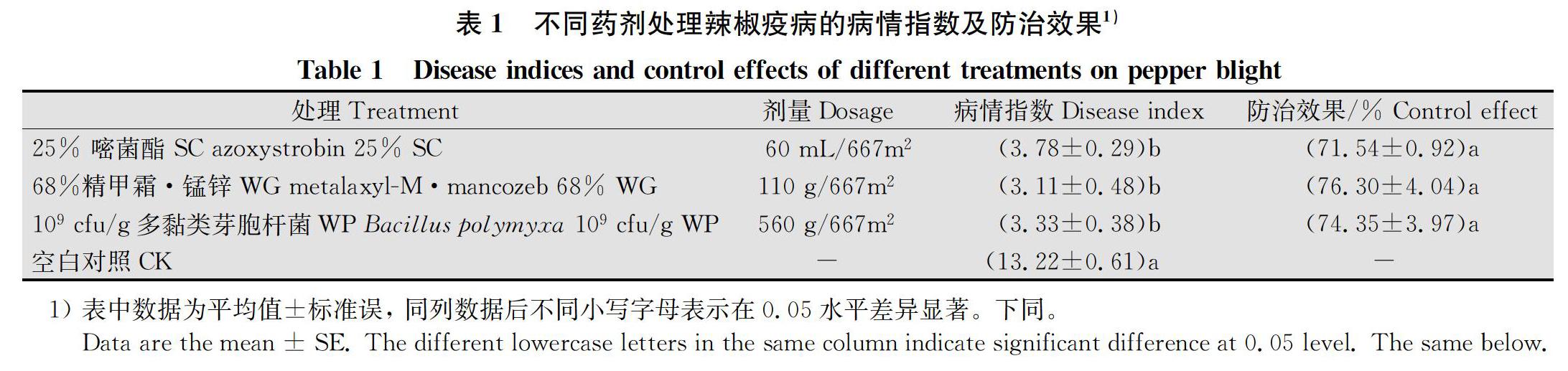
2.1 病情指数及防治效果
在常年多发辣椒疫病的土壤条件下, 68%精甲霜·锰锌WG 110 g/667 m2对辣椒疫病的田间防治效果最好,为76.3%, 其次是109 cfu/g多黏类芽胞杆菌WP 560 g/667 m2, 最后是25%嘧菌酯SC 60 mL/667 m2,后2种药剂防效分别为74.35%和71.54%,三者差异不显著(表1)。68%精甲霜·锰锌WG与109 cfu/g多黏类芽胞桿菌WP防治效果相差较小, 这说明多黏类芽胞杆菌已经达到与化学农药同等的效果,对此进行了进一步的分析。
2.2 高通量测序数据预处理结果
本研究通过高通量测序, 经过Galaxy网站处理得到有效测序数据, 在序列相似度97%水平下划分OTU, 共得到734 242个OTU。如图1所示, 各样品的稀释曲线已经趋于平缓, 即样本的OTU的覆盖度已基本饱和, 基本表明测序深度已经包含样品中所有物种, 测序数据量达到反应样品中物种多样性的需求。
2.3 α多样性分析
α多样性指数分析是指对单个样品中物种的多样性进行分析。丰富度指数Chao1反映了样品的丰富程度, 数值越高代表群落中物种的多样性越高。Shannon和Simpson指数, 二者同样反映样品的多样性程度,Shannon数值越高表示群落中物种的多样性越高,Simpson指数相反,数值越低说明群落中物种多样性越高,Inv_Simpson指数则同Shannon指数一样数值越高表示群落中物种的多样性越高。如表2所示, 多黏类芽胞杆菌(560 g/667 m2)处理下辣椒根际Chao1最高, 变化范围为3 517~3 604.8。根据图1可知, 经过多黏类芽胞杆菌处理后,样品的物种多样性高于其他3个处理。同时样品的Shannon、Inv_Simpson指数大小分别为多黏类芽胞杆菌(560 g/667 m2)>68%精甲霜·锰锌WG(110 g/667 m2)>25%嘧菌酯SC(60 mL/667 m2)>空白对照, 表明多黏类芽胞杆菌(560 g/667 m2)处理后群落中物种的多样性最高,且显著高于对照组。病情指数和α多样性相关性结果表明,病情指数与细菌α多样性呈显著负相关(表3)。
2.4 β多样性分析
β多样性是指利用各样本序列间的进化关系及丰度信息来计算样本间的距离,反映样本(组)间是否具有显著的微生物群落差异。
PCoA结果(图2)表明空白对照所处象限为单独象限, 说明对照组中微生物种群结构与其他3组差异显著; 25%嘧菌酯SC(60 mL/667 m2)与68%精甲霜·锰锌WG(110 g/667 m2)两组处理之间相距较近, 表明这两组处理之间种群结构差异相对较小; 109 cfu/g多黏类芽胞杆菌WP(560 g/667 m2)处理与其他组处理有明显的分离现象, 表明109 cfu/g多黏类芽胞杆菌WP(560 g/667 m2)与25%嘧菌酯SC(60 mL/667 m2)、68%精甲霜·锰锌WG(110 g/667 m2)、空白对照3组种群结构有较大差异。
多重响应置换程序(MRPP)、Adonis分析结果(表4)表明, 在不同处理辣椒根际土壤中细菌群落结构差异显著(P <0.05), 与上述PCoA分析结果一致。
2.5 高通量测序分析土壤菌落结构
通过RDP-Classifier软件对各样品在门分类水平上进行序列鉴定分析, 共得到13个门, 主要包括变形菌门Proteobacteria、奇古菌门Thaumarchaeota、酸杆菌门Acidobacteria、绿弯菌门Chloroflexi、放线菌门Actinobacteria等。变形菌门Proteobacteria在4组样品数据中相对丰度最高, 在样品中相对丰度分别为70.65%(JD)、34.95%(JC)、25.64%(JB)和24.42%(JA), 在JD组中变形菌门相对丰度远高于其他处理(图3)。酸杆菌门Acidobacteria在4组处理中相对丰度分别为19.53%(JA)、16.98%(JB)、12.28%(JC)、0.42%(JD); 绿弯菌门Chloroflexi在4组处理中相对丰度分别为7.70%(JC)、7.38%(JA)、7.13%(JB)、0.92%(JD), 酸杆菌门与绿弯菌门在JD组不属于优势种群, 而在其他3组则属于优势种群(表5)。奇古菌门Thaumarchaeota在4组样品中的相对丰度分别为16.10%(JA)、10.28%(JB)、2.68%(JC)、1.17%(JD), JC组与JD组差异不显著但与JA、JB组差异显著(表5)。放线菌门Actinobacteria的相对丰度在4组样品中分别为13.07%(JD)、11.46%(JC)、7.10%(JA)、4.72%(JB), 放线菌在JA与JB组之间相差较小, JC与JD组间差异较小, 但JB与JD两组间差异显著(表5)。
在屬水平上(OTU相对丰度大于1.5%),亚硝基念珠菌Candidatus Nitrosotalea在JA组和JB组相对丰度分别达到12.04%(JA)和8.91%(JB),而在其他2组的相对丰度分别为1.06%(JC)、0.01%(JD),相对丰度远高于其他2组处理(表 6)。未培养的森林土壤细菌uncultured forest soil bacterium在4组中的相对丰度分别为10.06%(JA)、6.84%(JB)、6.27%(JC)、0%(JD),表明其在JD组中不属于优势地位, 而在其他3组中属于优势地位(表6)。芽单胞菌属Gemmatimonas在JC组中属于优势地位,相对丰度为1.76% (JC),在JA组和JB组的相对丰度分别为1.21%(JA)、1.54%(JB),而在JD组中的相对丰度为0.04%,表明其在JD组中不属于优势地位(表6)。
3 讨论
本试验中同一处理下样品之间差异较小, 经β多样性分析可知在相同处理下的各样品间相似性明显大于不同处理之间的微生物群落结构的相似性, 这表明该数据具有可信性, 分析结果正常合理。经过分析发现, 在多黏类芽胞杆菌处理后的辣椒根际微生物群落的Chao1指数以及Shannon指数均高于其他三种处理, 结果表明多黏类芽胞杆菌处理后辣椒根际微生物群落和生物多样性明显提高, 基本符合Setl与Mc Lean[27]所阐述的生物多样性越高生态系统稳定性越高的理论, 这有助于进一步研究多黏类芽胞杆菌对辣椒疫病的抗病机制。
本研究对4组不同处理下辣椒根际土壤进行了菌群结构多样性分析, 高通量测序结果共鉴定到13个门, 主要包括变形菌门Proteobacteria、奇古菌门Thaumarchaeota、酸杆菌门Acidobacteria、绿弯菌门Chloroflexi、放线菌门Actinobacteria等, 其中优势种群为Proteobacteria (38.91%)、Acidobacteria(12.30%)、Actinobacteria(9.08%)。Fierer和Jackson[28]的研究发现此三类菌群在所有的生物群中均占优势地位, 与本试验具有一致性, 但是在相对丰度上存在一定的差异。
我们进行了多黏类芽胞杆菌与化学药剂68%精甲霜·锰锌WG、 25%嘧菌酯SC对辣椒疫病防治效果的调查, 结果表明多黏类芽胞杆菌(560 g/667 m2)对辣椒疫病的防治效果显著(表1)。伍明俊[20]、姚乌兰[29]、王光华[30]等研究发现多黏类芽胞杆菌筛选出的菌株具有很强的抗真菌活性。岑浴[31]研究表明多黏类芽胞杆菌的施用可以引起部分绿弯菌门Chloroflexi群落的增加。汪涛等[32]研究了多黏类芽胞杆菌对辣椒疫霉的防治效果, 但未对发病植株根际土壤微生物进行多样性分析, 没有涉及种群结构的研究。
研究发现, 经化学药剂68%精甲霜·锰锌WG、25%嘧菌酯SC处理后的辣椒根际微生物多样性都有所提高, 其原因可能是这两种药剂与辣椒根际微生物种群之间存在复杂的相互关系(如竞争、偏利、偏害等), 也可能是这两种药剂在一定程度上改变了辣椒根际微生物群落中原有的种群关系, 导致其中某些细菌种群有所降低,从而使辣椒根际微生物种群多样性增加。
试验运用高通量测序技术对样品进行了微生物种群多样性分析, 有助于探明多黏类芽胞杆菌对辣椒疫病微生态的影响, 本试验初步研究了多黏类芽胞杆菌对辣椒疫霉的防治效果及辣椒根际微生物结构变化, 但是具体机制以及原理仍未明确, 有待进一步研究。
参考文献
[1] LEONIAN L H. Stem and fruit blight of peppers caused by Phytophthora capsici sp. nov [J]. Phytopathology, 1922, 12(9): 401-408.
[2] GRANKE L L, QUESADA-OCAMPO L, LAMOUR K, et al. Advances in research on Phytophthora capsici on vegetable crops in the United States [J]. Plant Disease, 2012, 96(11): 1588-1600.
[3] GRANKE L L, QUESADA-OCAMPO L M, HAUSBECK M K. Variation in phenotypic characteristics of Phytophthora capsici isolates from a worldwide collection [J]. Plant Disease, 2011, 95(9): 1080-1088.
[4] 梅映雪. 辣椒栽培新技术及病虫害防治分析[J]. 北京农业, 2015, 26(6): 40-41.
[5] SOPHEARETH M, CHAN S, NAING K W, et al. Biocontrol of late blight (Phytophthora capsici) disease and growth promotion of pepper by Burkholderia cepacia MPC-7 [J]. The Plant Pathology Journal, 2013, 29(1): 67.
[6] FRSTER H, ADASKAVEG J E, KIM D H, et al. Effect of phosphite on tomato and pepper plants and on susceptibility of pepper to Phytophthora root and crown rot in hydroponic culture [J]. Plant Disease, 1998, 82(10): 1165-1170.
[7] XIE Jinhui, CARDENAS E S, SAMMIS T W, et al. Effects of irrigation method on chile pepper yield and Phytophthora root rot incidence [J]. Agricultural Water Management, 1999, 42(2): 127-142.
[8] 司美茹, 薛泉宏, 余博, 等. 辣椒疫霉菌生防菌的双重筛选[J]. 植物保护学报, 2006, 33(1): 41-46.
[9] ROBERTS D P, MAUL J E, MCKENNA L F, et al. Selection of genetically diverse Trichoderma spp. isolates for suppression of Phytophthora capsici on bell pepper [J]. Canadian Journal of Microbiology, 2010, 56(10): 864-873.
[10] 刘永亮,尹成林,田叶韩,等.拮抗真菌HTC的鉴定及其对辣椒疫病的生物防治潜力[J].植物保护学报, 2013, 40(5): 437-444.
[11] KIM H S, SANG M K, JUNG H W, et al. Identification and characterization of Chryseobacterium wanjuense strain KJ9C8 as a biocontrol agent of Phytophthora blight of pepper[J]. Crop Protection, 2012, 32: 129-137.
[12] SANG M K, KIM K D. Plant growth-promoting rhizobacteria suppressive to Phytophthora blight affect microbial activities and communities in the rhizosphere of pepper (Capsicum annuum L.) in the field [J]. Applied Soil Ecology, 2012, 62: 88-97.
[13] KIM H S, SANG M K, JEUN Y C, et al. Sequential selection and efficacy of antagonistic rhizobacteria for controlling Phytophthora blight of pepper [J]. Crop Protection, 2008, 27(3-5): 436-443.
[14] 李永强,杨建飞,张平,等.2株塔里木盆地土壤放线菌发酵产物抑菌作用初探[J].西南大学学报(自然科学版),2010(5):83-87.
[15] KHAN M A, CHENG Zhihui, XIAO Xuemei, et al. Ultrastructural studies of the inhibition effect against Phytophthora capsici of root exudates collected from two garlic cultivars along with their qualitative analysis [J]. Crop Protection, 2011, 30(9): 1149-1155.
[16] 李畅方,罗时华,何强,等.康地蕾得防治番茄青枯病药效试验[J].广东农业科学,2003(6):38-39.
[17] 李卫芬,陆平,周绪霞.多黏类芽胞杆菌β-葡聚糖酶特性及其基因克隆[J].浙江大学学报(农业与生命科学版),2004,30(3):331-335.
[18] PATRA P, NATARAJAN K A. Surface chemical studies on selective separation of pyrite and galena in the presence of bacterial cells and metabolic products of Paenibacillus polymyxa[J]. Journal of Colloid and Interface Science, 2006, 298(2): 720-729.
[19] 文凤云, 董淑丽, 李晓丽, 等. 多黏芽孢杆菌 Dw-6 抗革兰氏阳性菌多肽的分离纯化及抑菌活性机理[J]. 江苏农业科学, 2011 (3): 408-411.
[20] 伍明俊, 金丹, 李晖, 等. 抗真菌菌株 JW-725 的分离, 鉴定及发酵产物性质的初步分析[J]. 四川大学学报(自然科学版), 2003, 40(5): 945-948.
[21] 周华强,谭芙蓉,周颖,等.多黏类芽胞杆菌极端嗜热多肽的纯化及性质研究[J].现代农药,2007,6(3):40-43.
[22] 罗路云,金德才,左晖,等.沼澤红假单胞菌PSB06对辣椒根际微生物群落结构的影响[J].环境科学,2017,38(2):735-742.
[23] 王进强,许文耀,朱巧玲,等.56%氢氧化铜·烯酰吗啉可湿性粉剂对辣椒疫病的防治效果[J].亚热带农业研究,2006,2(1):37-40.
[24] MAGO C ˇ T, SALZBERG S L. FLASH: fast length adjustment of short reads to improve genome assemblies [J]. Bioinformatics, 2011, 27(21): 2957-2963.
[25] EDGAR R C, HAAS B J, CLEMENTE J C, et al. UCHIME improves sensitivity and speed of chimera detection [J]. Bioinformatics, 2011, 27(16): 2194-2200.
[26] EDGAR R C.UPARSE: highly accurate OTU sequences from microbial amplicon reads [J]. Nature Methods, 2013, 10(10): 996-998.
[27] SETL H, MC LEAN M A. Decomposition rate of organic substrates in relation to the species diversity of soil saprophytic fungi [J]. Oecologia, 2004, 139(1): 98-107.
[28] FIERER N, JACKSON R B. The diversity and biogeography of soil bacterial communities [J]. Proceedings of the National Academy of Sciences of the United States of America, 2006, 103(3): 626-631.
[29] 姚乌兰,王云山,韩继刚,等.水稻生防菌株多粘类芽孢杆菌WY110抗菌蛋白的纯化及其基因克隆[J].遗传学报,2004,31(9):878-887.
[30] 王光华,周克琴,金剑,等.生防微生物BRF-1对大豆根腐病的拮抗作用[J].大豆科学,2004,23(3):188-191.
[31] 岑浴.多粘类芽孢杆菌在茶叶上的定殖及其对叶际细菌群落的影响[D].石家庄:河北科技大學,2016.
[32] 汪涛,迟元凯,赵伟,等.多粘类芽孢杆菌TC35的鉴定及对辣椒疫病的田间防效[J].安徽农业科学,2018,46(4):138-139.
(责任编辑: 田 喆)
