丙氨酸氨基转移酶异常与高尿酸血症对高脂血症的交互作用*
2020-06-08翟文海李雪梅汪鋆植
翟文海, 李雪梅, 汪鋆植
三峡大学校医院保健科(湖北宜昌 443002)
高脂血症是导致动脉粥样硬化的重要因素之一,也是冠心病和缺血性脑卒中的独立危险因素[1]。随着人民生活水平提高、饮食习惯改变,我国居民高脂血症和代谢综合征(MS)其他组分(如高血压、肥胖及高血糖) 的发生率都逐年升高,且有年轻化趋势,严重危害人们的生命健康。高尿酸血症(HUA)是痛风发生的生化基础,与血脂代谢密切相关[2]。丙氨酸氨基转移酶(ALT)水平随着血脂浓度的增加而显著升高,可作为预测高脂血症患者肝功能损害的灵敏性指标。临床上无症状ALT升高的首要病因是非酒精性脂肪肝病(NAFLD),HUA与脂肪肝特别是NAFLD密切相关,NAFLD可能是MS在肝脏的表现[3],且都能增加MS危险性,但目前很少有关于ALT异常和HUA的交互作用对高脂血症影响的研究。本研究分析两者的交互作用,为高脂血症高危人群的有效干预提供依据。
1 资料与方法
1.1 一般资料 选择2018年3—11月在宜昌市第二人民医院进行健康体检的资料完整者为研究对象,排除严重肝肾损害、恶性肿瘤、自身免疫性疾病、甲状腺功能减退及血糖控制正常的糖尿病患者,共计5 155例,年龄28~86岁,平均(50.22±13.4)岁。其中男2 875例,年龄(51.25±14.9)岁;女2 280例,年龄(47.78±13.4)岁。
1.2 资料收集 由经过统一培训的调查员进行现场问卷调查,调查内容包括慢性肝病、肾病、高血压、糖尿病、恶性肿瘤病史、近期是否过量饮酒和劳累。专业医务人员做身高、体重、血压等体格检查。
1.3 生化指标检测及肝胆B超检查 研究对象清晨空腹采取静脉血,使用日立7600全自动生化分析仪检测生化指标,包括UA、空腹血糖、三酰甘油(TG)、总胆固醇(TC)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)、ALT及天冬氨酸氨基转移酶(AST)、总蛋白、白蛋白、总胆红素(TBIL)、直接胆红素(DBIL),用Randox质控品进行室内质控,定期参加临检中心室间质评结果均良好。同时由固定的超声专科医师行肝胆B超检查。
1.4 指标定义 体质指数=体重(kg)/身高平方(m2)。非高密度脂蛋白胆固醇(non-HDL-C)=TC-HDL-C。高脂血症诊断标准参照2007年中国成人高脂血症防治指南标准:以TC≥6.22 mmol/L、TG≥2.26 mmol/L、LDL-C≥4.14 mmol/L、HDL-C<1.04 mmol/L为异常,这4项出现任何1项即诊断为高脂血症。以3次测量收缩压平均值≥140 mmHg(1 mmHg=0.133 kPa)和(或)舒张压≥90 mmHg或近2周内服降压药血压正常者为高血压。体质指数≥24.0 kg/m2为超重或肥胖。UA≥420 μmol/L(男性)或≥357 μmol/L(女性)为HUA。空腹血糖≥6.1 mmol/L为高血糖,以ALT>40 U/L、AST>40 U/L为异常。
1.5 统计学方法 应用SPSS 18.0统计软件,符合正态分布的计量资料用表示,组间差异以t检验比较,偏态分布资料采用M(P25,P75)描述,组间比较采用秩和检验。计数资料组间比较应用2检验。相关性采用Pearson分析,使用非条件logistic回归模型对危险因素交互作用进行分析,以比值比(OR) 表示疾病危险性,计算交互作用指数(S)、超相对危险比(RERI)、归因比(AP),纯因子归因交互效应百分比为[AP*(AB)],交互作用的分析使用相加模型[4]。相乘交互作用的分析是将危险因素的乘积项放入logistic 回归模型。以P<0.05为差异有统计学意义。
2 结果
2.1 ALT和UA与血脂各项相关性分析 5 155例体检者共检出高脂血症1 542例(29.91%),4单项血脂异常分别检出(异常率):TG 756例(14.67%)、TC 943例(18.29%)、HDL-C 160例(3.10%)、LDL-C 625例(12.12%);ALT与这血脂4项及non-HDL-C相关系数(r)分别为0.252、0.151、-0.073、0.166、0.191,P值均<0.001;UA与这4项及non-HDL-C相关系数(r)分别为0.420、0.183、-0.253、0.199、0.285,P值均<0.001,ALT和UA均与TG、TC、LDL-C及non-HDL-C呈正相关,与HDL-C呈负相关。
2.2 两组人群生化和临床指标的比较 将1 542例高脂血症者作为病例组,在3 613例血脂正常者中取年龄、性别与病例组相匹配的1 349例作为对照组,结果提示病例组总蛋白、白蛋白水平及HUA、ALT异常、AST异常、高血糖、超重或肥胖、高血压、脂肪肝的百分率均高于对照组,TBIL、DBIL水平均低于对照组,差异有统计学意义(P<0.001),显示高脂血症存在多种代谢紊乱。见表1。
2.3 ALT异常及HUA对高脂血症的相加交互作用分析 5 155例中HUA人群高脂血症患病率63.0%(170/269)高于UA正常人群29.0%(1 417/4 886),差异有统计学意义(2=139.92,P<0.001);ALT异常人群高脂血症患病率54.1% (267/494)高于ALT正常人群26.9%(1 254/4 661),差异有统计学意义(2=158.23,P<0.001)。以是否患高脂血症为因变量(否=0,是=1),所选择的研究因素为自变量,分类变量进行哑变量处理,其余变量按照专业知识赋值。单因素logistic回归分析结果:ALT异常和HUA并存时患高脂血症的风险是正常ALT和UA者的15.65倍,差异有统计学意义(P<0.001),大于两因素单独存在(2.84和3.24)之和,交互作用定量分析结果:RERI为10.57(95%CI:0.25~20.89)、S为3.59(95%CI: 2.68~4.81)、AP为67.54%、AP*(AB)为72.15%;调整年龄、性别、AST、脂肪肝、高血糖、高血压、超重或肥胖混杂因素后多因素logistic回归分析结果:ALT异常和HUA并存时患高脂血症的风险是正常ALT和UA者的11.93倍,差异有统计学意义(P<0.001),大于两因素单独存在(2.45和2.01)之和,RERI为8.47(95%CI: 0.36~16.56)、S为4.44(95%CI: 1.85~10.65)、AP为70.99%、AP*(AB)为77.49%。见表2。

表1 两组人群生化和临床指标的比较 例(%)
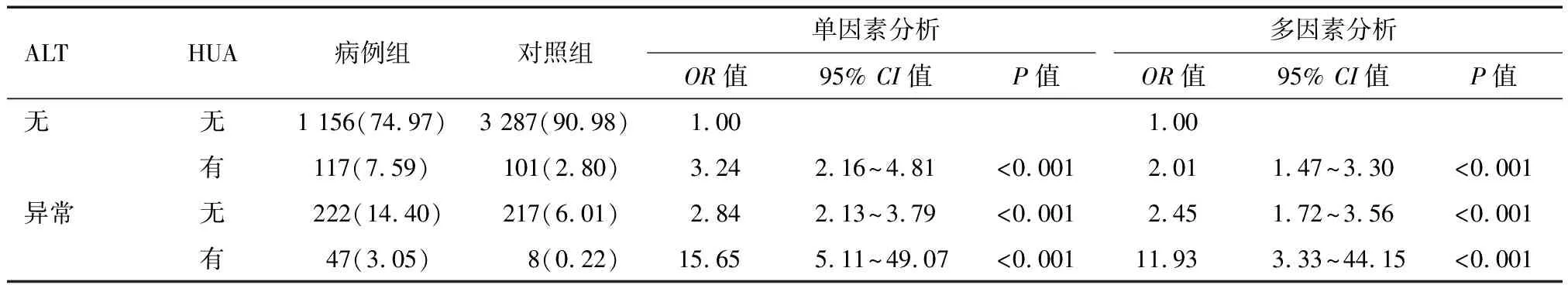
表2 ALT异常及HUA对高脂血症患者的相加交互作用 例(%)
2.4 ALT异常和HUA对高脂血症的相乘交互作用分析 将ALT异常、HUA、ALT异常×HUA放入logistic回归模型中,得到3个变量的OR值、P值。调整年龄、性别、AST、脂肪肝、高血糖、高血压、超重或肥胖等相关变量后,ALT异常、HUA的P值均<0.001,说明ALT异常、HUA各自对高脂血症的发病有影响,但ALT异常×HUA的P值>0.05,说明ALT异常、HUA之间无相乘交互作用,见表3。
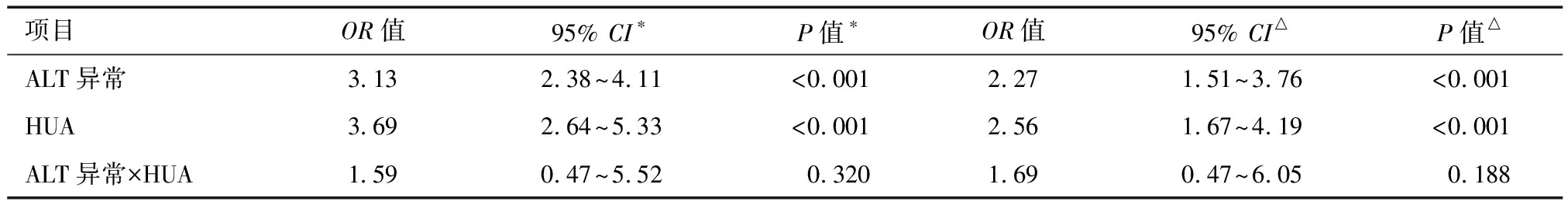
表3 ALT异常及HUA对高脂血症患者的相乘交互作用
注:*无调整变量,△调整年龄、性别、AST、脂肪肝、高血糖、高血压、超重或肥胖
3 讨论
高脂血症是一类人体脂蛋白代谢异常的常见疾病,早期预防和控制具有积极意义。本组资料高脂血症检出率29.91%接近2007年本地区杨少玉等报道的30.47%,低于2012年全国调查结果40.40%和王培等报道的2013—2017年5年间广州地区41.31%[5-6],可能与宜昌市作为中西部中小型城市,快节奏生活中的不良生活方式较广州居民少有关,也可能是与被统计人群的性别、年龄结构不同有关。血脂水平总的趋势是随着年龄的增长, TC、TG及LDL-C呈升高状态,有文献[6]显示高脂血症与腰围增大、超重和肥胖、高血压、高血糖、HUA密切相关,UA和ALT与 TC、TG、LDL-C都存在正相关,与HDL-C都存在负相关[7],本组资料结果与其相符,亦显示高脂血症存在多种代谢紊乱。另外non-HDL-C与UA和ALT相关指数(r)均高于TC、LDL-C、HDL-C,较LDL-C更能全面反映动脉粥样硬化程度,与文献[8]显示的与UA相关指数(r)non-HDL-C(0.413)低于LDL-C(0.478)结果有所区别,可能与本组资料为健康体检人群而不是特定的男性痛风患者有关。
HUA可导致多种组织细胞如脂肪细胞、血管平滑肌细胞、胰岛β细胞等产生氧化应激,引发痛风且与脂肪组织功能障碍、MS的发生发展密切相关[9-10],所引起的脂质代谢紊乱主要表现在TG合成增加、氧化修饰低密度脂蛋白合成增加、脂肪组织炎症。HUA患者体内存在HDL、LDL之间复杂的脂质交换,UA变化对TG影响最大,有研究显示82%高TG患者伴有HUA,而75%~80%HUA患者伴有高TG[11]。在几种HUA动物模型中通过降低UA,可明显降低TG、血压、BMI 等代谢指标水平[12],动脉粥样硬化斑块中也检测到UA浓度可增高5~6倍[13],显示HUA对NAFLD和动脉粥样硬化等疾病的发生具有重要影响。肝脏作为人体最大的腺体在糖脂及激素代谢中起着十分重要的作用,ALT异常不仅能提示肝脏功能的异常变化,还通常作为诊断NAFLD的替代指标[14],本质反映了肝脏脂肪变性和胰岛素抵抗,与炎症、氧化应激的显著相关,可影响肝内脂肪代谢。有研究认为血脂水平与ALT水平及胰岛抵抗有关,ALT能够预测LDL-C水平[15],Schindhelm等[16]随访6年后研究发现,ALT水平较高者发生MS的风险是水平较低者的2.25倍,男性血清ALT水平最高分位组患MS的危险性是最低分位组的4.21倍,女性3.10 倍,ALT升高发生MS及其各组分出现异常的危险性均随之增加[17],即使在正常值范围内,ALT升高也会增加MS的发病率[18],可能成为MS患病风险的一个预测和诊断新指标[19]。
本研究显示HUA、ALT异常人群高脂血症患病率分别高于UA、ALT正常人群,差异有统计学意义(P<0.001),通过logistic回归分析得出,发生高脂血症风险分别是正常UA的3.69倍、3.13倍,调整相关混杂因素后分别为2.56倍、2.27倍,均显示HUA、ALT异常对高脂血症患病率有正相关作用,能造成血脂异常且独立存在,分别符合HUA是TG升高的独立危险因素观点[11]以及ALT异常患者包括血糖血脂代谢紊乱的MS风险高于ALT正常人群的观点[19],表明检测UA、ALT水平或许对防治高脂血症以及MS提供重要依据。同样血脂升高可引起脂质沉积,导致尿酸排泄受阻,增加HUA风险[14],有文献[8]显示男性痛风患者TC、TG、LDL-C、non-HDL-C均为HUA的危险因素,而HDL-C为HUA的保护因素,脂质在肝脏沉积会引起ALT水平的异常升高,HUA、ALT异常都与高脂血症关系密切,相互影响。
研究发现HUA大鼠体内通过刺激肝脏线粒体发生氧化应激生成超氧化物损伤肝细胞[20],HUA可以促进NAFLD的发生及发展,是其独立危险因素[3],所导致的胰岛素抵抗和肝脏的直接损伤可能是导致肝脏转氨酶升高的主要原因。随着UA水平增高和作用时间的延长肝细胞氧化应激作用加强,ALT表达也呈增加趋势,两者呈正相关,成年人ALT升高和HUA互为彼此的独立危险因素[21],并在肝脏病变中起重要作用。本研究控制混杂因素后多因素logistic分析,ALT异常和HUA两因素同时存在时的OR值(11.93)大于单独存在时的OR值(ALT异常为2.45、HUA为2.01),归因于两因素交互作用所致的高脂血症患病率是其他或未知因子发病效应的8.47倍,两因素同时存在时高脂血症风险是单独存在时风险总和的4.44倍,高于两因素单独存在时的风险,差异有统计学意义(P<0.001),显示两因素对高脂血症患者有正向相加交互作用、协同效应。其中有70.99%高脂血症危险性归因于ALT异常和HUA两因素的交互效应,扣除其他因素或未知因子(本研究中)的影响为77.49%。本研究运用相乘模型分析ALT异常和HUA对高脂血症患者的交互作用,结果显示ALT异常和HUA间无相乘交互作用(P>0.05),与相加模型结果不一致。
本研究采用了更具有公共卫生学意义的相加模型探讨ALT异常和HUA对高脂血症的交互作用,显示两者同时存在时可增加高脂血症患病风险,临床防治高脂血症及相关疾病时有必要关注ALT异常和HUA的影响。同时也存在一定的局限性,既往病史以被调查对象自述为主,可能会产生一定回忆偏倚,有些影响人体血脂水平的非常规体检项目,如甲状腺功能指标往往只是出现甲状腺功能亢进或甲状腺功能减退症状才会做检查,难以获得完整资料,还需通过进一步的前瞻性研究来明确它们间的因果关系。
(志谢:感谢宜昌市第二人民医院林文源主任、李海泉医生协助病例调查和收集)
