抗血管生成药物相关蛋白尿研究进展
2020-06-08高文仓
张 超,陶 莹,高文仓
0 引言
血管内皮生长因子(Vascular endothelial growth factor,VEGF)介导的肿瘤血管生成在肿瘤的生长、侵袭和转移中起着至关重要的作用。因此,VEGF信号通路已经成为目前癌症治疗的重点。抗VEGF的靶向药物已被广泛应用于临床各种癌症的治疗,包括结直肠癌、乳腺癌、肺癌、肾细胞癌、卵巢癌、胰腺癌、胃癌等[1]。1971年,Folkman[2]提出抗血管生成作为一种新的抗癌策略。在接下来的15年中,又发现了几种能诱导血管生长的分子,包括成纤维细胞生长因子1(FGF1)、血管生成素和转化生长因子-α(TGFα),但它们在血管生成调控中的作用尚不清楚[3]。1989年,VEGFA的分离和克隆使研究者在理解其机制方面向前迈出重要一步[4]。VEGF是内皮细胞的有丝分裂,并负责新生毛细血管的形成、肿瘤生长和转移。生理VEGF家族由6种生长因子组成,即VEGFA、VEGF-B、VEGF-C、VEGF-D、VEGF-E和PLGF。VEGFR家族包括3个蛋白酪氨酸激酶:VEGFR-1(Flt-1)、VEGFR-2(Flt-1/KDR)和VEGFR-3(Flt-4)。VEGF与VEGFR联合通过P38MAPK、RAF/MEK/ERK和PI3K/PKB信号通路诱导血管生成。鉴于VEGFR-2在信号通路中起着更重要的作用,小分子酪氨酸激酶抑制剂主要针对VEGFR-2[5]。然而,许多患者接受抗血管生成药物治疗后出现了不同程度的蛋白尿,主要包括VEGF抑制剂及酪氨酸激酶抑制剂(TKIs),VEGF抑制剂研究最多的是贝伐珠单抗,TKIs包括阿昔替尼、阿柏西普、索拉非尼、舒尼替尼等都可发生蛋白尿甚至重度蛋白尿[6]。
1 抗血管生成药物及其引起蛋白尿现状
1.1 单克隆抗体
1.1.1 贝伐珠单抗 贝伐珠单抗[7]是一种重组人源化IgG1单克隆抗体,VEGF是在肿瘤血管新生过程中起调控作用的细胞因子,可促进血管内皮细胞增殖,从而促进新生血管的生成,对肿瘤细胞的生存、生长和远处转移起重要作用[1]。抗VEGF治疗可显著改善肾癌和其他晚期恶性肿瘤患者的预后,但可能伴有蛋白尿。一项Meta分析对72项已发表的临床试验进行了综合分析,其中贝伐珠单抗组21 902例,对照组20 608例;所有等级和高等级的蛋白尿发病率分别为18%和2.4%;与对照组相比,全等级风险显著增加(RR=3.595)[1]。
1.1.2 雷莫芦单抗 雷莫芦单抗是通过VEGFR-2表达的内皮细胞选择性地与VEGFA、C、D结合,在肿瘤血管生成和增殖中起重要作用[8]。雷莫芦单抗被批准用于胃癌、肺癌和结肠直肠癌的二线治疗。一项Meta分析共纳入4 996例接受治疗的患者(雷莫芦单抗组2 748例,安慰剂组2 248例),结果雷莫芦单抗组有259例(9.4%)、安慰剂组有70例(3.1%)患有所有等级的蛋白尿(RR=3.4);雷莫芦单抗组31例(1.1%)患者发生3级蛋白尿(仅1例4级,无5级事件),对照组1例(0.04%);27例(1.0%)患者因蛋白尿而停用研究药物,另有1例(0.04%)患者因蛋白尿停用研究药物[9]。
1.2 小分子酪氨酸激酶抑制剂(TKI)
1.2.1 阿帕替尼 阿帕替尼是一种新型的口服小分子TKI,选择性地抑制VEGFR-2,阻断VEGF结合下游的信号通路,强烈抑制肿瘤血管形成。于2014年在中国获得批准,用于胃癌的后续治疗。最近的临床试验显示了其广谱抗癌作用[5]。在一项包括820例癌症患者的Meta分析中,所有等级蛋白尿和高等级蛋白尿的发生率分别为45.1%和3.7%;阿帕替尼组与安慰剂组比较,所有等级蛋白尿的RR(2.62)均升高[10]。
1.2.2 帕唑帕尼 帕唑帕尼是一种针对VEGFR-1/-2/-3,血小板衍生生长因子受体(PDGFR)-α/-β和干细胞因子受体c-Kit的口服血管生成抑制剂[11]。在使用帕唑帕尼或舒尼替尼的1 392例转移性肾癌患者中,所有等级和高等级蛋白尿的发生率分别为15.0%和3.7%[12]。
1.2.3 索拉非尼 索拉非尼是一种抑制肿瘤血管生成和细胞增殖的多激酶抑制剂,已被至少8个主要指南推荐为治疗中、晚期肝癌的金标准[13]。研究显示,服用索拉非尼后出现所有等级蛋白尿的发生率为11.6%,高等级蛋白尿的发生率为0.9%[14]。
1.2.4 呋喹替尼 呋喹替尼是一种口服、有效和高选择性的VEGFR-1/-2/-3小分子抑制剂,2018年9月,呋喹替尼在中国获得了第1个全球批准,用于治疗至少2次既往全身性抗肿瘤治疗失败患者的转移性结直肠癌[15]。一项呋喹替尼临床试验共纳入415例接受治疗的患者(呋喹替尼组278例,安慰剂组137例),呋喹替尼组有117例(42.1%)、安慰剂组有34例(24.8%)患有所有等级的蛋白尿;9例(3.2%)患者发生3~4级蛋白尿,安慰剂组0例[16]。
1.2.5 瑞戈非尼 瑞戈非尼是一种口服多激酶抑制剂,可阻断许多与血管生成、肿瘤发生和肿瘤微环境相关的蛋白激酶的活性(来源生长因子受体和成纤维细胞生长因子受体)。于2012年9月被美国食品和药物管理局批准用于在标准治疗中取得进展的转移性结直肠癌[17-18]。一项瑞戈非尼临床试验中纳入656例患者接受治疗(瑞戈非尼组435例,安慰剂组221例),瑞戈非尼组有9例(2%)、安慰剂组有2例(<1%)患者出现所有等级的蛋白尿,3例(<1%)患者出现3~4级蛋白尿,安慰剂组1例(<1%)[17]。
还有一种比较特殊的抗血管靶向药物阿柏西普,它是一种重组融合蛋白,由细胞外结构域组成,来自VEGFR-1和VEGFR-2与人IgG1的Fc区融合[19]。它是与VEGFA、VEGF-B和PIGF(胎盘生长因子)结合的循环拮抗剂,随后阻止其与VEGFR-1和VEGFR-2的相互作用(VEGFR-1和VEGFR-2是比贝伐珠单抗更有效的VEGF阻断剂)。目前被批准用于转移性结直肠癌患者的二线治疗[19]。来自16个前瞻性临床试验的4 596例各种实体肿瘤患者的Meta分析中,所有等级和高等级蛋白尿的总体发生率分别为33.9%(95%CI:27.3%~42.1%)和7.9%(95%CI:6.1%~10.2%),与对照组相比,其蛋白尿的RR均增加[20]。在转移性肾癌(NCT 02072044)患者服用安罗替尼的研究中,不良反应出现蛋白尿占35.7%[21]。在使用以下短语查询数据库:蛋白尿和抗-VEGF或VEGF抑制或贝伐珠单抗、舒尼替尼、索拉非尼或阿昔替尼或帕唑帕尼,对所确定的每一条参考资料进行仔细审查,发现轻度和无症状性蛋白尿的发病率为21%~63%(见表1),但有报道,多达6.5%的肾癌患者出现了大量蛋白尿[22]。抗血管靶向药物治疗后出现蛋白尿是一个不可忽视的不良反应,需要进一步探索服用抗血管靶向药物引起蛋白尿的机制。
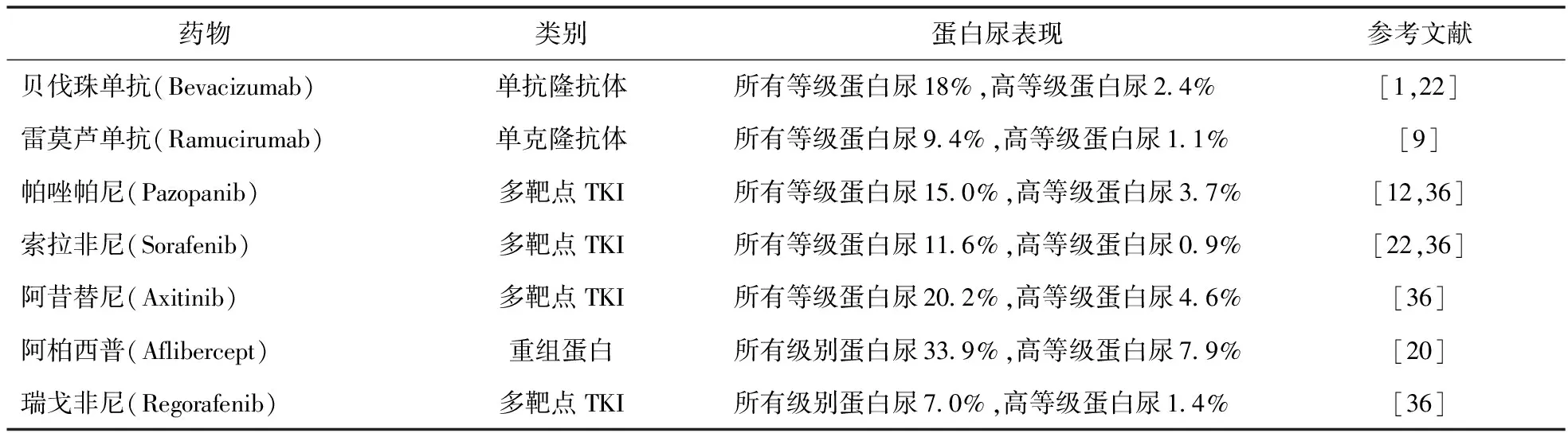
表1 常见VEGF抑制剂的蛋白尿表现
注:美国国家癌症研究所通用毒性标准(NCI CTC,版本号:4.0)将VEGF抑制剂相关蛋白尿严重程度分为:1级(尿蛋白<1 g/24 h)、2级(1.0~3.0 g/24 h)、3级(>3.5 g/24 h)。高等级蛋白尿≥3级
2 抗血管生成靶向药物导致蛋白尿的可能机制
2.1 内皮损伤 目前,VEGF抑制剂可根据其在VEGFA-VEGFR-2通路中的作用靶点进行分类:与VEGFA结合的药物,阻断剂VEGFA,抑制受体酪氨酸激酶(RTK)或抑制下游的药物。血浆在肾小球滤过屏障处的毛细血管床中发生,由3层组成:内皮细胞、基底膜、内脏上皮细胞或足细胞的足突[23]。在肾脏中,VEGFA主要由足细胞和肾小管上皮细胞表达,VEGFA过度表达或减少与多种肾小球疾病的关系表明,肾脏VEGFA信号的严格调控对肾小球疾病及体内平衡与疾病中肾小球成熟功能的发育与维持至关重要。VEGF还可以促进血管内皮细胞增殖和新生血管的形成,足细胞分泌VEGF减少对肾小球内皮细胞的损伤。研究表明,VEGF抑制剂可导致足细胞和裂孔隔膜损伤,这都可能引发蛋白尿的产生[23-24]。当VEGF受到了抑制,对内皮细胞的保护作用降低,可使肾小球滤过通透性增高、重吸收能力降低,最终导致蛋白尿[25]。
2.2 干扰足细胞-内皮VEGF轴信号 VEGFA-VEGFR-2信号转导抑制作用因治疗靶点不同而有不同的下游效应。在抗VEGF受体治疗过程中,足细胞分泌的VEGFA被隔离,阻断了与足细胞或内皮细胞VEGFR-2结合[26]。所以TKIs治疗可使VEGFA与肾小球内皮细胞和足细胞VEGFR-2结合,并抑制下游信号,这可以使胞质中的再灌注和足细胞中c-mip的过表达,导致细胞骨架的改变,从而发生肾病综合征[6]。抑制下游通路RAF/MAPK/ERK与肾小管间质损伤密切相关[27-28]。抑制mTOR最常与蛋白尿和足细胞损伤有关,但是也与肾特异性血栓性微血管病(TMA)有关[6]。研究发现,VEGF抑制剂可以使足细胞VEGF的表达降低,并且足细胞裂孔隔膜膜蛋白Nephrin表达下调,引起肾小球内皮细胞肥大、脱落,进一步引起肾小球滤过膜的通透性增加,肾小球滤液中蛋白质含量上升,超过了肾小管的重吸收能力和(或)导致肾小管上皮细胞内所含的蛋白水解酶丢失,从而导致多种肾小球、肾小管病变,由于肾小管的功能障碍,重吸收能力降低,最终引起蛋白尿的发生,严重者可导致肾病综合征[29-30]。
2.3 血栓性微血管病(TMA) VEGF抑制剂引起的蛋白尿患者中存在肾小球血栓性微血管病[31],通过动物实验进一步推断,肾小球足细胞分泌的VEGF是维持肾小球内皮细胞正常结构和功能所必需的,具体可能是通过上调抗凋亡基因如Bcl-2的表达、增加一氧化氮的生成、诱导衰变加速因子的表达等途径,对内皮细胞起到保护作用[6,32]。在TMA中所见到的大量上调的rela通过与其启动子结合,直接抑制c-mip活性,研究显示,c-mip过表达与足细胞直接损伤的关系在人、小鼠和体外研究中存在[33]。
2.4 血流动力学介导肾小球损伤 系统性高血压和肾小球高压可能与NO生成减少有关[6]。VEGF减少可使血管内皮的内皮型NO合酶活性下降,造成NO合成减少,使外周血管舒张功能异常,从而激活肾素-血管紧张素-醛固酮系统,引起高血压。蛋白尿可能是系统性和肾小球性高血压的结果,如抗VEGF治疗停药时高血压和蛋白尿同时减少,表明抗VEGF治疗后导致蛋白尿的机制可能与运动后蛋白尿相似。作为高血压和蛋白尿的发病机制,这些因素可能与NO的产生减少有关[23]。然而,临床中有时肾小球损伤先于高血压,提示在接受抗VEGF治疗的患者中,高血压可能不是蛋白尿的唯一原因[24]。
3 当前抗血管靶向药物蛋白尿治疗方法和展望
按照美国国家癌症研究所通用毒性标准(NCI CTC,版本号:4.0):当出现CTC1级蛋白尿可以继续靶向治疗。然而,对于CTC2级蛋白尿,需进行24 h尿蛋白定量检测,如果24 h尿蛋白≤2 g,可继续使用靶向药物;24 h尿蛋白>2 g,依据相关说明书则暂停靶向治疗,直到尿蛋白<2 g/24 h可恢复治疗。一旦患者出现肾病综合征,则要永久停用靶向药物[6,22]。通过查找NCCN、ESMO、CSCO等临床指南及相关文献,发现尚无药物被推荐用于抗血管靶向药物导致的蛋白尿的预防和治疗。对于贝伐珠单抗或者安罗替尼引起的蛋白尿患者,国内专家共识推荐[34]:每次开始接受贝伐珠单抗或者安罗替尼治疗之前,都应该进行相关的蛋白尿检测;如果出现24 h蛋白尿水平>2.0 g,应考虑暂停使用贝伐珠单抗或安罗替尼,直至24 h蛋白尿<2 g;肾病综合征(24 h蛋白尿>3.5 g)患者建议停用;ACEI/ARB类降压药可降低蛋白尿的严重程度和终末期肾病的风险,推荐使用。
VEGF信号通路及其下游通路的药物抑制是肿瘤学中常见的治疗策略,但是相关的肾毒性仍然是人们关注的问题。虽然蛋白尿等不良反应在实验和临床数据中都有很好的描述,但是没有标准的治疗策略。鉴于接受抗血管内皮生长因子治疗的癌症患者的生存率不断提高,这是一个值得研究的重要领域。根据相关资料,可以从引起蛋白尿的机制、临床和实验相关研究探讨可治疗蛋白尿的药物。对于出现蛋白尿合并高血压的患者,可以选择ACEI或ARB治疗,ARB与ACEI类似,除能够阻断RAS系统有效降压外,还通过对机体足细胞的保护、细胞凋亡的抑制、氧化应激、信号通路的干预等方面起到了肾脏的保护作用[6,24,35-36],然而其目标和推荐剂量尚不清楚。同样,一些中成药,如金水宝、百令胶囊、阿魏酸哌嗪等可以减轻血管内膜的损伤,松弛血管平滑肌,扩张肾血管,从而改善肾脏血流动力学和微循环,但对于是否可以减少抗血管靶向药物导致的蛋白尿仍缺少相关证据。对于如何减少蛋白尿,这是下一步研究的方向,可以通过体外实验即对肾脏相关细胞的培养,在加入抗血管靶向药物后,通过相关药物的对照实验,观察内皮细胞、足细胞等形态的变化,还可以通过动物实验和临床试验来观察蛋白尿的相关情况。研究发现,亚裔、糖尿病、基础收缩压(SBP)、先前存在1级蛋白尿和先前肾切除术可增加所有级别和高级别蛋白尿发生几率[12],对于有这些危险因素的患者,可以提前给予药物治疗并且监测24 h蛋白尿。相信未来可以找到理想药物治疗抗血管靶向药物所致的蛋白尿,避免出现因严重的蛋白尿而被迫停药的情况。
