电针联合丰富康复训练对局灶性脑缺血大鼠PI3K/AKT信号通路的影响
2020-06-07丰丽媛闫鸣鸣童明月
丰丽媛,唐 巍,兰 葳,闫鸣鸣,何 鹏,童明月
(1.安徽中医药大学研究生院,安徽 合肥 230012;2.安徽中医药大学针灸推拿学院,安徽 合肥 230012;3.亳州市中医院,安徽 亳州 236800)
脑卒中可归属于中医“中风”范畴,是一种常见的心脑血管病,具有高发病率、高致残率、高病死率的特点。中国是全球脑卒中发病率较高的国家之一,患病率逐年持续增加,且脑卒中患者年轻化趋势明显。缺血性脑卒中占脑卒中发病率的60%~80%[1],是由多种因素引起的脑组织局部供血减少或完全中断,导致脑组织缺血缺氧的一种脑血液循环障碍性疾病,临床伴有不同程度神经功能缺损的表现[2],如偏瘫、语言障碍、认知障碍。目前有研究[3]表明,缺血性脑卒中后内源性血管新生在改善脑组织功能中有重要作用,其新生成的血管可以增加缺血区脑组织的氧供和营养物质,挽救濒危组织。故血管新生是治疗缺血性脑卒中的潜在靶点,刺激血管新生可以作为治疗缺血性脑卒中的有效手段。本研究拟通过观察电针联合丰富康复训练激活磷脂酰肌醇3激酶/蛋白激酶B(phosphatidylinositol 3-kinase/protein kinase,PI3K/AKT)信号转导通路相关因子的表达情况,探讨其影响脑内血管新生以促进神经功能恢复的机制,为传统针灸疗法与现代康复技术的结合与运用提供实验依据。
1 材料
1.1 动物 选取SPF级健康雄性SD大鼠60只,2~2.5月龄,体质量为280~320 g,实验动物生产许可证号为SCXK(鲁)2019-0003。实验过程中在自然条件下动物自由摄食和饮水,室温为20~25 ℃,术前禁食不禁水。
1.2 试剂 AKT(2):CST;PI3K p110(CC02181):Bioworld;山羊抗小鼠IgG(137699)、山羊抗兔IgG(136080)、β-actin(18AV0406):Zs-BIO;RIPA细胞裂解液(强)(051018180717)和Western blot一抗、二抗去除液(051418180626):Beyotime;电化学发光(electrochemiluminescence,ECL)试剂盒(SF249607):Thermo。
1.3 仪器 自动制冰机(IMS-20):常熟市雪科电器有限公司;高速冷冻离心机(JW-3021HR):安徽嘉文仪器装备有限公司;水平摇床(TS-1000):海门市其林贝尔仪器制造有限公司;纯水机(Master-S30 UF):上海和泰仪器有限公司;华佗牌一次性无菌针灸针(0.25 mm×13 mm)、电子针疗仪(SDZⅡ型):广州市国览贸易有限公司。
2 方法
2.1 模型复制方法及分组 随机选取15只大鼠作为假手术组,仅作颈动脉分离,不插入尼龙线。其余大鼠参照Longa等[4]改良的颈外动脉线栓法复制脑缺血模型。用于模型复制的大鼠,经右侧颈外动脉插线,建立局灶性大脑中动脉缺血动物模型。大鼠称质量,腹腔注射10%水合氯醛(3.5 mL/kg)麻醉,将大鼠仰卧位固定于鼠板,在颈部右侧作一切口,钝性分离皮下组织,充分暴露颈总动脉,用缝合线标记颈总动脉,向下继续剥离颈外动脉和颈内动脉,缝合线结扎颈外动脉远心端,电凝笔电离颈外动脉,使用动脉夹暂时夹闭颈内动脉和颈总动脉,用动脉剪斜向上45°方向于颈外动脉残端作一“V”型切口,将尼龙线经颈外动脉插入颈内动脉,插入约20 mm,微遇阻力时停止,表示线栓头端已到达大脑中动脉起始段,此时即停止插线。常规术后操作,预防感染。参考Longa等[4]的5分制评分标准。0分:无神经损伤体征;1分:对侧前爪不能完全伸展;2分:自主运动时,身体向偏瘫侧转圈;3分:自主运动时,身体向对侧倾倒;4分:意识丧失,不能自发行走。于大鼠清醒后进行神经功能缺损体征评分,评分1分及以上者即为模型复制成功。将模型复制成功的45只大鼠随机分为模型组、针康组(电针联合丰富康复训练组)、抑制剂组(电针联合丰富康复训练组加抑制剂),每组15只。每组取15只大鼠用于神经功能缺损评分,评分结束后将其中的3只用于脑梗死面积的检测,6只用于缺血侧脑组织PI3K、AKT阳性细胞的检测,6只用于检测缺血侧脑组织PI3K、AKT蛋白的表达。
2.2 治疗方法 电针组选穴为“百会”“风府”“内关”“心俞”4个穴位。参照普通高等教育“十三五”国家级规划教材《实验针灸学》,结合大鼠解剖结构定位。第1天术后4 h开始治疗,用 0.30 mm×25 mm 毫针针刺,接SDZ-Ⅱ华佗牌电针治疗仪,“百会”“风府”为一组,“内关”“心俞”为一组,近心端穴位接正极,远心端穴位接负极。电针参数:疏密波,5~100 Hz,时间 20 min,每日1次,针康组和抑制剂组连续电针治疗7 d。
丰富康复训练包括丰富的环境与训练疗法。丰富的环境包括定时更换大鼠笼内物品,放置玩具、彩球、转盘、摇铃等,同时给予灯光、声音刺激。训练疗法主要包括平衡木、转棒、网屏训练。平衡木训练[5]:训练大鼠的平衡功能,将大鼠放置于长为170 cm、宽为2 cm的木棒上,平放在距地面7 cm处。转棒训练[5]:可评估及训练大鼠的动态平衡功能,将大鼠放置于长为150 cm、直径为4.5 cm的木棒上,其中点固定在3 r/min的转动器上,分别向左右交替转动。网屏训练[5]:评估大鼠抓握能力及肌力情况。将大鼠放在网带为50 cm×40 cm、网眼为1 cm×1 cm的网屏上,网屏的左右和上方用木板制成边框,网屏距离地面60 cm,下面铺以海绵垫,防止大鼠前期因前爪抓力不够摔伤。训练时观察大鼠是否会从网屏上掉下来或用前爪抓住网屏。针康组和抑制剂组,每天将大鼠置于丰富环境中,并置于平衡木、转棒、网屏进行行走、抓握训练各10 min,连续进行7 d。
抑制剂组大鼠处理方法:根据Paxinos和Watson大鼠脑立体定位图谱,将用于微量注射的不锈钢套管(长为10 mm,外径为0.5 mm,内径为0.3 mm)植入大鼠右侧侧脑室上方0.5 mm,确保插入的微量注射器下端能定位于侧脑室,将AKT阻断剂 Wortmannin(0.1 mmol/L)微量注射入侧脑室,每日1次。待大鼠清醒后,再进行电针联合丰富康复训练,连续进行7 d。
2.3 指标观察方法
2.3.1 大鼠神经功能评分 参考Longa等[4]的5分制评分标准,于各组大鼠治疗7 d后进行神经功能缺损评分。
2.3.2 2,3,5-氯化三苯基四氮唑(2,3,5-triphenyltetrazolium chloride,TTC)染色法检测大鼠脑梗死面积 于各组大鼠干预治疗7 d后,水合氯醛腹部注射麻醉,快速取脑,置于-20 ℃冰箱20 min,取出后进行冠状面切片,从额极开始每2 mm取一切片,将切片放置于培养皿中,避光条件下用2% TTC染色液进行染色,37 ℃水浴箱中孵育25 min后取出,用4%多聚甲醛固定。用数码相机对摆放好的切片进行摄像,用图像分析系统Image Pro Plus 6.0测量脑梗死面积。缺血部分面积占整个脑组织切片面积的百分比即为大鼠脑梗死面积比。
2.3.3 免疫组织化学法检测PI3K、AKT表达水平 将脑组织石蜡切片,按照实验常规流程依次进行链霉菌抗生物素蛋白-过氧化物酶法(streptavidin-peroxidase,SP)显色。步骤:烤片,脱蜡,脱水,阻断灭活内源性过氧化物酶,抗原修复,正常羊血清工作液封闭,一抗孵育过夜,滴加生物素标记的二抗、辣根过氧化物酶标记的链霉素卵白素工作液、DAB/H2O2反应染色,苏木素复染,常规脱水,透明,干燥,封片。每张切片在400倍光学显微镜下随机选取5个视野,出现棕黄色染色的细胞为阳性信号,计算阳性细胞数,以每个标本的积分光密度表示PI3K、AKT蛋白表达水平。
2.3.4 Western blot检测PI3K、AKT蛋白的表达水平 取大鼠脑组织,加入RIPA细胞裂解液1 mL(内含1 mmol PMSF)进行裂解,于4 ℃离心( 12 000 r/min)10 min,收集上清液,在收集的蛋白样品中按照1∶4加入5倍SDS-PAGE蛋白上样缓冲液。沸水浴加热10 min,以充分变性蛋白。待样品冷却到室温后,把蛋白样品直接上样到SDS-PAGE胶加样孔内即可。每孔加5~10 μL。浓缩胶所用电压为80 V,时间为30 min;分离胶所用电压为120 V,时间为1 h,电泳分离后,转至PVDF膜(PI3K转膜120 min,Akt转膜60 min),5%脱脂奶粉封闭2 h,而后进行一抗、二抗孵育。PBST洗膜后,用ECL法检测各组大鼠蛋白表达情况,Image J软件分析条带灰度值,蛋白相对表达水平为目标蛋白与β-actin电泳条带灰度值的比值。
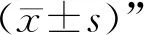
3 结果
3.1 各组大鼠神经功能缺损评分比较 假手术组大鼠神经功能缺损评分为0;与假手术组比较,模型组神经功能缺损评分显著升高(P<0.05);干预7 d后,针康组较模型组神经功能缺损评分显著降低(P<0.05),抑制剂组较针康组神经功能缺损评分显著升高(P<0.05)。见图1。

注:A.假手术组;B.模型组;C.针康组;D.抑制剂组;与假手术组比较,*P<0.05;与模型组比较,#P<0.05;与针康组比较,△P<0.05

3.2 各组大鼠脑梗死面积比较 假手术组脑梗死面积为0;与假手术组比较,模型组脑梗死面积显著升高(P<0.05);干预7 d后,针康组较模型组脑梗死面积显著降低(P<0.05),抑制剂组脑梗死面积明显大于针康组(P<0.05)。见图2、图3。

注:A.假手术组;B.模型组;C.针康组;D.抑制剂组
图2 各组大鼠脑梗死区域大体形态(TTC染色)

注:A.假手术组;B.模型组;C.针康组;D.抑制剂组;与假手术组比较,*P<0.05;与模型组比较,#P<0.05;与针康组比较,△P<0.05

3.3 免疫组织化学法检测的各组大鼠缺血侧脑组织PI3K、AKT蛋白表达水平比较 假手术组大鼠缺血侧脑组织有少量PI3K、AKT表达;与假手术组比较,模型组大鼠PI3K、AKT表达水平显著升高(P<0.05);与模型组比较,针康组大鼠PI3K、AKT表达水平显著升高(P<0.05);与针康组比较,抑制剂组大鼠PI3K、AKT表达水平显著降低(P<0.05)。见图4、图5。

图4 免疫组织化学法检测的各组大鼠缺血侧脑组织PI3K、AKT蛋白表达水平比较(SP法染色,10×40倍,箭头示阳性细胞)

注:A.假手术组;B.模型组;C.针康组;D.抑制剂组;与假手术组比较,*P<0.05;与模型组比较,#P<0.05;与针康组比较,△P<0.05

3.4 Western blot法检测的各组大鼠缺血侧脑组织PI3K、AKT蛋白表达水平比较 与假手术组比较,模型组大鼠缺血侧脑组织PI3K、AKT蛋白的相对表达水平显著升高(P<0.05);与模型组比较,针康组大鼠缺血侧脑组织PI3K、AKT蛋白的相对表达水平显著升高(P<0.05);与针康组比较,抑制剂组大鼠缺血侧脑组织PI3K、AKT的蛋白相对表达水平显著降低(P<0.05)。见图6。

注:A.假手术组;B.模型组;C.针康组;D.抑制剂组;与假手术组比较,*P<0.05;与模型组比较,#P<0.05;与针康组比较,△P<0.05

4 讨论
脑卒中在《黄帝内经》中又称之为“仆击”“薄厥”“偏枯”等,其病机归纳起来不外风、火、痰、气、虚、瘀六端,在这些病理因素的相互影响和相互作用下,脏腑阴阳失调,气血逆乱, 上犯于脑而发病。“病变在脑,首取督脉”,故治督脉可通髓达脑,醒神开窍。百会为督脉要穴,别名“三阳五会”。《会元针灸学》载:“百会者,五脏六腑奇经三阳百脉之所会,故名百会。”百会穴位于巅顶,为足少阳、足太阳、足厥阴与督脉的交会穴,具有升阳固脱、安神健脑、醒脑开窍等作用。风府为督脉经穴,督脉为阳脉之海,总督一身之阳气,风府又为治风要穴,故针刺风府可祛风通络、提振阳气。内关为心包经络穴,心俞为心的背俞穴,心主血脉,针此二穴可促进气血运行。有相关研究[6-7]报道,这些腧穴在促进神经再生,改善内皮功能,改善心肌供血,调节下丘脑中枢和脑电活动等心脑效应方面作用显著。故本实验针刺处方选用督脉经穴百会、风府,辅以内关、心俞,运用电针治疗以醒神开窍、调督通络。
脑卒中发生后,促进血管的生成可加快神经功能恢复,重建的神经血管单元可为脑卒中恢复提供新的机会[8]。PI3K/AKT、Notch、Wnt/β-catenin等[9-12]多个信号通路参与血管新生过程,PI3K/AKT信号通路是血管生成各类信号通路的调节中心[13]。研究[14]发现,PI3K/AKT信号通路可调控血管新生,促进内皮细胞的增殖、迁移和归巢,提高细胞生存能力和抑制内皮细胞衰老死亡。当机体在缺血、低氧等外界因素刺激下,PI3K/AKT信号通路被激活。PI3K是细胞内信号转导的重要信使,具有调节细胞新陈代谢、增殖、凋亡的作用,同时参与AKT依赖性信号通路的活化。AKT作为PI3K信号转导通路的下游重要靶点,是一种能够促进细胞存活,抑制细胞凋亡,且能够维持神经系统正常功能的重要信息分子[15-16]。AKT可以介导包括血管内皮细胞在内的多种细胞的生长,其活性的实现需要依赖第473位丝氨酸的磷酸化,促进血管生成信号,直接诱导血管生成[17]。
研究[18-19]发现,电针联合康复训练可通过对血管新生抑制因子的负反馈调节,发挥血管内皮生长因子(vascular endothelial growth factor,VEGF)、VEGFR2等血管新生相关因子的血管生成作用。VEGF是目前发现的最强烈、最有效、最重要的血管新生促进因子,通过与跨膜酪氨酸激酶受体VEGF1和VEGF2结合,可激活PI3K/AKT信号通路促进血管生成。本实验研究结果显示,针康组大鼠脑梗死面积、神经功能评分和PI3K/AKT表达量显著优于模型组、抑制剂组,这可能是由于电针联合丰富康复训练增加脑缺血大鼠缺血侧脑组织PI3K/AKT的表达,激活PI3K/AKT信号通路诱导血管新生,从而减小脑梗死面积,改善神经功能评分,促进脑缺血大鼠神经功能恢复。
本实验观察电针联合康复训练对PI3K/AKT信号通路的影响,进一步探讨电针联合丰富康复训练促进脑功能恢复的机制,为传统针灸疗法与现代康复技术的结合与运用,提供新的实验依据。
