分泌型卷曲相关蛋白在女性恶性肿瘤中的研究进展
2020-06-06张丽轩刘朝奇李志英
张丽轩,刘朝奇,李志英
0 引言
众所周知,宫颈癌、卵巢癌、子宫内膜癌等恶性肿瘤疾病严重威胁着女性健康,然而到目前为止,人类未曾完全明确女性恶性肿瘤的发生机制。早发现早诊断早治疗可有效减少恶性肿瘤患病率,提高生存率。Wnt信号通路中β-连环蛋白(β-catenin)异常表达与女性恶性肿瘤具有相关性[1],分泌型卷曲相关蛋白(secreted frizzled-related proteins,SFRPs)作为Wnt信号通路抑制剂,与细胞膜上的受体卷曲蛋白(frizzled,Frz)竞争性抑制Wnt蛋白,间接影响β-catenin水平和Wnt信号通路的下游癌基因,从而调控女性恶性肿瘤的发生。因此,随着SFRPs的深入研究,SFRPs可作为一种生物分子诊断疾病,同时为女性恶性肿瘤的治疗提供潜在价值线索。
1 Wnt信号通路与SFRPs蛋白家族的关系
根据Wnt配体的不同,普遍认为Wnt信号通路包括经典和非经典Wnt信号通路。经典Wnt信号通路即Wnt/β-catenin通路,非经典Wnt信号通路主要包括Wnt/PCP通路(planar cell polarity pathway)和Wnt/Ca2+途径。
在经典Wnt/β-catenin通路中,Wnt蛋白主要与细胞膜上的受体卷曲蛋白(frizzled,Frz)、低密度脂蛋白受体相关蛋白(low density lipoprotein receptor-related protein 5/low density lipoprotein receptor-related protein 6,LRP5/LRP6)结合,并诱导散乱蛋白(Dishevelled,Dsh/Dvl)磷酸化,导致β-catenin复合体降解,β-catenin复合体主要由腺瘤性结肠息肉病蛋白基因(adenomatous polyposis coli,APC)、糖原合成激酶3(glycogen synthase kinase-3β,GSK3β)、酪蛋白激酶1(casein kinase 1,CK1)等构成,核内和胞质中的β-catenin水平发生改变,进入细胞核的β-catenin与双向调节因子T细胞因子/淋巴样增强因子(T cell factor/lymphoid enhancer factor,TCF/LEF)相互作用调节靶基因,启动增强Wnt/β-catenin通路下游原癌基因表达,最终导致肿瘤的发生[2],见图1。
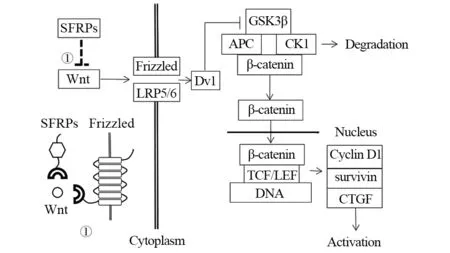
图1 SFRPs对经典Wnt信号通路的调控Figure 1 SFRPs control in the classical Wnt signaling pathway
在非经典Wnt/PCP通路中,Wnt蛋白通过激活Dsh下游区Ras同源基因家族成员A(Ras homolog gene family member A,RhoA)、受体相关共激酶(receptor-associated cokinase,Rac)、细胞周期分裂蛋白42(cell division cycle protein 42,Cdc42)等,进而影响细胞骨架结构。在非经典Wnt/Ca2+途径中,Wnt蛋白与定位于细胞膜上的Frz受体结合,调节胞内钙离子量,可激活蛋白激酶C(protein kinase C,PKC)、钙调蛋白依赖性蛋白激酶CaMKⅡ、活化T细胞核因子(nuclear factor of activated T cells,NFAT)以及其他信号转导因子和转录因子,影响细胞增殖与迁移[2]。
Wnt蛋白参与启动Wnt信号通路,是Wnt信号通路的关键生物因子,在发育过程中正确塑造组织生长及维持稳定性。1982年,Wnt1作为原癌基因首次被发现,是目前研究者发现的19个Wnt蛋白中的第1个成员,编码370个氨基酸的蛋白质,是Wnt通路的始动蛋白,能激活经典信号转导通路[3]。由于SFRPs的N末端富含半胱氨酸的结构域CRD,其与Frz结构相似,能竞争性结合Frz受体蛋白,拮抗Wnt信号通路,从而抑制了肿瘤细胞的增殖活力,是Wnt信号通路的负调控因子。除上述主要调控机制以外,有研究者曾提出,SFRPs对Wnt信号通路的调控机制可能还存在以下几种途径:(1)在SFRPs中,结构域CRD与CRD之间,通过滴定活性的方式影响Wnt蛋白与细胞膜上Frz受体的结合。(2) SFRPs与细胞膜上的Frz受体形成非功能性复合物,以正-负反馈方式发挥作用。(3)SFRPs与Wnt蛋白直接结合形成一种功能性复合体,对细胞膜上的Frz受体产生正性信号,从而激活通路[4]。另外,SFRPs启动子甲基化或超甲基化状态能够导致SFRPs基因失活,其蛋白质合成减少,无法有效阻断Wnt信号通路,通路下游癌基因表达增强,导致细胞异常增殖和肿瘤的发生。SFRPs启动子甲基化是指在DNA甲基转移酶的作用下,以S-腺苷甲硫氨酸为甲基供体,将甲基基团转移到胞嘧啶和鸟嘌呤二核苷酸的胞嘧啶中5位碳原子上,并与其3′端的鸟嘌呤形成mCpG。SFRPs启动子甲基化可在转录水平抑制基因表达。总之,SFRPs蛋白家族与Wnt蛋白的关系十分复杂,因此,深入研究二者之间表达的相关性具有十分重要的意义,并有望作为临床检测指标,辅助疾病诊断与治疗。
2 SFRPs的组成与表达特点
哺乳动物表达5 种SFRPs,统一命名为SFRP1-5。SFRPs定位于染色体8p12~11.1,SFRPs的相对分子质量为40 000,每个蛋白具有两个独立的结构域,N末端为富含半胱氨酸的结构域CRD(cysteine-rich domain,CDR),由10个半胱氨酸组成5对二硫桥。C末端为一个纺锤蛋白样的尼特林结构域(the netrin module,NTR)[5]。
SFRPs作为Wnt信号通路抑制剂,其生物表达特点具有多样性:(1)SFRPs调控细胞分化。一项研究发现,在白色脂肪细胞分化为成熟脂肪细胞过程中,SFRP4 mRNA和蛋白表达水平升高,并在第14天达到高峰,提示白色脂肪细胞已达到终末分化状态。其中,脂质体增殖物激活受体γ(proliferators activate receptor γ,pPARγ)、葡萄糖转运体4(glucose transport-4,GLUT4)显著降低[6]。我们推测SFRP4可能作为脂肪发生的启动子,促进了白色脂肪细胞分化,是脂肪形成过程中不可或缺的一部分。(2)SFRPs影响细胞极化。一项研究发现,细胞极化与PCP核心蛋白Vangl1、Vangl2、Prickle2和Celsr1的表达密切有关[7]。存在SFRP1、SFRP2和SFRP5的情况下,细胞膜上均能检测到PCP核心蛋白。但是,当缺乏SFRP1、SFRP2和SFRP5时,PCP核心蛋白未能在细胞上表现出极化定位。据此推测SFRPs参与了细胞极化,它的表达与否对影响细胞极化是显而易见的。(3)SFRPs参与早期发育。在一项敲除小鼠基因的研究中发现,发育早期的正常肺组织中,SFRP1与Wnt5a、Wnt10b密切相关,阻断SFRP1表达会导致肺泡异常扩张[8]。在胚胎发育过程中,SFRPs发挥着重要作用,SFRPs异常表达会破坏蛋白酶依赖的肺泡重塑过程,影响肺实质和肺泡大小。(4)SFRPs可作为血清标志物及抗肿瘤因子。研究发现,用人血清抗体检测SFRP4,提示SFRP4可作为慢性乙型肝炎、肝细胞癌的血清标志物,对诊断肝疾病具有重要意义,为了提高肝细胞癌的诊断准确率,可以联合检测SFRP4和AFP[9]。数据显示,在肝细胞癌组与慢性肝炎组、非肝细胞癌组中,肝细胞癌组SFRP4表达量明显高于另外两组。甲胎蛋白和甲胎蛋白受体工作特征曲线显示,在慢性肝炎组和肝癌组中,SFRP4敏感度降低,特异性上升,AFP敏感度和特异性呈略升趋势,SFRP4和AFP联合检测的敏感度和特异性分别可提升至79.2%和 95.3%,ROC曲线下面积(AUC)可升高到0.941(95%CI:0.908~0.975)。另外,SFRPs是一组可溶性蛋白,故具有细胞基质蛋白的特征:(1)由不同类型细胞分泌;(2)与细胞外基质有关;(3)组织重塑发生率高;(4)扩增生长[10]。
3 SFRPs对女性恶性肿瘤的作用
SFRPs异常表达与女性恶性肿瘤的发生存在一定的联系,见表1。
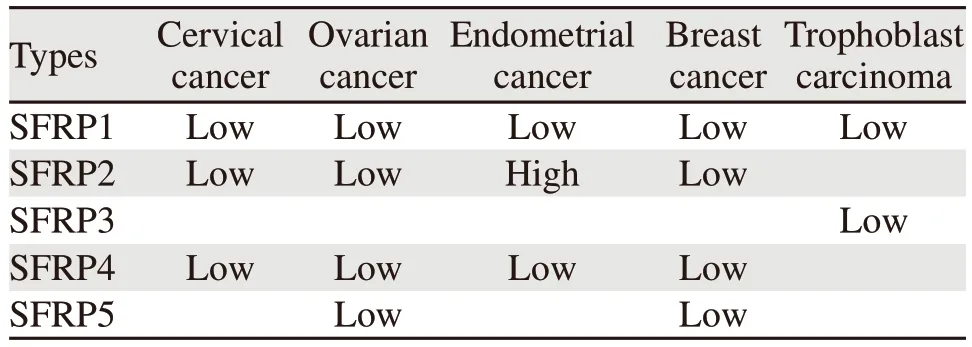
表1 SFRPs在女性恶性肿瘤中的表达Table 1 Expression of SFRPs in female malignant tumors
3.1 SFRPs与宫颈癌
Ghoshal等[11-12]利用谷胱甘肽转移酶GST(glutathione S-transferase,GST)标记SFRP1(GSTSFRP1),并克隆到pGEX-4T2原核表达载体中,结果证实,GST-SFRP1抗宫颈癌HeLa细胞和乳腺癌MCF-7细胞增殖活力呈剂量依赖性,同时联合化疗药物能有效提高抗癌活性。使用适宜剂量的纯化重组的SFRP4对宫颈癌和肺癌进行治疗,对细胞生长抑制作用高达40%,尤其在G2/M期阻滞和早期凋亡较为明显。SFRP4通过下调Wnt通路下游原癌基因Cyclin D1、C-myc和Survivin,抑制细胞增殖。故SFRP1、SFRP4上调能明显抑制宫颈癌细胞增殖。兰健等[13]研究发现,宫颈癌病灶SFRP2 mRNA和蛋白表达明显低于癌旁病灶;当SFRP2高表达时,Wnt信号通路下游靶基因C-myc和Cyclin D1的mRNA和蛋白表达水平均减少。提示SFRP2参与调控了宫颈癌生物学行为。郑朝坂等[14]发现宫颈癌病灶内SFRP2表达量与癌细胞凋亡、细胞上皮-间质转化(epithelial-mesenchymal transition,EMT)过程具有相关性。其次,宫颈癌病灶内凋亡基因SP2、CyclinD1、Piwil2、HERC4、EFEMP1的mRNA表达量均显著高于癌旁病灶,差异具有统计学意义。提示低表达的SFRP2能够增加凋亡基因的表达,进而抑制癌细胞凋亡。曹丽雯等[15]发现,SFRP1在正常宫颈、宫颈上皮内瘤变、宫颈鳞癌细胞膜的表达逐渐缺失,而β-catenin在细胞质、细胞核中的表达逐渐增强。不同FIGO分期与浸润深度的宫颈鳞癌组织β-catenin表达差异有统计学意义。SFRP1蛋白表达与人乳头状瘤病毒(human papillomavirus,HPV)感染呈负相关。胡丹妮等[16]通过Mass-Array甲基化定量分析多个CpG位点,提示相关的甲基化位点在CpG12.13、CpG18区域。聚类分析显示SFRP1在宫颈癌样本中的甲基化率显著高于上皮内瘤变组和正常对照组,提示由癌前病变到宫颈癌的发展中SFRP1基因甲基化起了连续性的作用。另外,在HPV16阳性和阴性两组中,SFRP1基因甲基化差异不显著,提示HPV16感染与SFRP1基因甲基化无关。由此我们推测SFRP1参与了宫颈癌的演变过程,但HPV感染是否与SFRP1基因甲基化导致的基因沉默引起相关蛋白表达降低有关需要进一步研究。因此可将β-catenin蛋白、SFRP1和HPV三者联合检测增加特异度和灵敏度,并作为宫颈癌的严重程度预测指标及治疗靶点。
3.2 SFRPs与卵巢癌
Al-Shabanah等[17]采用特异性PCR方法发现,在卵巢癌组织中SFRP1、2、4、5甲基化率分别为42%、63%、51%、55%。另外,在HPV16和HPV18感染中SFRP2、4、5甲基化率分别为61%、52%、57%和70%、65%、55%。提示SFRPs甲基化在调控或促进卵巢癌发生中起重要作用,SFRPs甲基化能沉默基因表达,并促进卵巢癌细胞的侵袭,或许可能成为卵巢癌的血清标志物。Kardum等[18]利用免疫组织化学和特异性PCR研究发现,正常卵巢组织、高分化浆液性卵巢癌及低分化浆液性卵巢癌中SFRP1蛋白表达呈下降趋势,而基因甲基化率呈上升趋势。因此SFRP下调可能促进卵巢癌的发生。郭玉霞等[19]研究了Wnt信号通路中的关键因子Wnt3a、Wnt4、Wnt11、C-myc和SFRP2,发现Wnt3a下游基因C-myc上调,SFRP2在卵巢癌中显著下调。然而SFRP2与哪一个配体结合调控了癌细胞的增殖还需要进一步分析。Gu等[20]研究发现,活化迁移至卵巢癌组织内的骨髓间充质干细胞可以通过释放miR-1180分子,识别并下调卵巢癌细胞中的SFRP1蛋白,由此提高Wnt通路活性。活化后的Wnt信号通路可增强癌细胞内糖酵解水平(即Warburg效应),从而引起糖酵解依赖性化疗耐药行为。根据上述研究,我们猜想SFRPs与Wnt蛋白的相互作用调控了卵巢癌细胞生物学行为,影响了卵巢癌发生及临床预后,同时两者联合检测或许能提高诊断的准确率,对卵巢癌的诊断有积极意义。
3.3 SFRPs与子宫内膜癌
Yu等[21]研究发现SFRP2对人胚胎干细胞向子宫内膜样细胞分化具有重要作用,SFRP2可降低分化效率,Wnt5a对人胚胎干细胞向子宫内膜样细胞分化有明显促进作用,Wnt7a无明显促进作用。我们推测子宫内膜上皮细胞的形成需要Wnt蛋白和SFRPs促进子宫内膜腺体的发育,但异常表达增高的SFRPs可能抑制子宫内膜上皮细胞形成,进而影响子宫内膜细胞正常生理调控,使正常子宫内膜细胞向癌细胞转化。另外有文献报道,子宫内膜癌细胞与正常细胞相比,SFRP4的表达水平发生变化,SFRP4在低分化子宫内膜肉瘤和侵袭性较强的未分化子宫内膜肉瘤中的表达均明显低于正常上皮。其原因可能为SFRP4启动子异常甲基化,而SFRP4的稳定高表达在体外可抑制子宫内膜癌细胞的生长[22]。韩翠香等[23]用RT-PCR、Western blot法发现子宫内膜癌组织中SFRP1和SFRP4蛋白表达阳性率均较对照组低。随着FIGO分期增加,SFRP1和SFRP4蛋白及mRNA表达阳性率逐渐降低(P<0.05)。另外有淋巴结转移的患者中,SFRP1和SFRP4的阳性率低于无淋巴结转移者(P<0.05)。因此SFRPs在子宫内膜癌的发生发展中承担着不可或缺的作用,SFRP1和SFRP4是Wnt信号通路的调节因子,在子宫内膜细胞增殖中起重要作用,也可能是肿瘤抑制因子,进一步研究SFRPs与子宫内膜癌因果关系,并合理干预,有助于控制子宫内膜癌的发展,为诊断子宫内膜癌提供新的预防靶点。
3.4 SFRPs与乳腺癌
Bhuvanalakshmi等[24]报道天然植物雌激素薯蓣皂苷元(diosgenin,DG)在许多癌症中有抗肿瘤特性。他们先将SFRP4基因插入到质粒中进行过表达,再用DG处理,观察到细胞迁移和血管形成能力减弱,同时β-catenin水平降低,下游抑癌基因GSK3β表达减少,抑制了EMT效应。证实了SFRP4在DG中起着决定性作用,SFRP4上调参与了DG介导的细胞凋亡。另有文献研究表示,高表达SFRPs能够减少乳腺癌的发生,SFRPs甲基化在乳腺癌中具有重要作用,并且与预后也有显著相关性[25]。SFRP1在正常乳腺上皮细胞中表达,但在浸润性乳腺癌组织中经常丢失,导致SFRP1表达缺失的原因是基因启动子甲基化。由于基因甲基化,SFRP2、SFRP5也在乳腺癌中下调,抑制乳腺上皮细胞EMT。左然等[26]在对乳腺癌潜在预后标志物分析时发现,SFRP1高表达者生存率比低表达者生存率高,故SFRP1高表达对乳腺癌患者预后具有保护作用(HR=0.9,P=0.015)。若SFRP1受到has-miR-342-5p抑制时则提示不良预后,因此has-miR-342-5p可能影响SFRP1的保护作用。Ren等[27]研究发现转移性乳腺癌中Wnt/β-catenin信号拮抗剂SFRP1也是miR-454-3p的靶点,其参与了通路信号的激活,在乳腺癌细胞中,miRNP免疫共沉淀实验显示miR-454-3p仅与AXIN2、DKK3和SFRP1有关。并且发现mir-454-3p参与了乳腺癌的早期转移过程,促进了乳腺癌细胞的干细胞生长和早期复发。根据以上研究我们猜测SFRPs参与了乳腺癌细胞分化增殖,影响了细胞自我更新能力。因此深入研究SFRPs在乳腺癌的作用,为临床治疗乳腺癌提供依据,具有积极意义。
3.5 SFRPs与人滋养细胞肿瘤
Partl等[28]通过动物实验模型,比较正常和宫内生长受限(intrauterine growth retardation,IUGR)胎盘中SFRP1和SFRP3表达情况。在大鼠的子宫内膜和肌层中,SFRP1和SFRP3均有表达,蜕膜细胞细胞质染色偶呈阳性。SFRP1和SFRP3在血管内皮细胞中的表达明显升高。人IUGR胎盘中SFRP1和SFRP3的表达量均高于正常妊娠胎盘(P<0.0001)。与癌旁病灶相比,人滋养细胞肿瘤组织中SFRP1和SFRP3的表达降低。尽管上述结果的关联并不明显,但我们猜想,SFRP1和SFRP3可能涉及调控了IUGR胎盘功能障碍的发病机制,继而导致人类滋养细胞肿瘤的发生。目前,SFRPs与人滋养细胞肿瘤的相关性研究较少,具体机制需要进一步研究,SFRPs对人滋养细胞肿瘤的诊疗可能具有潜在的广阔前景。
4 小结
在Wnt信号通路中,Wnt蛋白作为生长促进因子,导致细胞增殖,在不同的时间点影响细胞周期,它的独特之处在于诱导细胞增殖的同时也能作为定向生长因子发挥作用,正确塑造组织生长。SFRPs是Wnt转导通路重要抑制剂,在诱导肿瘤细胞凋亡、调控细胞生长等方面具有重要意义。女性恶性肿瘤中,SFRPs启动子的甲基化或超甲基化导致的基因沉默是一种关键驱动因素,促进了病理进展以及癌症的发生。肿瘤的发生需要一个复杂的交互网络,因此SFRPs启动子甲基化并不是导致女性恶性肿瘤病变的唯一因素,SFRPs家族、Wnt蛋白、Dkk类抑制剂乃至其他信号通路之间可能存在交叉、正负反馈作用。研究SFRPs家族对于女性恶性肿瘤的靶向治疗具有重要的意义,可以为女性恶性肿瘤的治疗提供潜在价值线索,同时有助于预防女性恶性肿瘤的发生与进展。
