荭草苷对APP/PS1转基因小鼠神经保护作用实验研究*
2020-06-06张泽,韩锟,贾宁
张 泽,韩 锟,贾 宁
锦州医科大学附属第一医院神经内科(锦州121001)
阿尔茨海默病(Alzheimer's disease,AD)是一种发生于中老年的神经系统变性疾病。研究表明[1-3],AD 患者脑源性神经生长因子(Brain derived neurotrophic factor,BDNF)及其功能性酪氨酸激酶B(Tyrosine kinase B,Trk B)受体表达减少。BDNF 属于神经营养因子家族的成员,在神经再生的发生、发展中发挥重要作用,其作用于Trk B受体,发挥抗神经元凋亡、改善认知功能的作用。脑内大量的β-淀粉样蛋白(β-amyloid protein,Aβ)沉积形成的老年斑是AD特征性病理改变之一,而Aβ1-42 是老年斑的主要成分[4]。荭草苷(Orientin,Ori)是一种水溶性碳苷类黄酮化合物,为荭草、竹叶、金莲花的主要活性成分,具有抗氧化应激、抗衰老、抗炎、抗凋亡等多种神经保护作用,能够改善痴呆小鼠的认知功能[5-7]。本文以APP/PS1转基因小鼠为研究对象,研究Ori对此动物模型BDNF和Trk B受体的作用,以及对Aβ沉积的影响。
材料与方法
1 实验材料 动物:10月龄APP/PS1转基因小鼠24只,同月龄同背景C57BL/6J小鼠8 只,购自中国医科大学实验动物中心[许可证号:SYXK(辽)2012-007]。药品与试剂:荭草苷(纯度≥99%)购于成都曼思特生物科技有限公司;兔抗BDNF 抗体、兔抗TrkB受体抗体购于北京博奥森生物技术有限公司;Aβ1-42 ELISA 试剂盒购于Invitrogen 公司。仪器:Morris水迷宫(安徽正华生物仪器设备有限公司);电泳仪、凝胶成像系统(美国bio-rad公司);紫外分光光度计(德国Biophotometer)。
2 实验方法
2.1 动物分组与处理:将APP/PS1转基因小鼠随机分成三组,即模型组(Tg组)、Ori低剂量组(Tg/Ori-L组)和Ori高剂量组(Tg/Ori-H 组),对照组(NT 组)为同月龄同背景C57BL/6J小鼠。每组小鼠8只,雌雄各半,体重(25±3)g,各组小鼠体重比较无统计学差异。给药方法:NT 组和Tg组每天给予双蒸水5 ml腹腔注射,Tg/Ori-L 组和Tg/Ori-H 组每天分别给予Ori 10、50 mg/kg 5 ml腹腔注射,均给药4周。
2.2 Morris水迷宫实验行为学检测:给药结束24 h后行Morris水迷宫实验。实验分为定位航行实验和空间探索实验两部分。实验程序参照Morris等方法进行[8-9],检测各组小鼠的空间学习记忆能力。
2.3 Western blot检测BDNF 和Trk B 受体的蛋白表达:提取各组小鼠海马的总蛋白,采用BCA 法测定蛋白浓度。40μg蛋白样品经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离后转膜,用5%牛奶封闭,加入一抗(BDNF,1∶500;Trk B 受体,1∶500;β-actin,1∶4000)4 ℃孵育过夜,再加入辣根过氧化物酶结合的二抗常温孵育1 h。ECL 显影,凝胶成像系统曝光,Image J软件分析。
2.4 ELISA 法检测海马区Aβ1-42水平:将各组小鼠的脑组织称重,加入8倍体积的盐酸胍裂解液研磨,室温下静置3~4 h。用反应缓冲液1∶50稀释样品后离心20 min,取上清用于可溶性Aβ1-42的测定,离心管底部沉淀再用70%甲酸溶解后离心1 h,收集上清液用于不可溶性Aβ1-42的测定。取标准品按说明书建立标准曲线。将标准品、样品各50μl分别加入微量酶标板内,立即向每孔加入50μl Aβ1-42抗体,置摇床室温孵育3 h。反复洗板4 次,室温孵育30 min。每孔加100μl染液覆盖,37 ℃孵育30 min。取出酶标板,每孔加终止液100μl,轻轻混匀,直至孔中的液体由蓝变黄。空白孔调零,30 min内在450 nm波长读取光密度(OD 值),根据曲线方程求出脑组织中Aβ1-42的浓度。
3 统计学方法 数据分析采用SPSS 13.0统计学软件进行。实验数据以均值±标准差(±s)表示,组间比较采用方差分析,P<0.05表示具有统计学差异。
结 果
1 Ori改善APP/PS1转基因小鼠学习记忆能力 各组小鼠定位航行试验显示,寻找平台逃避潜伏期(图1A)及平均路程(图1B)随着测试时间的延长而逐渐缩短。与NT 组相比,Tg组小鼠逃避潜伏期和寻找平台平均路程延长(P<0.05),经Ori治疗后均显著缩短(P<0.05),表明APP/PS1小鼠具有明显的空间学习障碍,Ori可以改善其能力。空间探索试验结果(图2)显示,Tg组小鼠穿梭原平台所在象限次数显著减少(P<0.05),经Ori治疗后次数均明显增加(P<0.05),提示APP/PS1转基因小鼠的空间记忆再现能力降低,Ori可改善其能力。与Tg/Ori-L 组比较,Tg/Ori-H 组逃避潜伏期、寻找平台平均路程和穿梭原平台所在象限次数均无统计学差异(P>0.05),说明Ori改善APP/PS1转基因小鼠的空间学习记忆能力无剂量相关性。
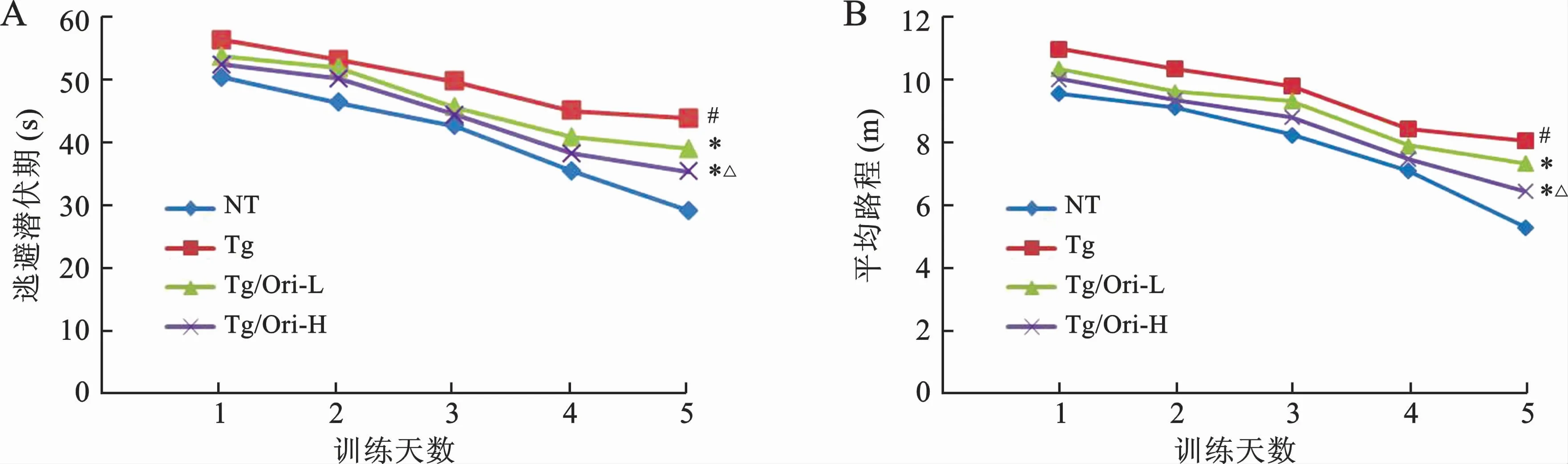
图1 各组小鼠寻找平台逃避潜伏期(A)和寻找平台平均路程(B)比较
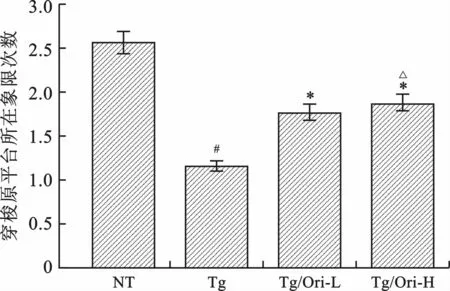
图2 各组小鼠穿梭原平台所在象限次数比较
2 Ori调节APP/PS1转基因小鼠海马区BDNF和Trk B受体蛋白表达 见图3。Western blot结果显示,与NT 组比较,Tg 组小鼠海马BDNF 和TrkB受体蛋白表达减少(P<0.05);与Tg组相比,Tg/Ori-L组和Tg/Ori-H 组小鼠海马BDNF 和TrkB 受体蛋白表达增加(P<0.05);Tg/Ori-H 组小鼠海马BDNF和TrkB受体蛋白表达与Tg/Ori-L 组比较,差异无统计学意义(P>0.05)。
3 Ori减轻APP/PS1转基因小鼠海马区Aβ1-42水平 见表1。ELISA 结果显示,Tg组小鼠海马区可溶性Aβ1-42含量及不可溶性Aβ1-42含量较NT 组明显增高(P<0.05);与Tg组比较,Tg/Ori-L 组和Tg/Ori-H 组小鼠海马区可溶性Aβ1-42含量和不可溶性Aβ1-42含量降低,差异有统计学意义(P<0.05);与Tg/Ori-L组比较,Tg/Ori-H 组小鼠海马区可溶性和不可溶性Aβ1-42含量无统计学差异(P>0.05)。
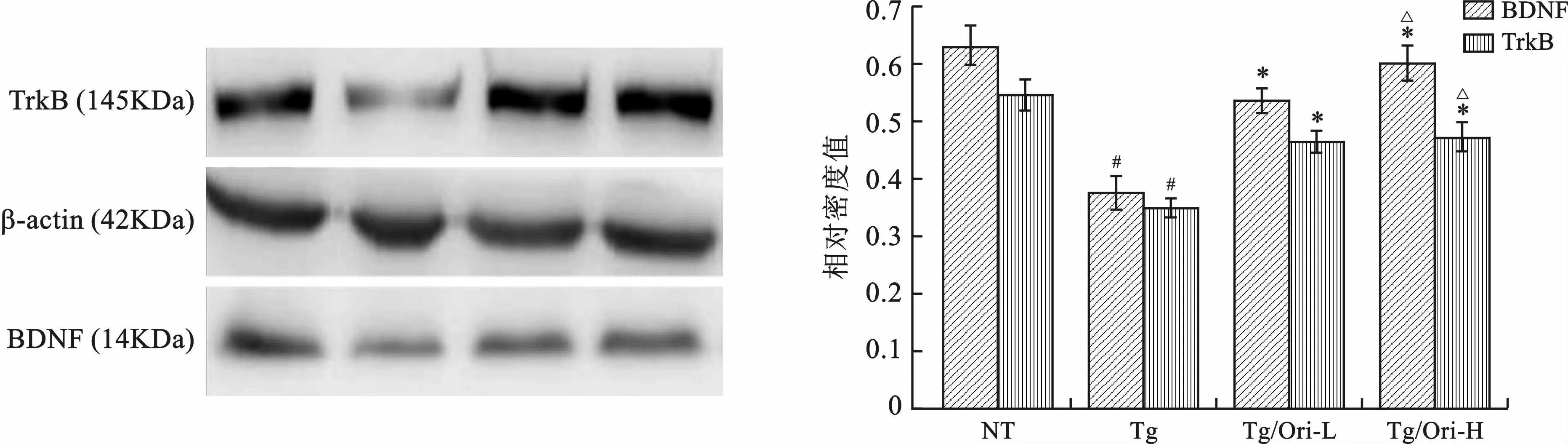
图3 各组小鼠海马区BDNF和Trk B受体蛋白表达比较
表1 各组小鼠海马区可溶性及不可溶性Aβ1-42含量比较(±s)

表1 各组小鼠海马区可溶性及不可溶性Aβ1-42含量比较(±s)
注:与NT 组比较,#P<0.05;与Tg组比较,*P<0.05
组 别 可溶性Aβ1-42(pg/mg)不可溶性Aβ1-4(ng/mg)NT 组24.05±4.98 42.06±6.98 Tg组 67.05±8.15# 112.03±11.23#Tg/Ori-L组 32.31±6.32* 76.35±6.42*Tg/Ori-H 组 39.17±9.86* 71.05±7.35*
讨 论
Ori是一种水溶性碳苷类黄酮化合物,为荭草、竹叶、金莲花的主要活性成分。研究表明[1-3]:Ori具有抗氧化应激、抗衰老、抗炎、抗凋亡、神经保护等多种生物学作用,能够改善Aβ以及噪音诱导的痴呆小鼠的认知功能。但Ori改善痴呆小鼠认知功能的机制目前尚不清楚。
BDNF/Trk B是中枢神经系统的神经保护信号通路之一,其中BDNF 广泛分布于海马、皮质和杏仁核等区域[10],通过与细胞膜上的Trk B 受体特异性结合而激活酪氨酸蛋白激酶,引起酪氨酸残基的磷酸化,促进神经干细胞的分化和成熟神经元的存活,提升海马神经元在损伤环境下的自我修复及适应能力,调控神经递质的合成和释放,增强突触可塑性,维持AD 病理环境中树突的形态和功能,最终改善认知功能[11-12]。研究表明[13-14]:AD 动物模型及患者BDNF和Trk B受体表达均下降,并与年龄和病程呈负相关,给予痴呆动物模型外源性导入BDNF 则有明显的神经保护作用,减少了Aβ沉积,从而改善了模型的空间学习和记忆能力。本研究中模型组小鼠海马BDNF/Trk B含量下降,从而导致Aβ1-42 含量增加,与文献报道一致[15]。Ori可上调小鼠海马区BDNF/TrkB 的表达,减少Aβ1-42的含量。Aβ沉积形成的老年斑是AD 的经典病理改变,Aβ的生成与清除失衡是AD 的核心发病机制。在体和离体实验均表明BDNF 能通过下调脑Aβ的表达减少老年斑的形成,保护脑内神经元、颗粒细胞、星型胶质细胞等,从而使神经细胞免受Aβ多聚体的细胞毒性损伤,提高神经细胞的存活能力[15]。本研究中APP/PS1转基因痴呆小鼠脑内BDNF 和TrkB受体表达减少,Ori能上调BDNF 和TrkB 受体表达,进而减少海马Aβ沉积,从而提高了空间学习记忆能力。但本研究中Ori影响痴呆动物模型BDNF/Trk B表达无剂量依赖关系,仍需进一步分组研究。
