动脉内皮血流动力学微环境建模分析和体外模拟方法与技术研究进展
2020-06-06覃开蓉梁夫友那景童
覃开蓉, 梁夫友, 那景童
(1. 大连理工大学 光电工程与仪器科学学院, 辽宁 大连 116024; 2. 上海交通大学 船舶海洋与建筑工程学院工程力学系, 上海 200240; 3. 大连理工大学 电子信息与电气工程学部生物医学工程学院, 辽宁 大连 116024)
0 引 言
动脉血管壁由内膜、中膜和外膜三层组织构成。其中,内膜是指位于动脉壁最内层的内皮细胞单层结构,又称“内皮”。作为介于血流和动脉壁组织之间的一道屏障,动脉内皮处于复杂的血流动力学微环境中[1-5]。微环境中除包含大量浓度随时间变化的生物和化学物质外,还有血流产生的血压、壁面剪应力以及血压导致的管壁周向牵张应力(或应变)等血流动力学信号(图1)[1-5]。通过细胞膜表面的受体及感受器,动脉内皮细胞能够识别细胞外不同形式的血流动力学微环境信号及其变化,并通过一系列的信号通路级联反应传递至细胞内部,引起基因和蛋白表达的变化,最终影响细胞增殖、迁移、凋亡等功能和行为,此即力学生物学(Mechanobiology)机制[1-5]。例如,生理范围的层流微环境能促进动脉内皮细胞分泌一氧化氮(Nitric Oxide, NO)、前列环素(Prostacyclin, PGI2)等血管舒张因子,起到抗炎症、抗氧化应激、抗动脉粥样硬化的作用[1-6];相反,弯曲和分岔动脉段的低水平剪应力或扰动流微环境会使内皮细胞的渗透性增大,活性氧类(Reactive Oxygen Species, ROS)及促炎症因子等物质的生成增多[7-8],从而导致内皮功能障碍,最终诱发一系列心脑血管粥样硬化性疾病(常表现为局部血管狭窄及下游器官/组织缺血)。
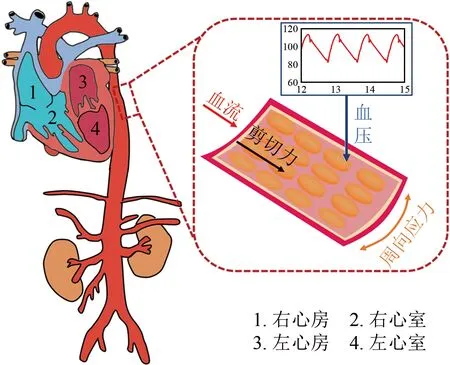
图1 动脉内皮微环境中血压、壁面剪应力和周向牵张应力(或应变)作用于血管壁示意图
Fig.1 Schematic diagram of blood pressure, wall shear stress, and circumferential tensile stress (or strain) applied on blood vessel’s wall in vascular endothelial microenvironment
由动脉粥样硬化引起的严重狭窄性病变,一般采用内膜剥离术[9]、支架介入治疗[10]、旁路移植术[11]等血管内/外科手术进行治疗,以实现血运重建;对轻度或中度病变,可采用左心室辅助装置[12]、体外反搏(External Counter Pulsation,ECP)[13-15]、运动干预[16-19]等方式调节动脉内皮的血流动力学微环境,通过力学生物学机制改善内皮功能,从而预防或逆转动脉功能失调。目前,左心室辅助装置、ECP、运动干预等力学疗法[20]已成为心血管疾病治疗与康复的重要切入点。然而,这些力学疗法究竟引起动脉内皮血流动力学微环境发生了什么样的变化、如何通过这些变化精准调控动脉内皮功能,对此尚缺乏全面、系统、客观、定量的研究,从而阻碍了这些力学疗法的精准实施以及在临床心血管康复医学中科学合理的应用。
动物实验与临床实验[9-19]等在体研究方式是探索这些力学疗法引起血流动力学微环境改变及其对动脉内皮功能影响的最直接方式。动脉内皮微环境中血流动力学信号的获取[21-63]和内皮功能的评价[64-65]不仅为心脑血管疾病的早期诊断和预防提供血流动力学及内皮功能指标,同时也是定量研究两者内在关系的前提。通过影像学、彩色超声多普勒血流速度检测、肱动脉血压检测、多尺度血流动力学建模以及计算流体力学(Computational Fluid Dynamics, CFD)数值仿真技术,可以检测或计算分析在体动脉内皮微环境中的壁面剪应力、血压和周向牵张应力(或应变)等血流动力学信息[21-63];而对在体动脉内皮功能的评价,则采用无创性血流介导的血管扩张(Flow-Mediated Vasodilation, FMD)指标[64],或采用其他有创方式对血管细胞进行取样分析[65]。
然而,由于动物和人体心脑血管细胞所处的血流动力学微环境非常复杂[2],且易受呼吸、神经调节等其他多种因素的干扰,动物实验和临床实验面临个体差异大,无创性在体检测血流动力学和生物化学信号、细胞内响应血流动力学微环境变化的分子生物学指标的手段有限、精准度不高等多种问题,且实验周期长、成本高,并可能存在伦理争议。为突破上述局限,建立体外模拟循环系统(Mock Circulatory System, MCS)[66-74]和体外内皮细胞培养模型(Endothelial Cell Culture Model, ECCM)[75-101]开展相关研究显得尤为重要。通过体外MCS,可以更加方便地研究不同力学疗法与血流动力学微环境信号之间的定量关系[66-74];而体外ECCM则为研究不同力学疗法引起的动脉内皮细胞功能变化及其力学生物学机制提供了客观化、标准化和定量化的研究平台[75-101]。这两种分别基于血流动力学和力学生物学原理的体外模型研究,迄今已发展为开展动物实验和临床实验之前不可或缺的研究步骤。
综上所述,动脉内皮微环境的血流动力学建模分析与体外模拟不仅为心脑血管疾病早期诊断与预防、治疗与康复提供重要的参考指标,而且是深入理解心脑血管疾病发生发展机制的前提和基础,具有非常重要的科学意义和临床应用价值。本文章节安排如下:引言部分阐述研究背景与意义;第1节综述在体动脉内皮微环境的血流动力学检测与建模分析研究进展(在体血管结构的影像学与血流动力学基本参量检测、在体血流动力学建模仿真);第2节介绍体外评估动脉内皮微环境血流动力学特性的MCS(MCS基本结构和方法、考虑局部动脉解剖结构的MCS);第3节介绍用于细胞力学生物学体外研究的ECCM研究进展,包括平行平板流动腔系统、静压力加载装置、牵张应变(或应力)加载装置、硅胶管流动腔系统以及基于微流控技术的ECCM;最后是全文总结及展望。
1 在体动脉内皮微环境的血流动力学检测与建模分析
动脉内皮微环境中血流动力学信号的获取,是定量研究不同力学疗法引起的血流动力学信号变化及其对动脉内皮功能影响的前提[21-63]。通过CT血管造影(CT Angiography, CTA)、核磁血管造影(MR Angiography, MRA)、数字减影成像(Digital Subtraction Angiography, DSA)、多普勒超声等影像学、多普勒超声血流速度检测以及肱动脉血压检测等技术,研究者能够获取循环系统血管解剖结构的几何尺寸、局部动脉的管壁运动、血流速度以及血压等信息,进而结合几何多尺度血流动力学建模与CFD数值仿真技术,得到在体动脉内皮微环境中的速度场和壁面剪应力分布等详细的血流动力学信息。
1.1 在体血管结构的影像学与血流动力学基本参量检测
临床开展的血管影像学检查以血管内腔成像为主,常用技术包括CTA、MRA、DSA以及多普勒超声等,基于血管内腔成像可识别动脉粥样硬化引起的管腔狭窄区域及程度,是临床决策的主要依据。临床研究表明:CTA、MRA均可对血管管腔狭窄率、内腔形态特征进行测量,对指导临床决策和患者风险分层具有重要价值[26-30];同时,两者各有其优缺点及特定的临床适用性。与MRA相比,CTA具有更快的检测速度、更高的空间/时间分辨率以及更广泛的适用性(如钙化斑块识别、金属支架介入手术后的血管成像)[31];MRA也有其自身优势,如可在未静脉注射造影剂的情况下实现血管成像[32],无放射线辐射风险,并可通过调节测量序列与参数(如3D TSE T1WI、黑血序列等),结合相应的图像处理技术,对动脉粥样硬化斑块组分或管壁组织实现在体成像与分析[33-35]。但是,由于受空间解析度的限制,CTA、MRA诊断临界狭窄的敏感度和可重复性不佳,有导致误诊或漏诊的风险[36]。在此背景下,有创DSA可提供更直观、更明确的管腔形态影像,从而提高诊断的准确率。目前,DSA技术已由早期的二维成像发展为更先进的三维、四维成像[37-38],成为诊断动脉粥样硬化性狭窄、颅内动脉瘤等血管疾病的金标准。近期,与人工智能算法结合的三维DSA图像重构技术进一步提高了对血管几何学参数的量化评价精度和效率[39]。
与CTA、MRA和DSA技术相比,基于多普勒超声技术的血管测量具有操作简单、快速和完全无创的优点,借助特定的扫描和图像处理技术也可对动脉粥样硬化斑块进行三维测量[40],但精度和可重复性尚未被广泛证明,在临床应用中多限于血管二维成像,临床价值多定位于血管疾病初筛,其对血管管径动态变化的实时追踪能力也可与血压信息结合评估血管的弹性[41],或与生理性缺血试验结合评估动脉内皮功能FMD[42]。近期,基于超声测量原理衍生了多种新的血管测量技术,例如,与在体注射微泡对比剂结合,可实现斑块内新生血管的显影,对识别易损高风险斑块具有重要价值[43];另一项重要的衍生技术是血管内超声成像(Intravascular Ultrasound, IVUS),该技术使用血管内超声探头对血管进行扫描,可实现斑块及血管内膜、中膜的组织成像,在评估斑块组分、破裂风险和血管重构方面具有重要的应用价值,目前已在心血管内科广泛应用[44]。
与血管成像相比,血流动力学信号的在体测量具有更大的挑战性。多普勒超声是临床上测量血流信息的常用手段之一,可测量血管横断面的最大或平均血流速度,但测量精度易受超声测量样本窗口选择/探头定位、血流速度分布的时变性/不规则性以及操作者技术水平/习惯等因素的影响,造成测量结果的不确定误差较大[45]。相位对比核磁成像(Phase-Contrast MRI, PC-MRI)是另一种广泛应用于临床的血流测量技术,其主要优点是可提供血管断面的流速空间分布信息,从而实现血流体积流量的较可靠测量[46],并可拓展至三维空间的流速测量(3D PC-MRI),实现特定血管区域三维流场的测量与描绘[47]。近期,结合心电门控技术进一步实现了对脉动流场的测量,即4D Flow MRI[48]。MRI测量也有其局限性,如对操作者依赖性高、测量精度受呼吸/心率不齐等因素影响大以及对低流速流场测量精度低等[49]。与流速相比,壁面剪应力、动脉内皮细胞功能与血管生理病理的联系更为密切,但其在体测量手段和精度仍存在很大的局限。既往研究虽然基于MRI所测流速信息结合特定算法实现了对血管壁面剪应力的量化评估[50],但由于近壁区域低流速和复杂几何形态的影响,测量误差大,壁面剪应力的测量结果仅具有定性参考价值。
总体来说,现有临床检测技术在血管成像方面较为成熟、种类较多且应用广泛,而在血流动力学信号测量方面仍存在精度/解析度不高、随机误差大、操作性差和可测参数少等一系列不足,特别是尚无可靠的壁面剪应力测量技术,在很大程度上限制了对动脉内皮血流动力学微环境的在体研究。
1.2 在体血流动力学建模仿真
计算机建模仿真是弥补血流动力学参数在体测量局限性的重要手段。早期研究工作主要基于血管影像学信息(如CTA、MRA数据)构建患者个性化的血管几何模型,利用CFD技术对特定血管区域的血流形态进行计算,实现流场及壁面剪应力参数的量化评价[51-52]。该方法具有流场信息丰富细致(如涡结构、二次流等)、对壁面剪应力及其衍生参量的量化评估精度高等优点,对研究内皮细胞功能、行为以及动脉粥样硬化、动脉瘤等血管疾病与血流动力学微环境的关联性具有重要的辅助价值;但同时也面临诸多问题[53],典型问题包括:(1)基于影像学信息的模型重构误差显著增大计算结果的不确定性;(2)模型边界条件设置的患者个性化程度不足,造成计算结果偏离患者的在体血流状态[54]。有研究表明,针对同一个患者,即使在保持模型边界条件不变的情况下,受图像分割算法、图像采集精度等因素的影响,血管几何模型重构的随机误差可引起计算得到的壁面剪应力、振荡剪切指数等血流动力学参数产生40%以上的变化[55-57]。在基于医学影像信息的血流动力学建模计算大背景下,患者个性化模型边界条件设置问题长期被忽视,直到近几年才引起重视。近期的数项研究发现,采用简化或人群平均化边界条件替代患者个体化边界条件引起的计算结果偏差可达90%以上[58-59],证明了患者个性化模型边界条件设置的重要性。针对该问题,研究者常采用基于在体实测血流信息(如超声、PC-MRI信息)设定边界条件的方法来提高建模仿真的患者个性化保真度及其临床应用价值[60-61](图2);而对难以在体测量血流信息的较小动脉(如脑动脉、冠状动脉),则采用几何多尺度建模方法构建可以基于可测临床信息进行校准的参数化平台,实现不可测动脉模型边界处血流动力学参数的患者个性化估测和设置[62]。除上述影响血流动力学计算结果可靠性的因素外,近期有研究表明,脉动血流的生理性非周期变化会引起壁面剪应力参数,尤其是剪应力时间梯度的显著变化(约27%),提示既往研究常采用的周期性血流假设存在一定的局限性[63]。

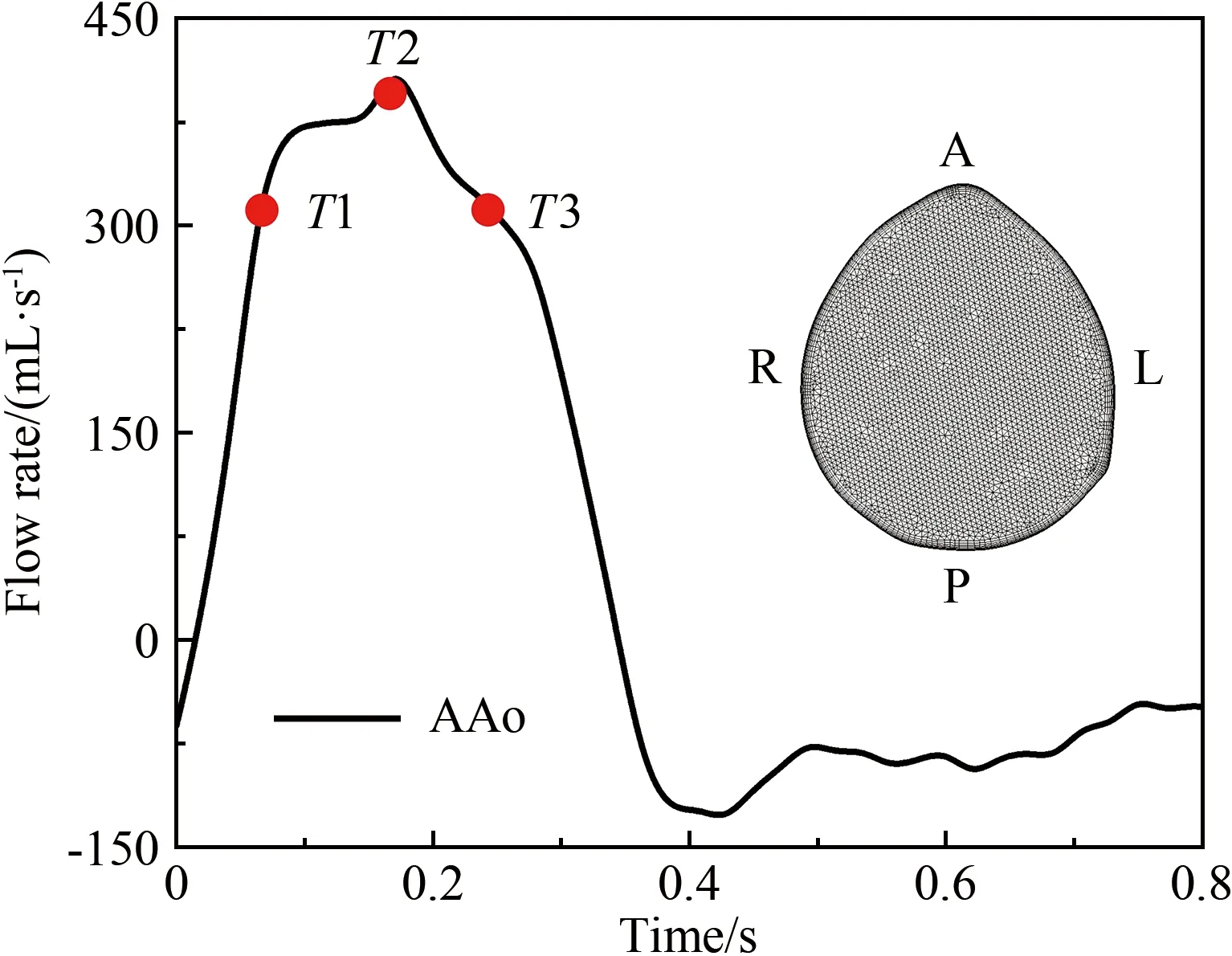

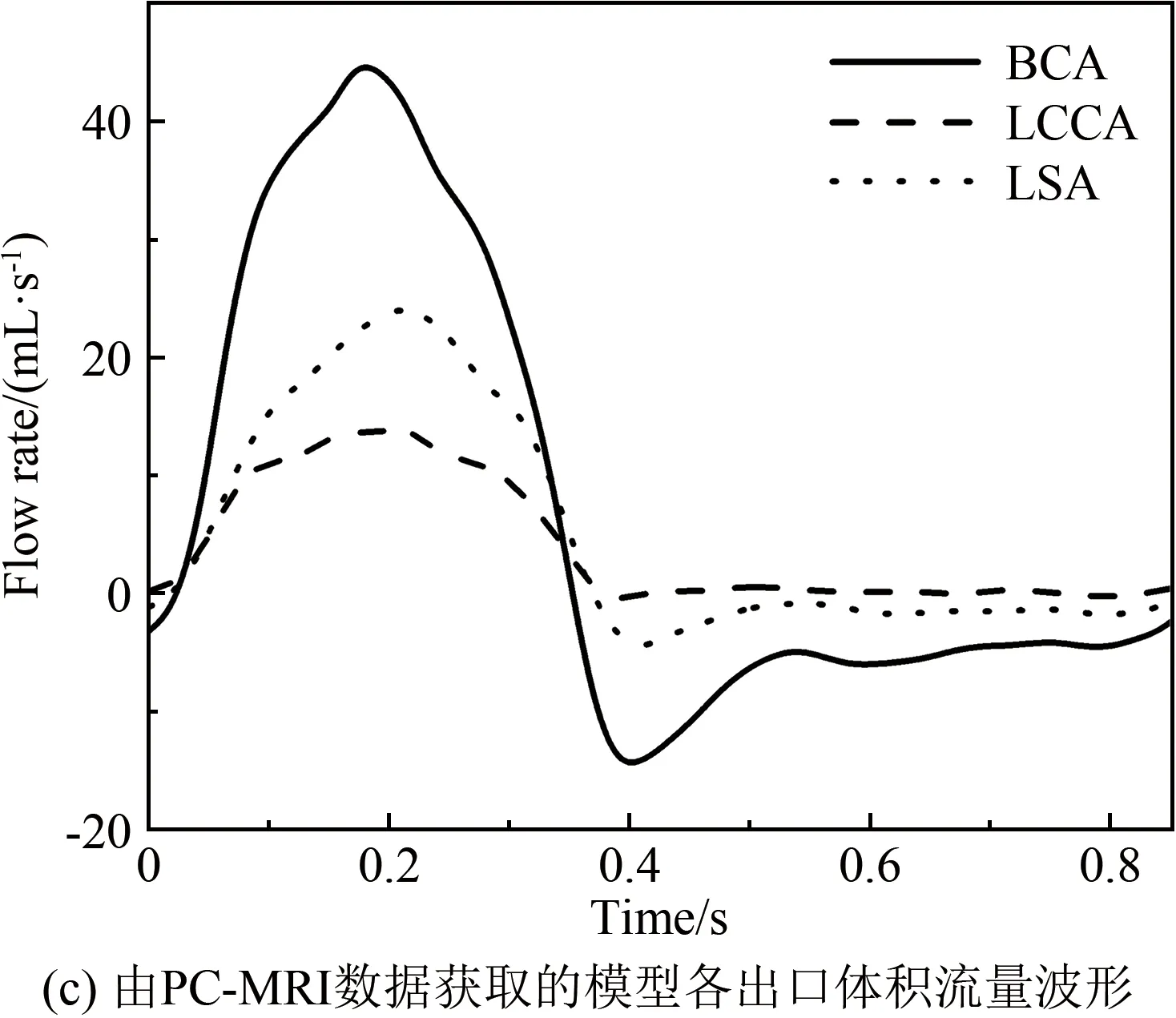
图2 患者个性化主动脉模型的边界条件设置[61]
Fig.2 Patient-specific prescription of boundary conditions for an aortic model[61]
综上,血流动力学建模仿真具有血流动力学信号量化评估精度高、信息丰富的优势,对研究动脉内皮微环境具有良好的潜力和可行性,但仍普遍存在几何模型重构随机误差大、边界条件设置的患者个性化程度不高等关键问题。为解决上述问题,亟待开发可靠、可重复性高的医学影像分割技术、几何多尺度建模以及计算模型与可测临床数据的融合技术。
2 体外评估动脉内皮微环境血流动力学特性的MCS
MCS常用于体外评估动脉内皮微环境血流动力学特性。MCS一般采用机械泵模拟心室,用各种集中参数元器件(弹性腔、连接管路、可调阻力阀等)和分布参数元器件(硅胶弹性管等)模拟心室后负荷的输入阻抗[74]、局部动脉解剖结构和力学特性,组成一套体外MCS;通过传感器检测模拟动脉管段的血压和血流量信号,或采用粒子图像测速技术(Particle Image Velocimetry, PIV)检测模拟动脉管段的流速剖面,进而结合多尺度血流动力学建模与CFD数值仿真技术,研究不同生理病理状态以及不同力学疗法引起的动脉内皮微环境中血流动力学信号的变化[66-74]。
2.1 MCS的基本结构和方法
如图3所示,MCS的基本结构包括流体力学回路和信号采集处理模块[73]。其中,流体力学回路对应于人体循环系统的血压脉动、血流分配等血流动力学特性;信号采集处理模块通过传感器和数据处理单元对流体力学回路产生的压力、流量等信号进行测量、分析和显示。
MCS的流体力学回路由模拟心脏泵血功能的驱动装置和模拟血管系统血流动力学特性的集中参数元器件组成。模拟心脏泵血功能的驱动装置一般包括电机或气驱动的心室模拟器、单向阀以及相应的控制系统。模拟血管系统血流动力学特性的集中参数元器件包括模拟血管顺应性C的弹性腔、模拟血流惯性L的连接管路以及模拟血流阻力R的可调阻力阀等。针对不同的研究目的,MCS流体力学回路包括二元件、三元件、四元件、五元件模型设计甚至更多元件的复杂设计。
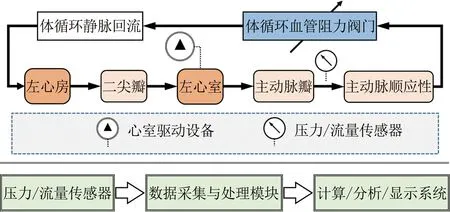
图3 MCS基本结构示意图(基于文献[73]图1重绘)
Fig.3 Schematic diagram for fundamental structure of the MCS (adapted from Fig.1 in Ref.[73])
设计MCS流体力学回路的关键在于精确模拟真实主动脉根部的血压p(t)波形和血流量q(t)波形。由于主动脉根部下游动脉床的输入阻抗能够反映脉搏波在动脉床中的传播特性以及动脉床本身的力学特性,因此可通过模拟主动脉根部下游动脉系统的输入阻抗来设计集中参数模型[74]。动脉输入阻抗表示频域上脉动压力与脉动流量之间的关系。血压波形p(t)和血流量波形q(t)经Fourier分解后的Fourier级数可表示为:

(1)

(2)
式中,ωn为圆频率。任意圆频率ωn对应的血压和血流量谐波分量的幅值和相位之间的关系可用动脉输入阻抗z(ωn)表示为[74]:
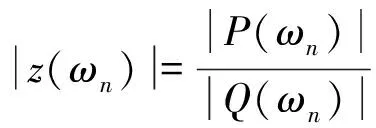
(3)
∠z(ωn)=∠P(ωn)-∠Q(ωn)
(4)
式中,|P(ωn)|和|Q(ωn)|分别为血压和血流量在ωn处的幅值;∠P(ωn)和∠Q(ωn)分别为血压和血流量在ωn处的相位。|z(ωn)|和∠z(ωn)分别为动脉输入阻抗在ωn处的幅值和相位角。
根据动脉血流传输网络与电路网络的等效关系,将心脏等效为电流源,将血压等效为电路中的电压,血流量等效为电路中的电流,血管网络的顺应性元件、阻力元件、惯性元件分别等效为电路中的电容、电阻和电感,可构建多元件的集中参数电路网络模型,容易知道所设计电路网络的等效阻抗是由一个或多个顺应性C、流感L和流阻R表示的复函数。利用电路等效阻抗的幅值和相位数值拟合主动脉根部的输入阻抗z(ωn)的幅值和相位,使得平方残差之和RSS(Residual Sum of Squares)达到最小值,最终确定的集中模型参数元件值是进一步制作流体力学回路中顺应性C、流感L和流阻R元器件的基础。
(5)
动脉顺应性C可用一个中空的圆柱筒模拟。圆柱筒中充入一定体积的气体,气体的可压缩性代表动脉的弹性,计算公式如下[74]:
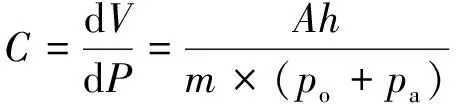
(6)
式中,V为空气柱的体积;P为空气柱内的气压;m为一个多变指数(m≥1),在实验过程的恒定温度下,m=1;A为圆柱筒中空部分的横截面积,h为空气柱高度;po为大气压,pa为圆柱筒内液体作用于筒内空气柱的压力。因此,若已知顺应性C和压力pa,根据式(6)可计算出圆柱筒内空气柱的高度h,作为圆柱筒尺寸选择的参考。
流感L用一段连接管道模拟,可通过如下公式计算[74]:

(7)
其中,ρ为流体密度,l′为管道长度,A′为管道的内截面积。因此,若已知流感L和管道内截面积A′,根据式(7)便可计算出连接管道的长度l′。
流阻R包括管道内的阻力和可调阻力阀的阻力。管道内的阻力一般为固定值。圆管阻力可根据下式估算[74]:
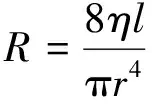
(8)
其中,η为液体黏度,l为管道长度,r为管道半径。
一旦确定了模拟主动脉根部下游动脉系统的所有集中参数元器件,则确定了该系统的输入阻抗特性。进一步通过控制机械泵输出精准模拟主动脉根部的血压波形p(t),则可唯一确定机械泵的输出血流量波形q(t);反之亦然。MCS中的液体介质一般采用密度和黏度与血液密度(~1050 kg/m3)和黏度(~0.004 Pa·s)相近的溶液,如水和甘油混合液等。
2.2 考虑局部动脉解剖结构的MCS
上述基于集中参数模型构成的MCS基本结构通常较为简单,仅体现了心室与后负荷系统相互作用的宏观血流动力学特性,可实现脉动流条件下循环系统整体的血流动力学性能测试。但是,这种基本结构的MCS无法实现大多数力学疗法对循环系统特定区域的灌注效果和相互作用,也无法用于检测分析特定区域动脉内皮附近微环境中的血压、壁面剪应力和牵张应力(或应变)等血流动力学信号。因此,需要对MCS的基本结构进行扩充。
为模拟局部动脉管段的血流动力学特性,首先,需要基于影像学技术获取研究者感兴趣的特定在体动脉管段的局部解剖结构和尺寸,进而基于在体血流动力学原理和CFD数值仿真技术得到整个局部动脉管段的管壁弹性、压力降、血流量以及流阻等;其次,结合前述方法,设计对应的集中参数模型并重新调整元器件值,得到考虑特定动脉管段血流动力学响应的更新的多尺度血流动力学模型;最后,基于更新的模型元器件值,制作更新的体外MCS。
制作特定动脉管段时,可根据获取的在体动脉管段的解剖结构和尺寸,采用3D打印技术,以水溶性材料聚乙烯醇(polyvinyl alcohol, PVA)打印动脉管段,以聚二甲基硅氧烷(Polydimethylsiloxane, PDMS;A胶∶B胶=10∶1)浇筑主动脉根部,水浴溶解PVA后得到高度光滑且光学性能透明的动脉管段PDMS实验模型[39-72],如图4所示。
尽管MCS已经取得了长足发展,但在目前不同生理病理状态以及不同力学疗法条件下,人体循环系统全局和局部血流动力学特性的精准获取还存在检测和分析上的困难,因此,在体外建立MCS以更加精准地模拟全局和局部血流动力学特性,还缺乏系统的理论方法和实验模拟手段。
3 用于细胞力学生物学体外研究的ECCM
上节所述的MCS便于开展宏观的血流动力学检测分析,但该类系统普遍存在尺寸偏大、循环液体量多、没有体外细胞培养腔室等缺陷,不便开展细胞力学生物学研究。ECCM是能够模拟且易于监控血流动力学微环境信号和动脉内皮功能的微型化、客观化、标准化和定量化的研究系统。ECCM主要用于研究不同生理病理状态以及不同力学疗法引起的血流动力学微环境信号对动脉内皮功能的调控,进而研究相关的细胞分子生物学机制[75-77]。用于细胞力学生物学体外研究的ECCM至少包含两方面功能:一是能模拟不同生理病理状态以及不同力学疗法条件下在体内皮微环境中的血流剪应力、血压和牵张应力(或应变)等血流动力学信号;二是具有动脉内皮细胞的体外培养腔。
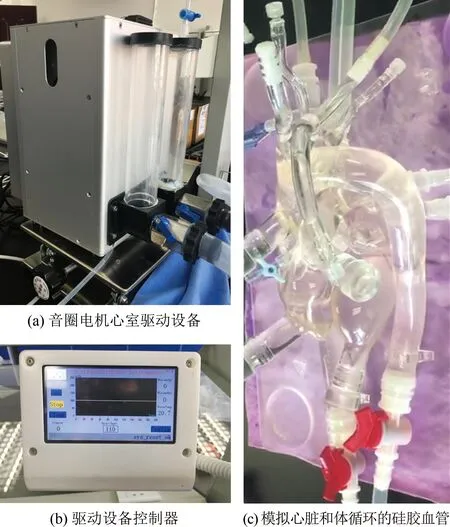
图4 考虑局部动脉解剖结构的MCS实物图
Fig.4 An actual setup of the MCS with consideration of local arterial anatomic structure
20世纪70年代ECCM就已经出现[75-76],迄今已取得长足发展[77]。早期的体外培养模型以模拟剪应力、血压或牵张应力(或应变)的单独作用为主,如单纯模拟血流剪应力环境的平行平板流动腔[78-83]、单纯模拟静压力的培养室[84]以及单纯模拟牵张应变(或应力)的FlexCell装置[85-86]。这些体外模型通常被称为“解构型模型”(Deconstruction-oriented model),即:将在体血流动力学综合因素解析为单个因素,能提供可定量的剪应力、静压力或牵张应力(或应变)的单独作用微环境,用于研究剪应力、静压力或牵张应力(或应变)的单独作用对不同类型细胞形态、分化、增殖、迁移和凋亡等的影响以及相关的机械力信号转导通路、基因表达和蛋白质分子改变[75-80]。
在体大动脉的内皮细胞处于脉动变化的血流动力学环境[2-3]中,同时承受脉动血流剪应力、血压和牵张应力(或应变)的联合作用,而解构型模型无法全面模拟在体脉动血流动力学微环境,因此不能用于研究脉动流剪应力、血压和牵张应力(或应变)组合刺激对心血管细胞形态、结构、功能和行为的影响。其后出现的硅胶管细胞培养模型,能够模拟血流剪应力、血压和牵张应力(或应变)的组合作用,不仅可以同时模拟三者大小,还能重建三者之间的相位关系[87-92]。此类模型即为“重构型模型”,试图尽量重现研究者感兴趣的在体局部解剖区域内的真实血流动力学微环境及其后负荷血流动力学特性的综合影响,研究目标区域微环境中血流动力学因素对细胞的影响及机制[87-92]。
3.1 平行平板流动腔系统
平行平板流动腔系统是模拟动脉内皮细胞承受剪应力作用的装置[78-83]。常见的系统如图5所示,由蠕动泵、上贮液池、下贮液池、平行平板流动腔构成一个液体循环回路系统。核心部件平行平板流动腔用于细胞培养,是由玻璃片、硅胶垫和盖玻片组成的一个高度hp远小于宽度wp和长度Lp的扁平立方体腔室。
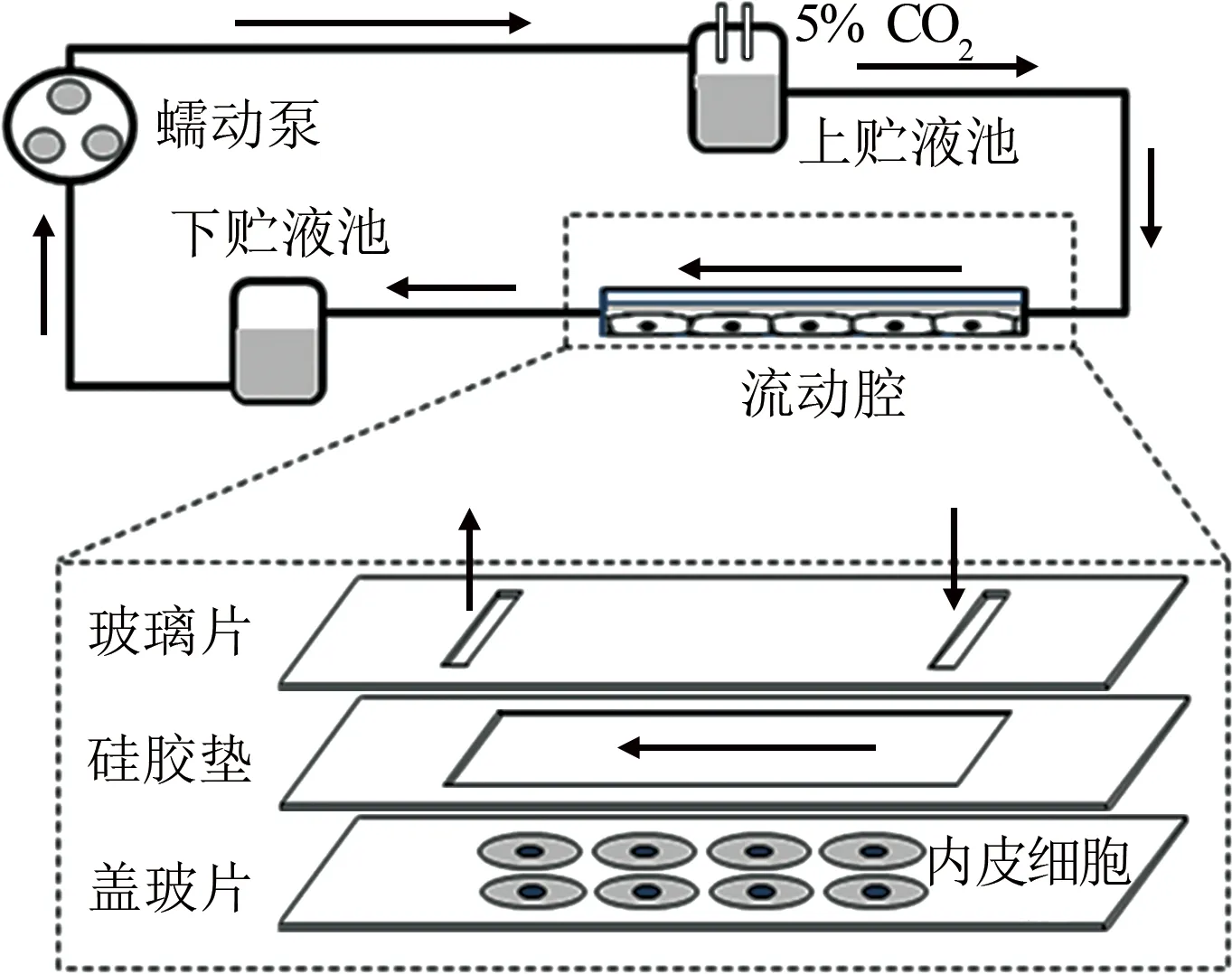
图5 平行平板流动腔系统(基于文献[83]图1重绘)
蠕动泵把液体从下贮液池泵至上贮液池,由上下贮液池的液位差产生驱动压力梯度,对培养于平行平板流动腔底部盖玻片上的细胞产生壁面剪应力作用。定常流情况下,平行平板流动腔底板(盖玻片上表面)壁面剪应力τw计算公式为[93]:
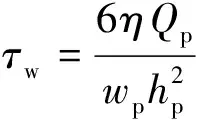
(9)
式中,Qp为流过平行平板流动腔的体积流量。在周期性脉动流情况下,平行平板流动腔内的剪应力计算公式略为复杂[94];然而,由于平行平板流动腔的高度远小于宽度和长度,且腔室内流动的雷诺数很低,满足准定常流假设,剪应力计算公式可简化为式(9)的形式。
3.2 静压力加载装置
静压力加载装置是模拟动脉内皮细胞承受静压力作用的装置[84]。常见的系统如图6所示,由注射器、阀门1、阀门2、压力传感器以及密闭腔室构成一个液体静压力加载系统。密闭腔室是其核心部件,由细胞培养腔和固定底架组成。注射器将液体由阀门1注入或抽出,对培养于细胞培养腔底部的内皮细胞产生静压力(阀门2配合调节静压力大小),压力传感器读取相应的压力值。
3.3 牵张应力(或应变)加载装置
牵张应力(或应变)加载装置是模拟动脉内皮细胞承受牵张应力(或应变)的装置[85-86]。FlexCell系统是常见的商业化牵张应力(或应变)加载装置(图7),其核心部件FlexCell腔室是一个由硅胶膜和培养皿构成的细胞培养腔,与支撑底座、真空泵及计算机监控系统共同构成牵张应力(或应变)加载装置。
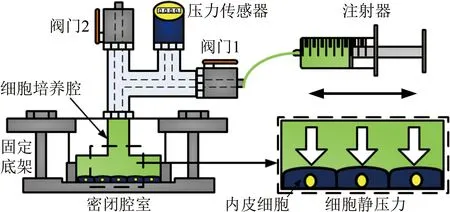
图6 静压力加载装置(基于文献[84]图1重绘)
Fig.6 An apparatus for loading static pressure (adapted from Fig.1 in Ref.[84])
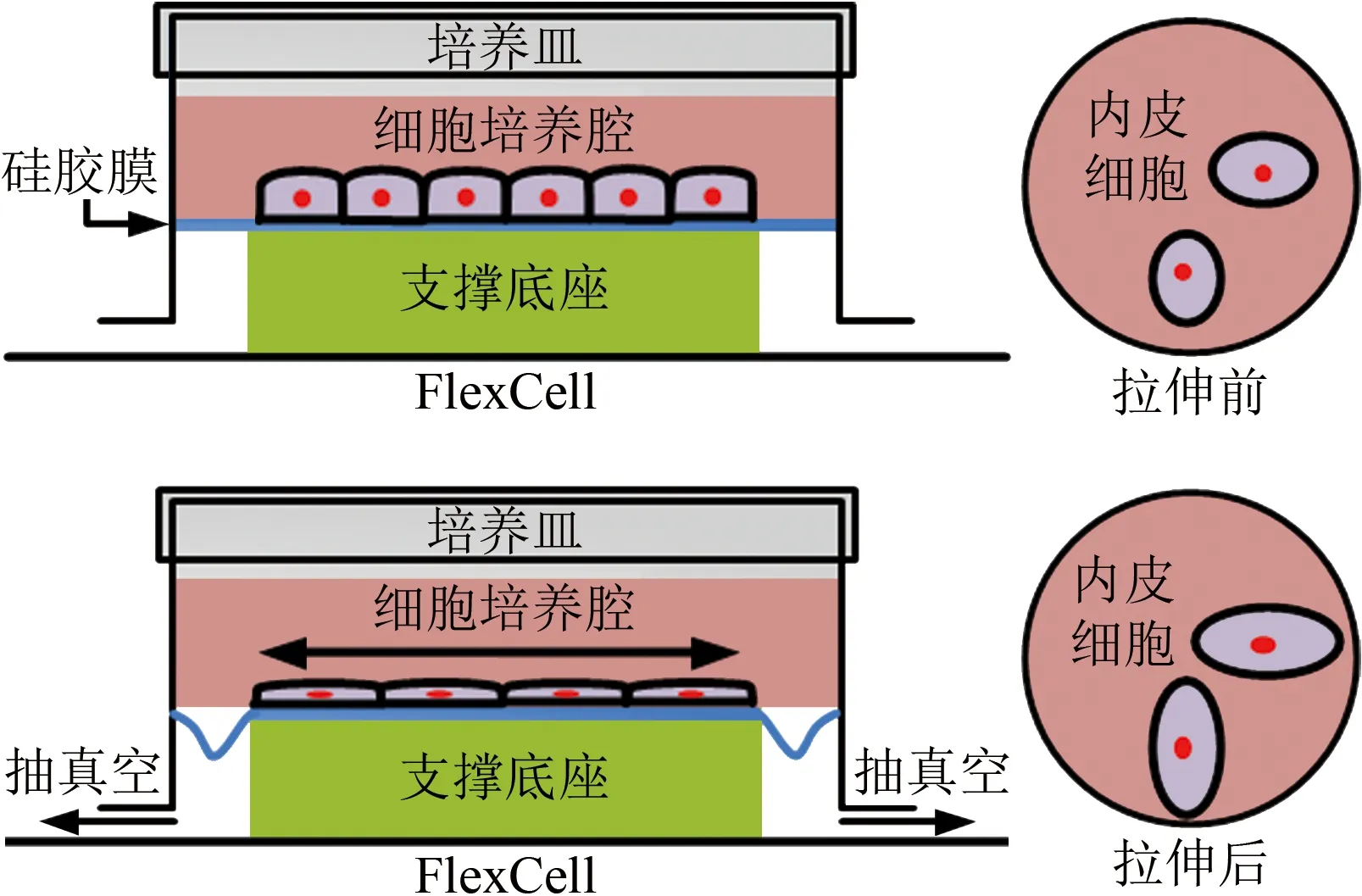
图7 牵张应力(或应变)加载装置(基于文献[86]图1重绘)
以计算机驱动真空泵将空气从FlexCell腔室支撑底座两侧抽出,减小硅胶膜下方腔室压力,使硅胶膜向支撑底座两侧拉伸,对培养于硅胶膜上方的细胞产生牵张应力(或应变)作用。利用检测系统采集硅胶膜对应的牵张应力(或应变)图像,经数据处理得到真空泵产生的负压与牵张应力(或应变)之间的函数关系近似表达式,在压力已知的情况下,可依据该表达式计算实验中的硅胶膜牵张应力(或应变)大小。
3.4 硅胶管流动腔系统
具有硅胶管流动腔的ECCM是模拟动脉内皮细胞承受血压、壁面剪应力和牵张应力(或应变)联合作用微环境的装置[87-90]。常见的系统如图8所示。其核心部件是一个安装在支架上的中空薄壁硅胶弹性圆管,和贮液池、脉动泵、弹性腔、后负荷共同组成一个液体循环回路系统;回路中的压力传感器1、压力传感器2分别检测硅胶管两端的压力,流量传感器检测管路流量。
脉动泵把液体从贮液池泵至整个液体循环回路系统,以弹性腔的顺应性缓冲脉动泵产生的高频噪声。由于硅胶管具有良好的弹性特性,使得液体在系统中循环时,对培养在硅胶管内壁并形成融合单层的动脉内皮细胞加载压力、壁面剪应力和牵张应力(或应变)的联合作用。后负荷由顺应性元件、流感和流阻组成的多元件构成,用于模拟在体局部动脉内皮下游血管床的整体血流动力学特性。在已知硅胶管两端压力波形以及管路流量波形的前提下,根据流体力学原理可以逆向求解硅胶管内壁的压力、壁面剪应力以及牵张应力(或应变)波形。
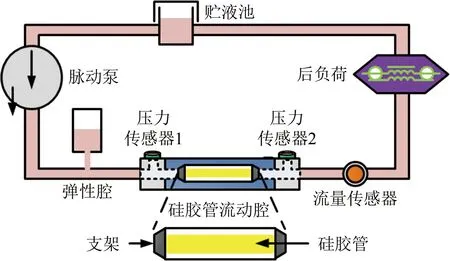
图8 硅胶管流动腔系统(基于文献[90]图2重绘)
3.5 基于微流控技术的ECCM
尽管内皮细胞体外培养模型经历了从解构型模型到重构型模型的研究发展过程,对在体复杂血流动力学微环境的模拟也越来越精细,但是,这些体外模型系统对细胞形态、功能、行为以及信号转导通路、基因表达和蛋白质分子的测量与分析,主要通过对细胞人工取样、采取离线方式进行,一般并不包含对血流动力学刺激下体外培养的心血管细胞响应的在线测量与分析。近年来,随着传感器[95-96]和微流控芯片[91-92, 96-100]技术的飞速发展,研究者能够在微流控芯片上模拟在体循环系统的脉动血流剪应力、血压和牵张应力(或应变)环境[91-92],结合微型传感器[95-96]、显微镜[100]等设备,对血流动力学信号作用下体外培养内皮细胞的功能和行为进行在线监测。
这种基于微流控技术的ECCM,由核心的微流控芯片细胞培养腔以及气体压力加载装置(i)、信号检测装置(ii)和比例-积分-微分(Proportional + Integral + Derivative,PID)反馈控制装置(iii)构成一个液体循环回路及信号监控系统(如图9(a)所示)。其中,微流控芯片细胞培养腔可设计为矩形通道[102]或变截面通道[103]模拟单独剪切力的时空分布,还可设计为如图9(b)所示的“三明治”三层结构[91-92],用与动脉弹性模量类似的弹性薄膜将具有扁平立方体沟道的上下层PDMS隔开形成2个细胞培养腔(图9(b)蓝色部分)。培养腔几何尺寸及弹性薄膜的弹性模量由模拟不同生理病理状态以及不同力学疗法条件下的脉动血压、剪应力和牵张应力(或应变)的实际需要确定;上层培养腔内接入静止液体,下层培养腔接入液体循环通路,使培养于上层培养腔的内皮细胞承受牵张应力(或应变)的单独作用,而培养在下层培养腔的内皮细胞受压力、剪应力以及牵张应力(或应变)的组合作用。


图9 基于微流控技术的ECCM(基于文献[92]重绘)
气体压力加载装置(i)结合PID反馈控制装置(iii)产生精确模拟不同生理病理状态以及不同力学疗法条件下的压力波形,对微流控芯片细胞培养腔加载定量可控的脉动流压力信号;系统的信号检测装置(ii)实时监测微流控芯片的输入端A和输出端B的压力及流量波形,反馈给PID控制装置(iii);调节加载装置(i),定量调控作用于微流控芯片细胞培养腔的压力、流量信号幅度和频率的变化,最终在微流控芯片细胞培养腔产生不同生理病理状态以及不同力学疗法条件下剪应力、血压和牵张应力(或应变)的单独或组合作用。弹性腔、流感及阻力阀为MCS血流动力学特性的流体力学元器件。内皮细胞力学生物学响应动态过程由各种生物力学和生物化学传感器、显微镜结合CCD摄像机检测、记录、保存至反馈控制设备(iii)。
然而,迄今为止,基于微流控技术构建的ECCM对不同生理病理以及不同力学疗法条件下的局部动脉内皮微环境中血流动力学信号的精准模拟还缺乏一套系统的理论方法;另外,对细胞外血流动力学信号的精准监控、动脉内皮细胞响应血流动力学信号的关键生化反应和信号分子变化还缺乏有效的在线监测分析手段。
4 结 论
近几十年来,作为弥补动脉内皮血流动力学微环境信息在体测量技术局限性的重要手段,基于血管医学影像的血流动力学建模仿真方法与量化分析技术已取得了长足进步,极大地促进了研究者对动脉内皮微环境中的血液流动特征、壁面剪应力分布及其与内皮细胞功能异常、动脉粥样硬化发生/发展关系的认知和理解。然而,由于不同患者的血管解剖结构和生理病理状态存在显著差异,在血流动力学建模中引入的不合理边界条件可能造成模型仿真结果严重偏离患者的实际在体状态;另外,基于医学影像的几何模型重构仍存在随机误差大、可重复性差等问题,会进一步影响模型仿真结果与在体血流动力学微环境的一致性。本文作者与合作者针对脑动脉瘤[51, 58, 104]、主动脉[61, 105-106]、颈动脉[22-23, 63]和下肢动脉[105]等开展了一系列建模仿真工作,探讨了血管几何形态、模型边界条件等对血流动力学模拟结果的影响,并初步验证了利用几何多尺度建模融合临床数据来提高建模仿真的患者个性化保真度的可行性[62],为认识或解决上述问题提供了部分依据和思路。在未来工作中,有必要在模型边界的患者个性化设定以及医学图像分割与模型重构等方面开展更深入的理论与方法研究,以实现仿真模型对在体内皮血流动力学微环境的高保真度再现。这将不仅为心脑血管疾病的早期诊断、预防、治疗与康复提供更加精准的血流动力学机制与生理参数,也将为体外精准模拟动脉内皮的血流动力学微环境提供依据。
用于体外评估动脉内皮微环境血流动力学特性的MCS和用于细胞力学生物学体外研究的ECCM能够克服动物实验和临床实验所面临的个体差异大、在体信号检测困难、实验周期长、成本高且存在伦理争论等问题。基于MCS和ECCM,本文作者与合作者开展了心血管细胞力学生物学相关的实验[83, 102-103, 108-109]、微尺度流动与传质分析[93-94, 110-113]、细胞动力学建模[114-116]与控制[117-118]等工作,这些工作拓展了定量化研究细胞力学生物学的思路。然而,目前已有的MCS和ECCM对不同生理病理状态以及不同力学疗法条件下的局部动脉内皮微环境中血流动力学信号的精准模拟,还缺乏一套系统的理论方法;对细胞外血流动力学变量、生化微环境的精确控制尚存在不足,对动脉内皮细胞响应血流动力学信号的关键生化反应和信号分子变化还缺乏有效的在线监测分析手段。这些问题的解决,将为进一步深入研究不同生理病理状态以及不同力学疗法引起的血流动力学微环境改变调控动脉内皮功能的规律及其力学生物学机制提供新的视角,为寻找科学合理的手术与力学康复疗法以逆转动脉功能失调、进而提高心脑血管疾病的治疗与康复效果提供科学依据,具有广阔的临床应用前景。
致谢:感谢大连理工大学王宇副教授与博士研究生于苗、杨雨浓为本文插图制作提供的帮助。
