微流控芯片技术在血细胞变形和流动性分析研究中的应用进展
2020-06-06戚晓菁李学进
戚晓菁, 李学进
(浙江大学航空航天学院工程力学系 流体工程研究所, 杭州 310027)
0 引 言
微流控芯片(Microfluidics)又称芯片实验室(Lab-on-a-chip),是把生物、化学及医学等领域涉及的样品制备、反应、分离、检测等多种技术单元灵活组合、规模集成并完成操控分析的一种微技术平台[1]。由于微流控芯片具有小型化、微量化、定量化及集成化等诸多优势,因此已被广泛应用于生物医学和环境科学等研究领域[2-4]。特别地,由于微流控芯片具有设计灵活的特点,通过多通道阵列组合可提供复杂的微通道网络结构(如直线型、弯曲蛇形、多边形、折叠形),可用于模拟生理和病理环境复杂的微血管环境[5-6]。因此,利用微流控芯片技术研究健康与疾病中血细胞在微血管内的流动和变形性能引起了研究人员的广泛关注。
血细胞又称“血球”,是存在于血液中的细胞,能随血液的流动遍及全身[7]。血细胞通常分为3类:红细胞、白细胞和血小板。红细胞呈双凹圆盘状,直径约为7~8 μm,有一定的弹性和可塑性,主要功能是运送氧;白细胞体积比红细胞大,能作变形运动,具有机体防御和免疫调节功能;血小板呈圆盘形,当受到机械或化学刺激时,则伸出突起,呈不规则形,其主要功能是凝血和止血以及修补破损的血管。机体的生理和病理变化往往会引起血细胞数量或质量(功能)的改变,进而引起贫血、发热、感染、出血和血管栓塞等临床症状。例如,在微血管系统中,红细胞在组织的氧合作用中发挥着重要作用。当红细胞流过狭窄毛细血管时,由于存在剪切应力,红细胞会在毛细血管中发生压缩变形,进而促进红细胞与周边组织的氧气交换[8]。而在病理状态下,红细胞变形性能的下降阻碍了细胞通过微血管的转运。
血液是一种具有相当黏性的流体,其在血管内的流动行为有着明显的黏性流动特性[9]:在靠近血管壁处血液流动满足斯托克斯流特征,而在远离血管壁的区域则又呈现明显的泊肃叶流特征(图1(a))。因此,血液在血管内流动时,红细胞在惯性升力和细胞-血管壁相互作用下会发生变形并迁移至血管中间区域。我们知道,红细胞几乎占据了40%~45%的血液体积,因此,血管中红细胞的迁移及运动行为主导了血流动力学并致使白细胞和血小板向血管壁附近区域迁移(图1(b))。利用血流这一特殊的动力学特征,人们发展了多种微流控芯片装置,用于分离和采集特定类型的血细胞,并在临床诊断和个性化治疗等方面发挥了重要的作用(图1(c))。本文将结合国内外最新研究进展,以健康和疾病中的血细胞为例,从单细胞变形、流动、黏附等性能表征及多细胞分离和迁移动力学等方面简单归纳目前微流控芯片技术在血细胞力学分析和表征方面的应用进展。
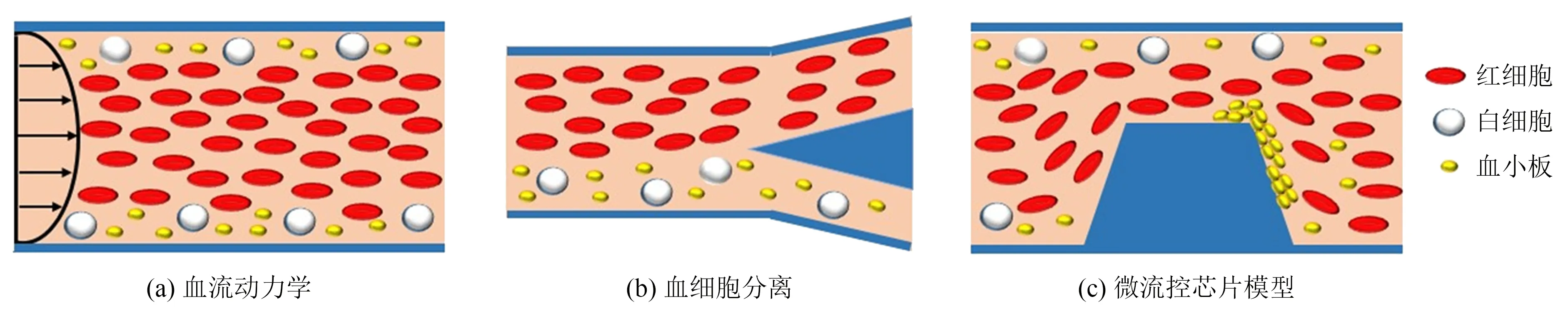
图1 血细胞在血管内流动的动力学特征及微流控仿生模型设计
1 微流控芯片在血细胞变形和流动性能研究中的应用
1.1 血细胞在毛细微管道内的流动和变形
需氧代谢是人体维持生命活动的基本条件,血液的运输功能主要依靠红细胞来完成。在血液循环过程中(特别是在微循环过程中),红细胞必须具有良好的变形性能才能顺利地通过口径比它小的毛细血管网和血窦孔隙[7]。然而,在病理条件下,红细胞变形性能降低,高切黏度增高,从而增加了血液的外周阻力,影响到血液循环以及组织和器官的血液供应。因此,研究红细胞的变形性能,对理解基本的血液循环及血液疾病的临床表现均具有重要意义。基于此,人们发展了单通道和多通道等不同类型的微流控芯片装置,用于探索红细胞在毛细管内的流动行为和变形性能。单通道微流控芯片指在一个芯片上仅含有一个微通道,结构相对简单,可准确检测单个血细胞在毛细管道内的流动及变形性能;多通道微流控芯片也称为集成微通道芯片,其在一块芯片上包含有多个微通道,这样便可以在同一芯片上同时并行处理多个样品,具有高通量和高灵敏度的特点,从而提高了微流控芯片通量及检测效率。此外,多通道微流控芯片的多维网格结构可模拟复杂的血管分支网络和血流微循环环境,可用来研究微血管堵塞及血栓形成过程。由于多通道芯片结构复杂、控制参量多,因此对实验操作及控制条件(如压力梯度、来流速度等)提出了更严格的要求。本文重点综述这方面的一些研究工作。
1.1.1 单通道微流控芯片
单通道微流控芯片可在高灵敏度下研究红细胞在毛细血管内的流动,并直接观察到细胞、亚细胞水平的动态和不连续过程,从而帮助人们更好地认识几种红细胞疾病。例如,李巨及其合作者设计了一种单通道微流控芯片来研究红细胞随毛细血流的流动特征(图2)[10]。他们发现当红细胞挤入狭窄的毛细管道时(微通道尺寸只有4 μm),细胞会发生很大的变形(图2(c)),但一旦穿过后则很快恢复其最初的圆盘状结构(图2(d))。同时,他们基于亚细胞层面的红细胞模型结果分析,认为细胞骨架重组可能是这种大变形的原因。Quinn等利用类似的微流控芯片装置,对红细胞在毛细血管内的流动规律进行了定量探索[11]。通过调节通道出入口压力梯度控制流体流速,他们分析了不同压降下红细胞通过毛细管的流动速度,发现细胞流动速度随压力梯度近乎呈线性变化。由此可见,基于单细胞微流控芯片的实验和亚细胞层面的模型分析可以帮助人们理解红细胞在毛细血管内的流动规律。
人们也通过电学测量的手段研究毛细管内流动红细胞的变形性能[12-13]。我们知道,流过毛细管的红细胞经历了瞬时形状演变,而其特征形状的恢复时间,可以作为红细胞变形性能的标志之一。在恒定剪切力下,红细胞流过与其自身尺寸相近的毛细管时,会发生挤压变形。通过实验发现,红细胞变形的严重程度与沿微流体通道施加的电流的信号强度成比例[12]。基于此,人们可以通过红细胞的特征伸长指数推断其变形性能。
红细胞血液病是血液系统发病率较高的疾病。近年来的研究表明红细胞的膜结构及变形性能与很多血液疾病的发生和发展都密切相关。目前,人们通过微流控芯片可测定病变红细胞的变形性能,从而获得有关血液疾病临床状态以及药物疗效的一些关键信息[14-16]。例如,Shelby等设计了一种单通道微流控芯片来测定恶性疟原虫感染的红细胞(后文简称“疟疾感染红细胞”)的变形性能变化[14]。他们从患者血液中获取不同感染程度的红细胞,并将其放在黏性流体中稀释,然后使其通过不同尺寸的狭窄矩形毛细微管道(图3)。这些感染的红细胞有不同的形状和刚柔性,进而影响其在微通道内的流动行为。他们发现感染初期的环状体(Ring)红细胞可正常通过毛细微管道(图3(a1)~(a4)),而处于滋养体(Trophozoite)阶段的红细胞可通过较宽尺寸(6和8 μm)的微管道,但无法顺利通过更狭窄(2和4 μm)的微管道。但是,处在裂殖体(Schizont)阶段的红细胞变形性能明显减弱,仅能通过8 μm的毛细管(图3(b1)),而无法通过6 μm及以下的毛细管(图3(b2)~(b4))。
Guo等设计了一种轻便的微流控芯片装置来研究疟疾感染红细胞变形性能的变化[15]。这种微流控装置借助一系列紧压的“漏斗形收缩”使得红细胞变形通过(图4(a)~(b)),然后根据测定的推动细胞流过“漏斗形收缩”的压力大小分析感染红细胞的变形性能。结果表明,在恶性疟原虫感染红细胞的各个阶段实时精确测定感染红细胞的变形性能是可能的(图4(c))。
1.1.2 多通道微流控芯片
利用微流控芯片装置进行血细胞性能分析时,由于单个血细胞的尺寸很小,因此往往只能对微量的血液样本进行检测。在多数情况下,感染或者病变血细胞在微量血液样本中含量极少。因此,如何从微量血样中对含量极少的感染红细胞进行分析检测是一个亟待解决的问题。为此,人们设计了多通道微流控芯片,可在高通量和高灵敏度下对血细胞进行直接的力学分析和变形性能测量。同时,微流控芯片的多维网络结构可连通成网, 可以模拟复杂的几何形态和更逼真的血流微循环环境。目前,多通道微流控芯片已被用于研究健康与疾病中血细胞的变形、聚集及微血栓形成等方面。根据本课题组及合作者在此领域的实验积累,介绍以下3个方面的研究进展。
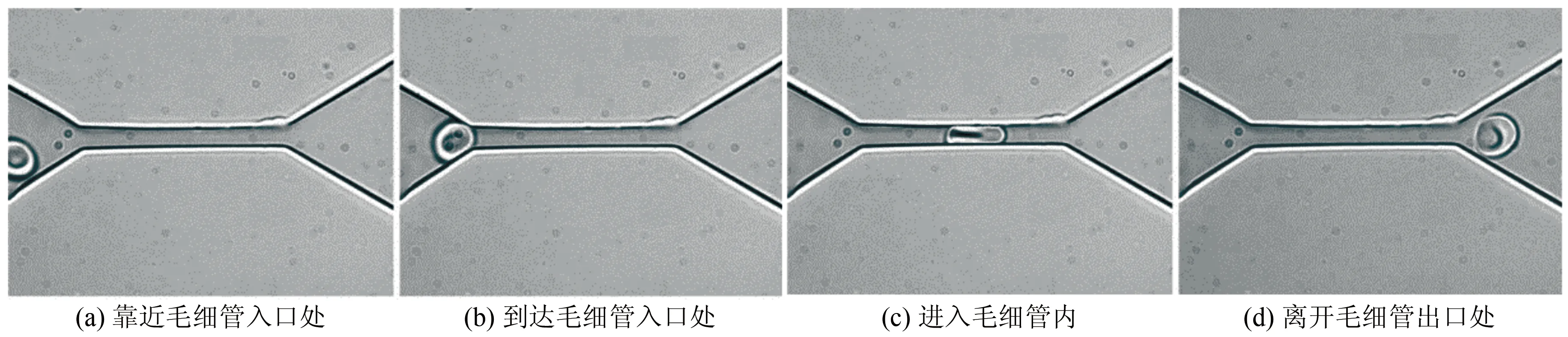
图2 基于单通道微流控装置研究健康红细胞在毛细管内的流动和变形[10]。(a)~(d)显示红细胞在流过毛细管不同区域时的变形
Fig.2Invitromicrofluidic model for investigating the translocation process of a healthy human red blood cell (RBC) through a microcapillary[10]. The series of images (a)~(d) show the shape of the RBC as it is squeezed through the narrow microchannel
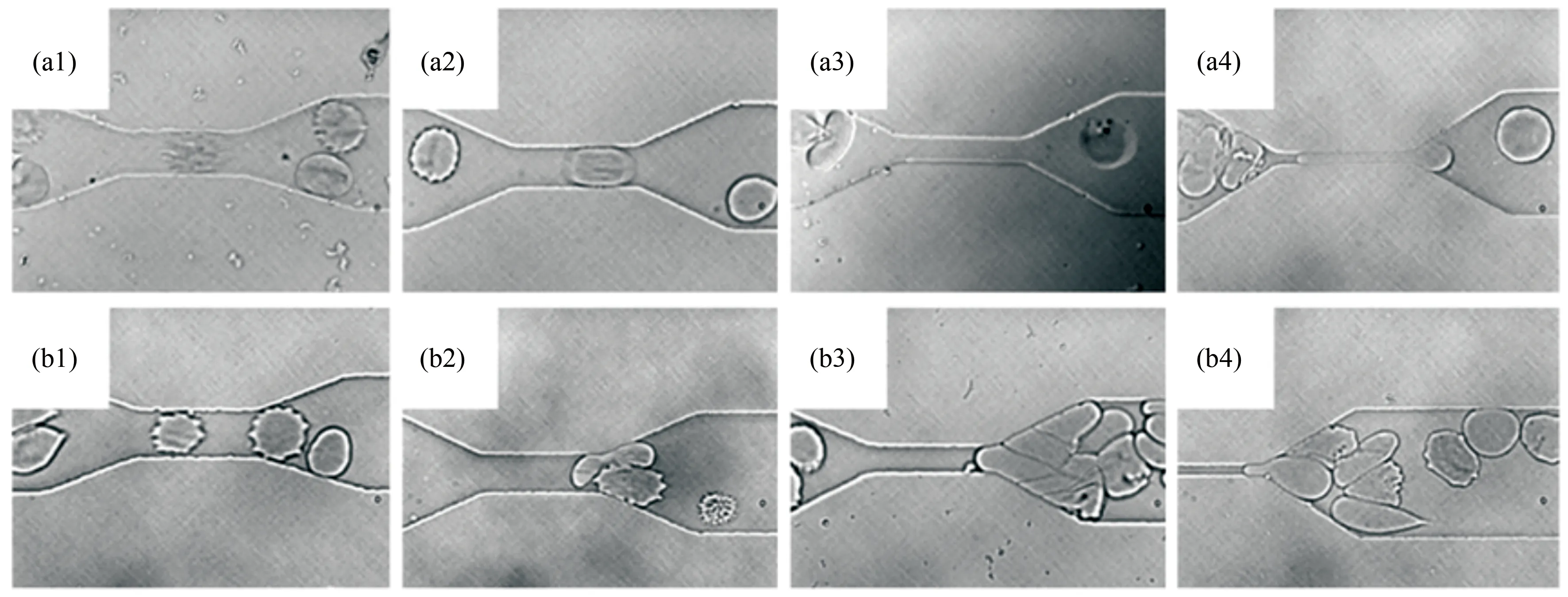
图3 基于单通道微流控装置研究疟疾感染红细胞在不同尺寸的毛细管内的流动及堵塞行为[14]。自左至右毛细管的宽度分别为8、6、4及2 μm。感染初期的环状体红细胞可顺利通过毛细管道((a1)~(a4));感染末期处于裂殖体阶段的红细胞仅能通过8 μm的毛细管道(b1),但无法通过6 μm及以下的毛细管并导致微通道的堵塞((b2)~(b4))
Fig.3 Micrographs of malaria-infected RBCs traversal across microfluidic channels. Ring-stage infected RBCs can pass through all constricted microchannels ((a1)~(a4)); schizont-stage infected RBCs block all but the 8 μm microchannel ((b1)~(b4))
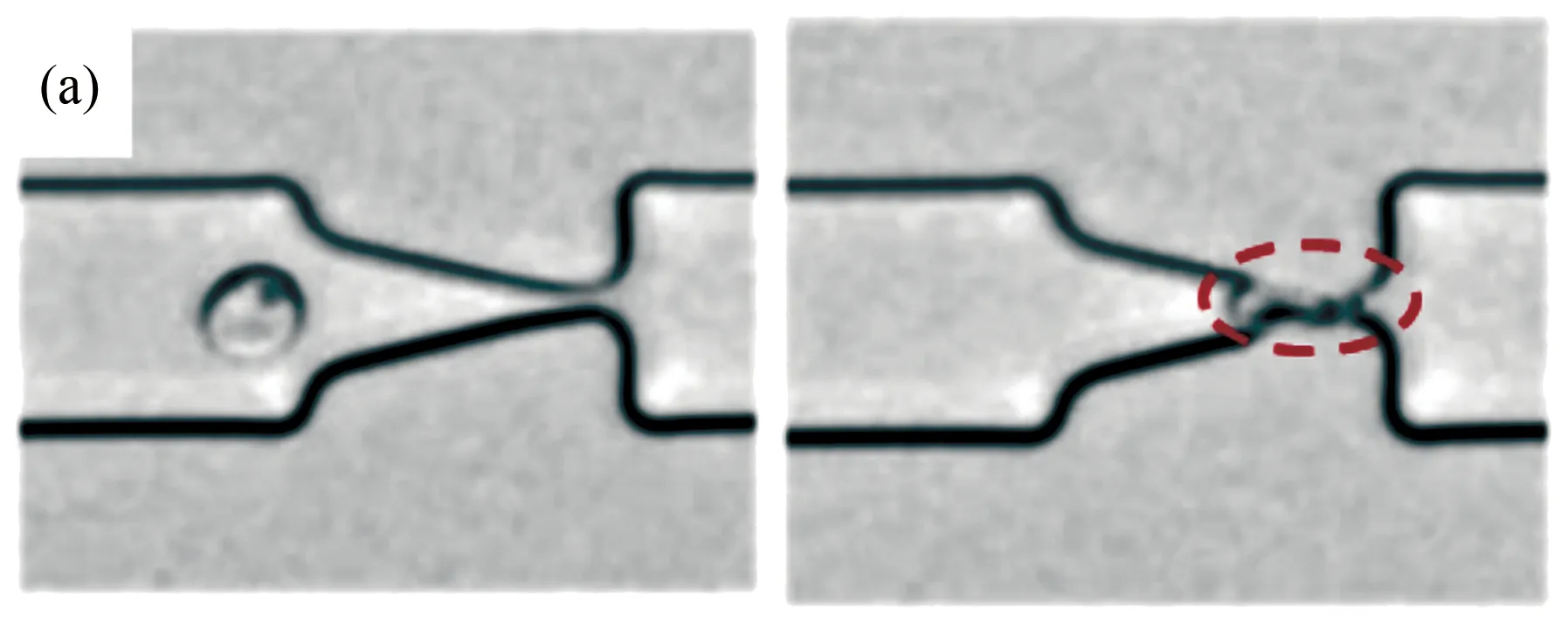
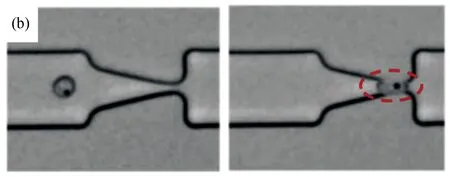
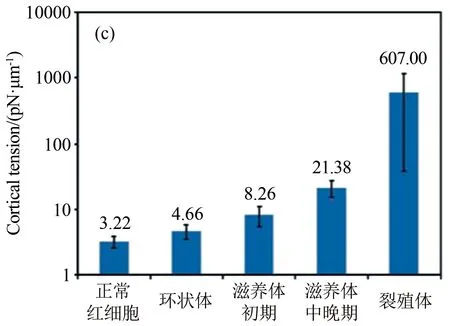
图4 基于单通道“漏斗形收缩”微流控装置研究疟疾感染红细胞的流动及变形行为[15]。(a) 感染初期的环状体红细胞在较小的压力梯度下可通过漏斗形收缩微管道;(b) 感染末期处于裂殖体阶段的红细胞则需要较大的压力梯度才能通过微细管;(c) 基于实验结果统计得到的不同感染阶段的红细胞膜皮质张力
Fig.4 Analysis of the flow behavior and deformability of malaria-infected RBCs in microfluidic channels with multiple funnel-shaped constrictions. (a) A ring-stage infected RBC could transit rapidly through the funnel constriction at a low pressure; (b) A schizont-stage infected RBC, which is hardly deformed, requires a high pressure to drive through the constriction; (c) Histogram of the measured cortical tension of uninfected and malaria-infected RBCs
(1) 基于多通道微流控装置研究疟疾感染红细胞在毛细管内的流动行为。Bow等设计了一种多通道微流控装置,可从仅含有极少量疟疾感染红细胞的血样中对感染红细胞进行直接的变形性能检测[17]。他们设计的微流控装置上有多组并排的、宽度仅为3 μm的微管道阵列(图5(a))。当红细胞在微流道内流动时,必须通过变形以流过微管道阵列(图5(b),箭头所示)。相比健康红细胞而言,疟疾感染红细胞更难挤入狭窄微通道,且在微流道内流动速度更慢,说明受感染的红细胞变形性能有明显的降低。同时,他们发现微管道入口的形状(收缩式入口及发散式入口)也会对红细胞的流动行为有明显的影响。相比于发散式入口微管道结果,受感染的红细胞更容易进入收缩式入口微管道,且其在微流道内的流速也有明显的增加。因此,借助该微流控芯片装置可以更好地分析受感染的红细胞的流动行为,并帮助医学工作者更好地诊断疾病。

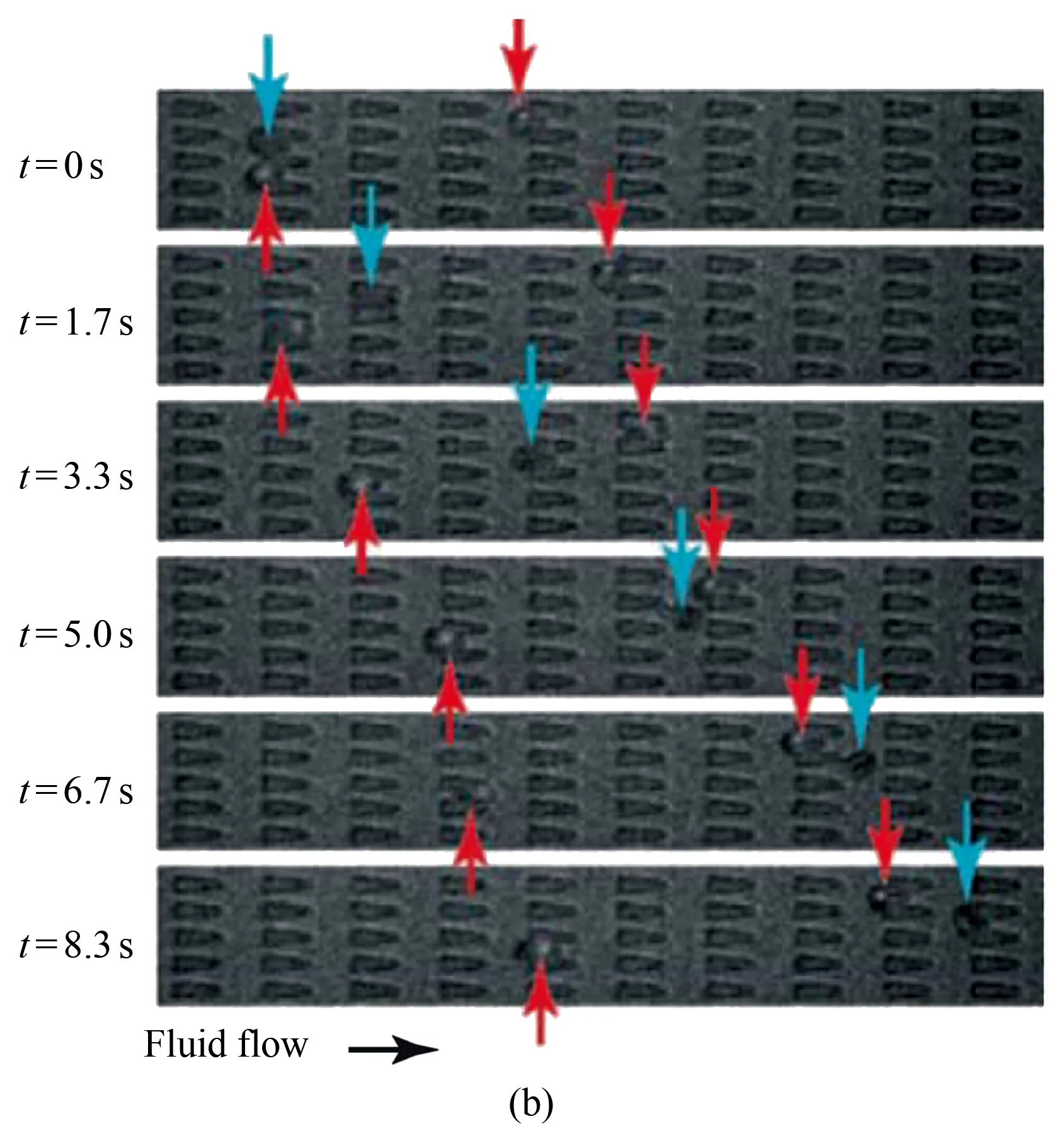
图5 基于多通道微流控装置研究受疟疾感染红细胞在毛细管内的流动行为[17]。(a) 微流道装置示意图。微流道内有多组并排的宽度仅为3 μm的微管道阵列,红细胞流过微管道阵列时需变形才能通过; (b) 通过实验获得的健康红细胞(蓝色箭头所示)和疟疾感染红细胞(红色箭头所示)在多通道毛细管内的流动现象
Fig.5 Microfluidic platform for studying the flow behavior of malaria-infected RBCs in the microchannel[17]. (a) Schematic diagram of the device design; the spacing between pillars is 3 μm and the depth of the device is 4.2 μm; (b) Micrographs of uninfected (blue arrows) and malaria-infected (red arrows) RBCs in the microchannel
(2) 基于多通道微流控装置研究镰状细胞贫血症下红细胞的镰变过程及其对细胞变形和流动的影响。镰状细胞贫血症是一种常见的遗传性血液疾病,也是人类发现的第一个分子疾病[19]。其临床表现为慢性溶血性贫血、易感染和再发性疼痛危象以致局部缺血从而导致器官组织损害[20]。为了探索红细胞的镰变过程及其导致的毛细血管堵塞现象,研究人员需要对红细胞所处微环境的氧气浓度进行调控并模拟镰变红细胞在毛细血管内的流动和堵塞情况。然而,从实验角度来看,利用常规实验仪器实现这样的细胞微环境有较高难度。Du等利用互联多通道微流控装置克服了这一局限[18, 21]。该装置允许研究人员调控氧气水平和脱氧程度,进而控制红细胞的镰变过程并分析红细胞从发生镰变到诱发镰状细胞危象的整个过程(图6(a)和(c))。他们发现,当氧气浓度非常低或处于缺氧状态时,红细胞发生镰变,不但在外形上由圆盘状变成镰刀状(图6(b)),其变形性能也有明显异常:镰状红细胞变形性能差,进而在微管道阵列中发生堵塞(图6(d))。同时,他们发现红细胞镰变的初期是可逆的,给予氧可逆转细胞镰变过程。所以,一旦把镰变红细胞置于有氧环境时,红细胞可迅速恢复圆盘状结构且可通过变形流过微管道[21]。
此外,镰变红细胞还可使血液黏滞性增加,血流缓慢,加之变形性能差,易堵塞毛细血管和小静脉血管,从而引起局部缺氧和炎症反应导致相应部位产生疼痛危象[20]。为了探索镰变红细胞如何与血管相互作用引发血管栓塞,Papageorgiou等人利用互联多通道微流控芯片装置研究了镰状红细胞黏附毛细管道壁的动力学过程[22-23]。实验结果表明,镰变初期的红细胞在毛细管中可显著地黏附于管道壁,缺氧会进一步增强这些红细胞的黏附,但是对镰变末期的红细胞无明显影响;同时,他们发现镰状网织红细胞表现出独特的黏附动力学行为:镰状网织红细胞可以从细胞表面向外生长的镰状纤维处产生新的黏附位点,进而促进细胞黏附。该互联多通道微流体模型的实验结果证实了镰变初期的红细胞在微环境中导致血管栓塞形成的重要作用。该芯片的设计接近体内微血管通道,可作为一种易于使用的体外模型,用来探索毛细微通道中病变红细胞的黏附及流动行为。
(3) 血液疾病微血管阻塞及血栓模型。微血栓是微循环的血管中由于血细胞或纤维蛋白互相粘结而成的一种均质无结构的微小血栓。由于微血栓尺寸小,所以在一般的病理检查(包括X光、B超、心电图等)时难以发现,其在体内的形成过程更难以检测。近年来,人们借助微流控芯片技术尝试研究微血管阻塞及微血栓形成过程[5, 24]。例如,Tsai等设计了一种微流控器件来模拟变狭窄的小动脉血管,可以在生理和病理血流下分析微血管堵塞及血栓形成的过程[25]。该微流控器件内含有多组互通且分叉的微管道(最小尺寸为30 μm),以模拟毛细血管后小静脉和动脉形成的复杂血管网络(图7)。利用该微流控芯片可模拟包括血液-内皮细胞黏附、多细胞聚集等力学因素导致的血流动力学环境的变化,以及模拟包含肿瘤坏死因子a (TNF-a)、突触融合蛋白2 (STX2)等在内的多种生化因素促使微血管血栓形成的过程。借助该微流控芯片,他们还定量研究了羟基脲(Hydroxyurea)药物对镰状细胞贫血症引发的微血管堵塞的影响,发现该药物可降低微血管栓塞的几率,从而为解释该药在临床上的药效作用提供了细胞水平的依据。该研究表明,基于微流控芯片的微血管堵塞及血栓模型是连接体外实验和体内实验的一座桥梁,为血液疾病微血管栓塞的病理研究及相关药物筛选提供了条件。

图6 基于多通道微流控装置研究镰状细胞贫血症下红细胞的流动和变形性能[18]。(a) 通过调控氧气水平和脱氧程度控制红细胞的镰变和可逆转镰变过程;(b) 当处于缺氧状态时,红细胞发生镰变后导致其形状发生变化(黄色箭头所示);(c) 微流道装置示意图。微流道内有多组并排的宽度仅为4 μm的微通道阵列,红细胞需变形才能通过;(d) 在有氧(上图)和脱氧条件(下图)下,观察红细胞在毛细管道内的流动及堵塞现象
Fig.6 Microfluidic platform for studying sickle cell behavior under transient hypoxic conditions[18]. (a) Schematic diagram of microfluidic device; (b) Visual determination of cell sickling events from morphological changes in RBC membrane; (c) Schematic diagram of microfluidic device; the microfluidic channel contains periodic obstacles forming 15-μm-long, 4-μm-wide and 5-μm-high microgates; (d) Individual RBC behavior under oxygenated (Oxy, upper) and deoxygenated (DeOxy, lower) states[18]
图7 基于多通道微流控装置模拟微血管堵塞及血栓形成过程[25]。(a) 微流控芯片装置图;(b) 微流控芯片中多通路微管道网络示意图,其中最中间一排的微管道宽度只有30 μm;(c) 微流控芯片上“内皮细胞化”微血管分叉结构;(d) 血细胞-内皮细胞黏附及多细胞聚集导致的微血管堵塞现象
Fig.7Invitromicrofluidic microvasculature model for modeling of the microvascular occlusion and thrombosis that occur in hematologic disease[25]. (a)~(b) Illustration of the device design; (c) Characterization of the “endothelialized” microvasculature on the chip; (d) The observation of microchannel occlusion due to a combination of increased adhesion and cell stiffness
1.2 血细胞分离和采集
血细胞分离和采集是从全血中把某种特定类型的血细胞(如红细胞、白细胞和血小板等)分离、纯化并进行采集,在生物学和医学研究以及血液疾病临床诊断和治疗中具有非常重要的作用[26-27]。通过微流控芯片装置可以对少量血样快速、高效地检测并分离出不同种类的血细胞。目前,以微流控芯片为研究平台的血细胞分离采集方法主要有2种:(1) 以细胞微结构和物理/力学特性为基础的细胞被动分离[28-29];(2) 通过在微流控通道中施加外加力场驱动细胞分离[30-31]。
1.2.1 以血细胞微结构和物理/力学特性为基础的细胞分离
流体流动时,在黏弹性效应和惯性效应作用下,大颗粒将向靠近侧壁的横向位置迁移。类似地,当血液在血管中流动时,尺寸较小的柔性红细胞将迁移至血管中间区域,而尺寸较大的刚性白细胞及肿瘤细胞将向血管壁周围迁移。利用这一特殊的血流动力学特征,一些课题组设计了微流控芯片用于分离并采集不同类型的血细胞。例如, Liu等基于细胞物理特性和流体黏弹性效应设计了一种微流控芯片,不同大小的细胞在微流道内流动至不同的通道:红细胞汇聚在中间通道,而肿瘤细胞在两侧通道内富集[28],成功实现了循环肿瘤细胞和红细胞的完全分离。此外,他们通过改变作用于囊泡的流体力,成功实现了外泌体从胞外囊泡的分离采集[32]。类似地,Zhang等利用该方法实现了红细胞与血浆的加速分离[33]。Hou等设计了一种可以控制液体流动的微流控芯片,通过不同的管道设计与流速调节改变微流道内的流体力学特征,进而利用血细胞在大小、形状及刚柔力学特性的不同,从微量血液样品中分离出了特定的血细胞,包括疟疾感染的红细胞[34]、循环肿瘤细胞[35]及不同种类的白细胞[36-37],最终达到了检测的目的。


图8 基于惯性效应和黏弹性效应设计的微流控装置用于特定类型血细胞的分离采集[34-35]。(a) 微流道内疟疾感染红细胞和健康红细胞的分离[34];(b) 微流道内循环肿瘤细胞、白细胞和红细胞的分离[35]
Fig.8 Schematic illustration of cell separation in microfluidic channels based on cell size and deformability[34-35]. (a) Separation of malaria-infected RBCs and uninfected RBCs in microfluidic channel[34];(b) Separation of RBCs, white blood cells (WBCs) and tumor cells in microfluidic channel[35]
1.2.2 通过在微流控通道中施加外加力场驱动的细胞分离
通过在微流控通道中施加外加力场驱动细胞分离的方式主要包括介电电泳力驱动、磁场作用力驱动、超声波驱动等3种。
(1) 介电电泳力驱动。介电电泳技术描述的是位于非均匀电场的中性微粒由于介电极化的作用而产生的平移运动。当处于非均匀电场中时,血细胞产生极化现象,其表面会产生偶极矩,进而在介电电泳力的作用下,向更强的电场强度方向移动(阳性介电电泳)或者更弱的电场强度方向移动(阴性介电电泳)。由于血细胞所受介电电泳力的大小取决于血细胞的大小和形状、以及悬浮媒介的介电性质和黏度特性等因素,因此在微流控芯片上进行介电电泳可实现血细胞的分离[38-39]。介电电泳细胞分离技术具有无需标记、无需表面修饰和特异性高的特点,因此, 以微流控芯片介电电泳为基础的分离采集技术在血细胞分离领域已被广泛应用。例如,Nascimento等利用微流控介电电泳实现了受寄生虫感染的红细胞与健康红细胞的分离采集[40]。当红细胞受到寄生虫感染后,其细胞膜微结构和表面抗原会发生一定程度的变化,同时,细胞膜通透性也会有一定程度的增强,导致感染红细胞和健康红细胞在介电场中所受介电电泳力的方向和大小都有不同,进而迁移至不同的微通道,实现分离采集的目的。
(2) 磁场作用力驱动。对目标血细胞用微型磁珠进行磁性标记,被磁性标记的血细胞流经磁场区域时,磁场作用力使目标血细胞偏离原来的运动轨道。不同大小和磁化率的血细胞流经梯度磁场时所受磁场作用力不同从而实现分离采集。例如,Karabacak等利用惯性效应及磁场效应设计了一种微流控芯片装置,成功实现了对纯循环肿瘤细胞的分离富集[30]。这套微流控装置前半部分的微通道内布满了倾斜的微柱阵列,尺寸小的红细胞/血小板和尺寸大的白细胞/癌细胞在微柱阵列中受到惯性升力不同而分离至不同的微通道(图9(a))。接下来,白细胞和癌细胞的悬浮液经过中间微通道流经磁场区域,在磁场作用力和流体驱动力的共同驱动下流向不同的收集通道,从而将低浓度的癌细胞从白细胞中分离出来(图9(a))。Zhao等利用磁流体对不同类型细胞的作用力不同设计了2种微流控装置(图9(b)),实现了循环肿瘤细胞和白细胞/红细胞的分离[41]。另外,利用磁流体方法可测量红细胞在磁性介质中的悬浮情况,进而评估红细胞的变形性能。例如,Tasoglu等将红细胞浸入溶液里,然后注入夹在2个磁体中间的毛细管中[42]。磁力从毛细管底部到顶部垂直减小,因此红细胞的最终平衡位置由细胞的密度确定。这种方法可以区分并分离健康和被感染的红细胞。
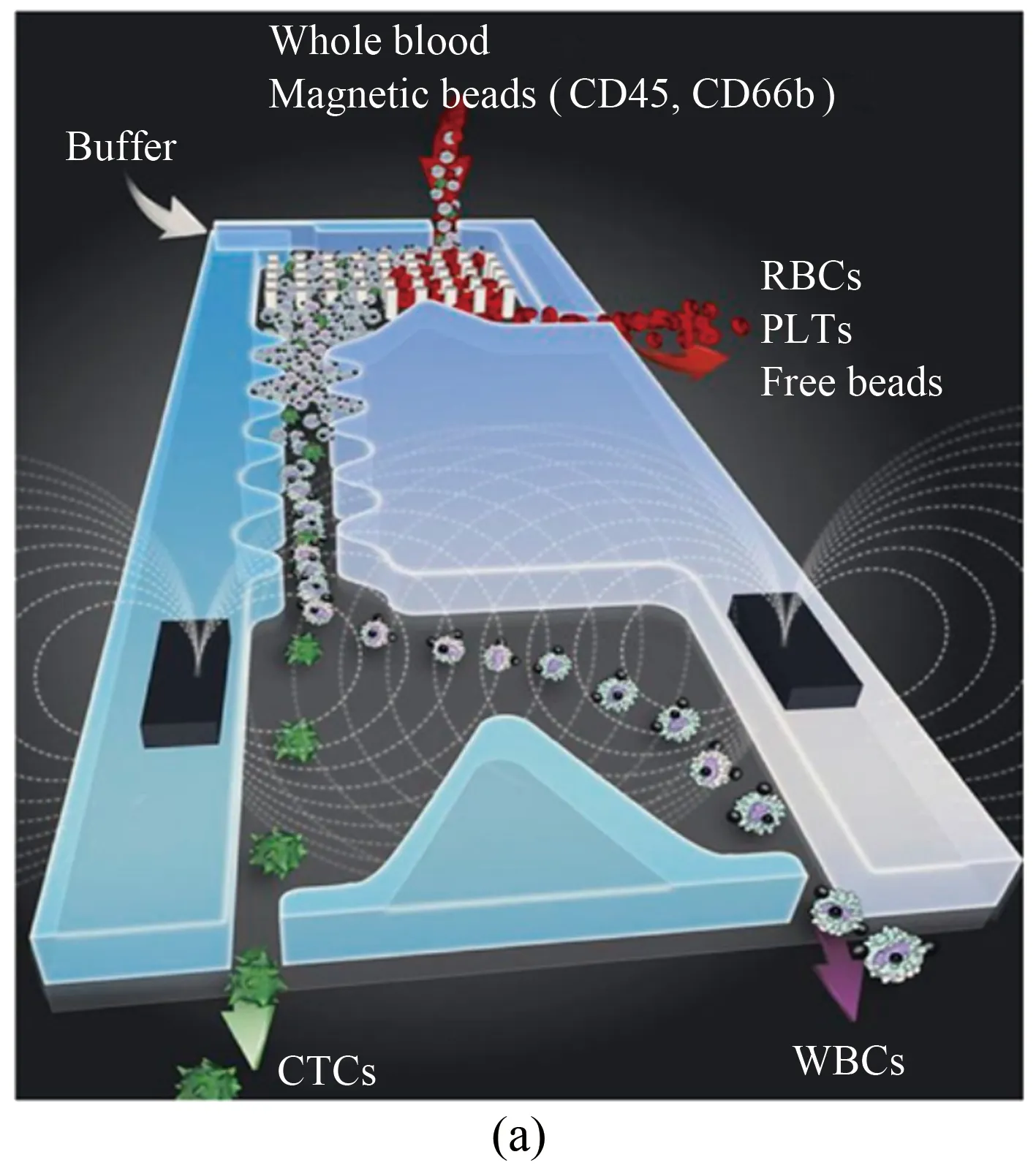



图9 微流控通道中细胞分离示意图。(a)~(b) 基于惯性升力和磁场效应从微量血液样品中实现肿瘤细胞和血细胞的分离采集[30, 41];(c)~(d) 通过超声波微流控装置从血细胞混合液中分离肿瘤细胞[43-45]
Fig 9 Schematic illustration of cell separation in microfluidic channel. (a)~(b) Separation of blood cells and tumor cells in ferrofluids[30, 41];(c)~(d) acoustic separation of tumor cells from blood samples[43-45]
(3) 超声波驱动。对通过微通道的流体施加一定角度的声波,其产生的压力可推动悬浮在液体中的颗粒移动。与正常的血细胞相比,声波对癌细胞的推力更大,故可将肿瘤细胞推到单独的微通道。例如,Ding等人设计了一个外加表面声波的微流控装置实现了循环肿瘤细胞的分离捕获[44]。这套微流控装置的两端装有2个产生声波的传感器(图9(c))。当两股声波相遇时,产生的压力能推动细胞移动。他们利用此方法从乳腺癌患者的血液中成功检测到极为罕见的肿瘤细胞[45]。Collins等使用高频聚焦表面声波垂直作用于流体,进而推动流体流动并在微通道中产生流体涡流[43]。他们利用流体涡流形成的涡旋实现了多种不同尺寸颗粒的分离捕获,并从红细胞和癌细胞混合液中成功捕获了乳腺癌细胞(图9(d))。基于微流控超声波驱动的细胞分选具有无需配体、无需标记和生物兼容的特点,同时,由于每个细胞仅在不到1 s的时间内经历声波,因此,与其他细胞分离捕获技术相比,该技术显得更为温和,对分离血细胞损伤的风险大大降低。
1.3 血细胞机械疲劳损伤
软物质材料会在长期的循环应变作用下发生损伤和断裂,也就是机械疲劳。类似的,在生物细胞中,例如红细胞,在循环应力的作用下也会产生机械疲劳。Du及其合作者基于介电电泳技术设计了一种包含振幅调制电极的微流控芯片,研究了循环机械应变下单个红细胞的机械疲劳损伤行为[46-47]。实验结果表明,在一定的循环载荷下,红细胞会产生机械疲劳效应;同时,在相同的累积加载时间和相同的最大载荷下,动态循环载荷比静态载荷对红细胞膜的损伤更大[48]。此外,他们发现不同的载荷形态(如方波载荷、拟正弦波载荷等)对红细胞膜损伤的影响程度也有所不同:与拟正弦波载荷实验结果相比,循环方波载荷对红细胞膜机械变形影响更为显著。他们还发现机械疲劳效应会导致磁滞和能量耗散,持续的机械疲劳对血细胞的结构完整性和生物学功能有着不利影响。这样的疲劳测试平台可用来定量表征血液循环过程中单个血细胞累积的细胞膜损伤,帮助人们了解血细胞的应力波动对其生物力学特性的影响。
2 总结及展望
红细胞变形性能对血流性质有重大影响,它是决定高切率下血液黏率的关键因素。许多血液病变是由于红细胞变形性能低下导致的。例如,疟疾感染红细胞和贫血症下镰状红细胞的变形性能会减弱,不利于红细胞通过狭窄毛细血管[49-50];遗传性球形红细胞增多症下球形红细胞由于体表比增加进而使红细胞很难变形[51-52]。目前,人们已发展一些实验技术来研究病变红细胞的变形性能及生物力学响应,然而,在单细胞水平研究红细胞的变形和流动特征仍面临很大挑战。近些年来迅速发展的微流控芯片技术凭借其特有的优势为健康与疾病中的红细胞力学性能研究提供了一个很好的平台。随着微流控芯片技术的不断发展,如何模拟更复杂的几何形态和更逼真的血流微环境,把血细胞形状的动态变化和各种疾病的病理变化及临床表现联系起来,将是未来工作的一个重点和难点。
同时,基于微流控芯片技术的器官芯片(Organ-on-a-chip)近几年来发展迅速,已经实现了体外模拟多种活体细胞、组织及器官微环境[53]。为适应人类器官及血管的复杂性,未来的研究需要建立更加复杂的多器官微流控芯片(Multi-organ-on-a-chip)系统,将不同器官芯片模型应用到类似人体的血液循环环境中。目前热门的3D生物打印技术具有精确的控制能力和个性化特点,使得“定制”人体组织器官成为可能。通过在芯片上打印特定带血管的器官,可以更好地模拟细胞、血管及组织微环境并建立患者特异化(Patient-Specific)的血管及器官模型,进而从细胞-组织-器官等不同层面多尺度探索相关疾病的发生机制,并进行更加系统的药物毒性检测和药效评估。
