瑞香狼毒化学成分抑制PC-12细胞神经突起生长活性研究
2020-06-04肖淇文田均勉
肖淇文,田均勉
(西北农林科技大学 化学与药学院,陕西杨凌 712100)
瑞香狼毒(StellerachamaejasmeL.)为瑞香科植物,又名断肠草,用药部位为其根,广泛分布于中国西北、西南、东北及河北等地,资源十分丰富[1]。其性味苦平,有逐水祛痰、破积杀虫之功效, 其根已被用于中药作为乳液和皮肤病药物[2]。近年来国内外对其化学成分的研究报道较多,该植物主要含有双黄酮、木脂素、香豆素、二萜等成分,具有抗菌、抗结核、抗肿瘤及抗病毒尤其是抗HIV的活性[3-6]。
神经生长因子(NGF)是第一个被发现且目前研究得最为透彻的神经营养因子,在神经元的生长发育、轴突的生长、递质的合成及细胞的凋亡等阶段起着重要作用,是人和动物体内必不可少的多功能因子[7]。PC-12细胞,也称为大鼠肾上腺嗜铬细胞瘤细胞,可以与NGF结合发生神经元样分化,可作为一个细胞模型用于神经生物学和神经化学的研究[8]。NGF在PC-12细胞的膜上有TrkA和p75两类受体,NGF与TrkA受体结合后,激活了细胞内的多条信号通路,诱导PC-12细胞的神经突起生长[9]。同时大量临床前证据表明,阻断NGF与 TrkA的作用可以减轻疼痛和痛觉过敏;动物模型试验已证实,使用抗NGF抗体或非选择性小分子TrkA抑制剂阻断NGF-TrkA信号可抑制疼痛[10-11]。目前尚未有瑞香狼毒中神经突起生长活性研究,为此本研究以湖北恩施瑞香狼毒为试验材料,提取可能具有活性的化合物,以期找到活性优良的药物先导化合物。
1 材料与方法
1.1 试验材料
所用瑞香狼毒于2012年8月采于湖北恩施,并由西北农林科技大学吴振海高级实验师鉴定为瑞香狼毒StellerachamaejasmeL.。标本(20120820SC)保存于西北农林科技大学陕西省天然产物化学生物学重点实验室。Bruker AVANCE-500核磁共振仪(TMS为内标);ESI-MS采用Thermo Fisher LTQ Fleet;HPLC(QuikSep P0050,慧德易),GF254薄层层析硅胶板、柱层析硅胶(100~200目、300~400目)及薄层层析硅胶H为青岛康鼎公司生产。反相硅胶PR-C18(YMC公司产品,日本);凝胶为GE生产;石油醚、氯仿、乙酸乙酯、丙酮、甲醇等有机溶剂均为分析纯,天津试剂厂生产。PC-12 细胞(未分化)购自中国科学院典型培养物保藏委员会细胞库/中国科学院上海生命科学研究院细胞资源中心。注射用鼠神经生长因子(NGF)购自武汉海特生物制药股份有限公司。
1.2 试验方法
干燥瑞香狼毒根50 kg,粉碎后以95%工业乙醇回流提取,浓缩回收乙醇得总浸膏。对浸膏依次以石油醚、乙酸乙酯和正丁醇萃取,分成石油醚、乙酸乙酯、正丁醇和水相等四个部分。
将乙酸乙酯萃取部位3.2 kg用硅胶(100~200目)拌样进行柱色谱分离,用石油醚-乙酸乙酯梯度洗脱(9∶1、8∶2、7∶3、6∶4、5∶5、 4∶6、0∶10;每个梯度50 L),最后用甲醇(50 L)洗脱,经薄层色谱(TLC)分析,合并相同组分得Eu-1~Eu-10,然后将其中的Eu-8(800 g)继续用硅胶(100~200目)拌样进行柱色谱分离,用石油醚-乙酸乙酯(9∶1、8∶2、7∶3、6∶4、5∶5、 4∶6、 0∶10)梯度洗脱,经TLC检测,合并相同部分得到Eu-8-1~Eu-8-5。Eu-8-4(418 g)继续经硅胶柱层析分离,共分为7段,另命名为RL1~RL7。将RL4(315.8 g)经中压正相硅胶柱色谱分离得到RL4B1~RL4B18。RL4B2(1.457 g)经正相硅胶和凝胶分离,得到化合物(4)(700 mg)。RL4B5(2.198 g)反相硅胶柱色谱,甲醇-水 (1∶10- 1∶0)分离后得到(6)(79 mg)和化合物(7) (6 mg)。RL4B6(1.260 g)经过正相硅胶和凝胶柱(氯仿-甲醇1∶1)纯化后得到化合物(8)(351 mg)。RL4B7(430 mg)和RL4B8(2.574 g)合并后再次经过硅胶柱层析后得到化合物(5) (7 mg)和化合物(1)(10 mg)。RL4B9(131 mg)由甲醇溶解后,经过半制备HPLC(色谱柱:YMC-Pack ODS-A,250×10 mm,5 μm,12 nm;溶剂:70%甲醇-水,流量:3 mL/min)纯化得到化合物(2)(20 mg, tR=14 min)和化合物(3)(23 mg, tR=21 min)。将Eu-6(70 g)重新用硅胶(100~200目)拌样进行色谱分离,用石油醚-乙酸乙酯 (9∶1、 8∶2、7∶3、6∶4、5∶5、4∶6、 0∶10)梯度洗脱,经TLC检测,合并相同部分得到F1~6,将其中的F6(10.9 g)经过正相硅胶和凝胶(氯仿-甲醇 1∶1)纯化后得到F6C1~3,将F6C2(216 mg)再次使用凝胶柱(甲醇)分离后得到化合物(1)(27.1 mg)。
1.3 NGF介导促神经突起生长活性测定
NGF用PBS(磷酸缓冲液pH 7.2~7.4)溶解,配成NGF原液(20 μg/mL)。待测化合物用DMSO溶解,配成化合物原液(50 mmol/L)。PC-12细胞在F-12完全培养基(10% HS和5% FBS)中生长72 h,之后将PC-12 细胞在24孔板培养24 h待细胞贴壁后,换用新鲜的F-12低血清培养基。NGF原液用PBS稀释至终质量浓度为 20 ng/mL,待测化合物原液用低血清培养基稀释(化合物1~4终浓度为:25 μmol/L),并分别加入24孔板中。化合物作用72 h后,在倒置显微镜下观察PC-12细胞的形态变化。将含一个或多个神经突起,并且至少有一个神经突起的长度达到胞体直径1倍的细胞视为阳性细胞,选取多个随机视野进行细胞计数,每个随机视野中至少有100个细胞,试验重复3次。细胞分化率计算公式:细胞分化率=有效细胞数/总细胞数。
2 结果与分析
2.1 结构鉴定
化合物(1)为白色无定形粉末,易溶于甲醇溶剂,有紫外吸收。ESI-MS给出分子离子峰为m/z689.2 [M+Na]+,C37H46O11。1H NMR(CD3OD, 500 MHz): δH0.81(m, H, H-8′), 0.93(d, 3H,J=6.3 Hz, H-10′), 0.99(d, 1H,J=4.7 Hz, H-9′), 1.07(m, 1H, H-7′), 1.13(m, 1H, H-5′), 1.15(m, 1H, H-4′), 1.23(d, 1H,J=13.6 Hz, H-6′), 1.47(m, 1H, H-6′), 1.48(m, 1H, H-7′), 1.49(m, 1H, 1.49, H-3′), 1.50(m, 1H, H-5′), 1.61(m, 3H, H-19), 1.69(m, 1H, H-4′), 1.74(s, 4H, H-17,3′), 1.85(m, 1H, H-2′), 2.04(m, 1H, H-2′), 2.16(m, 2H, H-12), 2.21(m, 1H, H-11), 2.31(m, 1H, H-8′), 2.64(dd, 1H,J=9.9, 3.6 Hz, H-1), 2.83(d, 1H,J=3.8 Hz, H-10), 3.24(m, 1H, H-8), 3.40(s, 1H, H-7), 3.68(d, 1H,J=12.6 Hz, H-20), 3.86(d, 1H,J= 12.9 Hz,H-20), 4.37(m, 2H, H-14,18), 4.53(s, 1H, H-5), 4.85(s, 1H, H-16), 4.91(d, 1H,J=12.3 Hz, H-18), 4.99(s, 1H, H-16), 7.51(m, 2H, H-Bz-3′,5′), 7.63(m, 1H, H-Bz-4′), 7.98(d, 2H,J=8.2 Hz, H-Bz-2′,6′) ppm。13C NMR(125 MHz): δC19.3(C-17), 20.1(C-19), 20.2(C-10′), 23.6(C-3′), 25.4(C-4′), 26.2(C-5′), 28.0(C-6′), 28.2(C-7′), 32.6(C-2′), 34.2(C-12), 34.7(C-8′), 36.2(C-8), 39.2(C-9′), 44.3(C-11), 55.9(C-1), 56.2(C-10), 59.3(C-7), 61.6(C-6), 62.5(C-20), 69.5(C-5), 71.4(C-18), 81.9(C-9), 82.3(C-14), 85.2(C-13), 88.6(C-4), 111.8(C-2), 113.2(C-16), 121.5(C-1′), 129.9(Bz-3′,5′), 130.6(Bz-2′,6′), 131.4(Bz-1′), 134.6(Bz-4′), 147.6(C-15), 168.1(Bz-CO), 176.6(C-3) ppm。通过和文献[12]报道的数据比对,确定该化合物为Stelleralide C(图1-1)。
化合物(2)为淡红色粉末,易溶于甲醇溶剂,有紫外吸收。ESI-MS给出分子离子峰为m/z1107 [2M+Na]+,C30H22O10。1H NMR(CD3OD, 500 MHz): δH4.61(d, 1H,J= 12.0 Hz, H-11), 5.72(s, 2H, H-16, 18), 6.10(d, 1H,J=1.9 Hz, H-6), 6.20(d, 1H,J=1.9 Hz, H-8), 6.33(d, 1H,J=12.0 Hz, H-12), 6.54(d, 2H,J=8.5 Hz, H-22, 24), 6.60(d, 2H,J=8.5 Hz, H-28, 30), 7.02(d, 2H,J=8.5 Hz, H-21, 25), 7.16(d, 2H,J=8.5 Hz, H-27, 31), 7.96(s, 1H, H-2)。13C NMR(125 MHz): δC49.7(C-11), 54.9(C-12), 94.7(C-8), 96.1(C-16, 18), 100.0(C-6), 105.8(C-10), 106.6(C-14), 115.9(C-28, 30), 116.0(C-22, 24), 122.4(C-3), 130.1(C-21, 25), 131.1(C-27, 31), 135.4(C-26), 136.2(C-20), 156.6(C-23, 29), 156.7(C-2), 159.3(C-9), 163.5(C-5), 165.5(C-17), 165.7(C-15, 19), 166.4(C-7), 181.7(C-4), 204.9(C-13)。其核磁数据与文献[13]报道的狼毒色原酮(Chamaechromone)的核磁数据基本一致,故确定该化合物为狼毒色原酮(图1-2)。
化合物(3)为黄色粉末,易溶于甲醇溶剂,有紫外吸收。ESI-MS给出分子离子峰为m/z1107 [2M+Na]+,C30H22O10。1H NMR(CD3OD, 500 MHz):δH3.14(m, 1H, H-3), 3.27(dd, 1H,J=8.8, 3.5 Hz, H-3′), 5.14(d, 1H,J=8.8 Hz, H-2″), 5.55(d, 1H,J=4.7 Hz, H-2), 5.76(d, 1H,J=2.2 Hz, H-6), 5.78(d, 1H,J=2.2 Hz, H-6″), 5.87(d, 1H,J=2.2 Hz, H-8), 5.98(d, 1H,J=2.2 Hz, H-8″), 6.65(d, 2H,J=8.5 Hz, H-3′, 5′), 6.79(d, 2H,J=8.5 Hz, H-3″′, 5″′), 6.93(d, 2H,J=8.5 Hz, H-2′, 6′), 7.15(d, 2H,J=8.5 Hz, H-2″′, 6″′)。13C NMR(CD3OD, 125 MHz):δC50.0(C-3), 50.9(C-3″), 81.6(C-2), 83.4(C-2″), 96.2(C-8), 96.5(C-8″), 97.2(C-6), 97.4(C-6″), 103.9(C-10), 105.2(C-10″), 116.3(C-3′, 5′), 116.5(C-3″′, 5″′), 128.6(C-2′, 6′), 128.9(C-1′), 129.2(C-1″′), 130.4(C-2″′, 6″′), 158.7(C-4′), 159.1(C-4″′), 163.5(C-9), 165.3(C-5, 9″), 165.6(C-5″), 168.4(C-7), 168.6(C-7″), 196.4(C-4), 198.7(C-4″)。通过和文献[14]报道的数据比对,确定该化合物为新狼毒素B(Neochamaejasmin B)(图1-3)。
化合物(4)为黄色粉末,易溶于甲醇溶剂,有紫外吸收。ESI-MS 给出分子离子峰为m/z565 [M+Na]+,C30H22O10。1H NMR(CD3OD, 500 MHz):δH3.76(m, 2H, H-3, 3″), 4.79(m, 2H, H-2, 2″), 5.75(s, 2H, H-6, 6″), 5.89(s, 2H, H-8, 8″), 6.80(d, 4H,J=8.5 Hz, H-3′, 5′, 3″′, 5″′), 7.02(d, 4H,J=8.5 Hz, H-2′, 6′, 2″′, 6″′)。13C NMR(CD3OD, 125 MHz): δC51.4(C-3, 3″), 82.6(C-2, 2″), 96.3(C-8, 8″), 97.5(C-6, 6″), 102.9(C-10, 10″), 116.7(C-3′, 5′, 3″′, 5″′), 129.1(C-1, 1″′), 130.9(C-2′, 6′, 2″′, 6″′), 159.9(C-4′, 4″′), 164.5(C-9, 9″), 165.6(C-5, 5″), 168.5(C-7, 7″), 197.0(C-4, 4″)。通过和文献[15]报道的数据对比,最终确定该化合物为异新狼毒素A(Isoneochamaejasmin A)(图1-4)。
化合物(5)为白色固体,易溶于氯仿溶剂,难溶于石油醚等低极性有机溶剂,有紫外吸收。ESI-MS中出现m/z275 [M+H]+,C15H14O5。1H-NMR(CDCl3, 500 MHz) :δH2.57(1H, dd,J=16.2, 8.2 Hz, H-4), 2.92(1H, dd,J=16.2, 5.5 Hz, H-4), 4.03(1H, m, , H-3), 4.64(1H, d,J=7.9 Hz, H-2), 5.95(1H, d,J=2.2 Hz, H-6), 6.01(1H, d,J=2.2 Hz, H-8), 6.81(1H, d,J=8.5 Hz, H-3′, 5′), 7.23(1H, d,J=8.5 Hz, H-2′, 6′)。13C-NMR(CDCl3, 125 MHz):δC28.6(C-4), 68.7(C-3), 82.6(C-2), 95.7(C-6), 96.5(C-8), 101.1(C-10), 116.1(C-3′, 5′), 129.6(C-2′, 6′), 131.3(C-1′), 156.8(C-9), 157.3(C-5), 157.5(C-7), 158(C-4′)。其光谱数据与文献[16]中枇杷素的光谱数据对照基本一致,故鉴定为枇杷素(Afzelechin)(图1-5)经过查阅文献发现为首次从该植物中分到。
化合物(6)为黄色针晶,能够溶于甲醇,有紫外吸收。ESI-MS给出分子离子峰为m/z287 [M+H]+,C15H10O6。1H NMR(CD3OD, 500 MHz): δH6.19(m, 1H, H-6), 6.40(m, 1H, H-8), 6.91(d, 2H,J=6.0 Hz, H-3′, 5′), 8.08(d, 2H,J=6.0 Hz, H-2′, 6′)。13C NMR(CD3OD, 125 MHz): δC94.7(C-8), 99.5(C-6), 104.7(C-10), 116.5(C-3′, 5′), 123.9(C-1′), 130.8(C-2′, 6′), 137.3(C-3), 148.3(C-2), 158.4(C-5), 160.6(C-4′), 162.6(C-9), 165.7(C-7), 177.6(C-4)以上数据和文献[17]一致,鉴定该化合物为山萘酚(kaempferol) (图1-6)。
化合物(7)为白色结晶,能够溶于甲醇、氯仿-甲醇混合溶剂,有紫外吸收。ESI-MS中出现了m/z743 [2M+Na]+,C20H24O6。1H NMR(CD3OD, 500 MHz): δH1.77(m, 1H, H-8′), 2.00(m, 1H, H-8), 2.77(d, 2H,J=7.6 Hz, H-7), 3.40(dd, 1H,J=11.3, 4.1Hz, H-9′), 3.66(m, 1H, H-9), 3.67(m, 1H, H-9), 3.70(dd, 1H,J=11.3, 4.1 Hz, H-9′) 3.76(s, 3H, 3-OMe), 3.78(s, 3H, 3′-OMe), 3.80(s, 1H, H-7′), 6.20(s, 1H, H-5), 6.61(dd, 1H,J=8.2, 1.3 Hz, H-6′), 6.64(s, 1H, H-2), 6.68(d, 1H,J=1.6 Hz, H-2′), 6.74(d, 1H,J=7.9 Hz, H-5)。13C NMR(CD3OD,125 MHz): δC33.7(C-7), 40.2(C-8), 48.1(C-7′), 48.2(C-8′), 56.5(3-OMe), 56.6(3′-OMe), 62.5(C-9′), 66.1(C-9), 112.6(C-2), 114.0(C-2′), 116.2(C-5′), 117.5(C-5), 123.3(C-6′), 129.2(C-1), 134.3(C-6), 138.7(C-1′), 145.3(C-4), 146.0(C-4′), 147.3(C-3), 149.1(C-3′)。通过对比文献[18]数据,发现该化合物的核磁数据和异落叶松脂醇完全相同,因此该化合物结构被确定为异落叶松脂醇(Isolariciresinol)(图1-7)经过查阅文献发现为首次从该植物中分到。
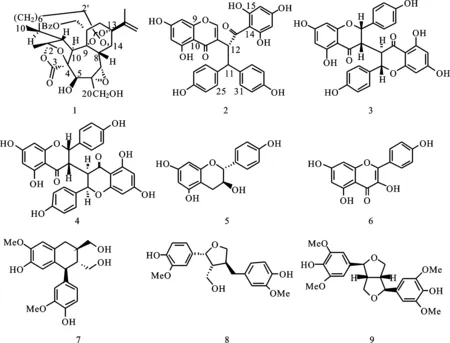
图1 化合物1~9的化学结构Fig.1 Chemical structure of compounds 1-9
化合物(8)为白色晶体,能够溶于甲醇、氯仿-甲醇混合溶剂,有紫外吸收。ESI-MS中出现了m/z743 [2M+Na]+,C20H24O6。1H NMR(CD3OD, 500 MHz): δH2.38(m, 1H, H-8), 2.50(dd, 1H,J=13.5, 11.5 Hz, H-7′), 2.73(m, 1H, H-8′), 2.93(dd, 1H,J=13.5, 4.7 Hz, H-7′), 3.64(dd, 1H,J=11.0, 6.3 Hz, H-9), 3.72(dd, 1H,J=8.4, 6.1 Hz, H-9′), 3.83(dd, 1H,J=11.0, 6.3 Hz, H-9), 3.83(s, 3H, 3-OMe), 3.84(s, 3H, 3′-OMe), 3.98(dd, 1H,J=8.4, 6.8 Hz, H-9′), 4.75(d, 1H,J=6.9 Hz, H-7), 6.64(dd, 1H, H-6′), 6.72(d, 1H, H-5′), 6.77(s, 2H, H-5, 6), 6.80(d, 1H,J=1.3 Hz, H-2′), 6.91(s, 1H, H-2)。13C NMR(CD3OD, 125 MHz): δC33.8(C-7′), 44.0(C-8′), 54.2(C-8), 56.6(3,3′-OMe), 60.7(C-9), 73.7(C-9′), 84.3(C-7), 111.0(C-2), 113.7(C-2′), 116.2(C-5), 116.4(C-5′), 120.0(C-6), 122.4(C-6′), 133.7(C-1′), 136.0(C-1), 146.0(C-4), 147.2(C-3), 149.2(C-3′,4′) ppm, 与文献[19]对照,确定该化合物为(-)-落叶松树脂醇((-)-lariciresinol)(图1-8)经过查阅文献发现该化合物为首次从该植物中分到。
化合物(9)为无色结晶,能够溶于甲醇、氯仿-甲醇混合溶剂,有紫外吸收。ESI-MS中出现了m/z441 [M+Na]+,C22H26O8。1H NMR(CD3OD, 500 MHz): δH3.04(m, 2H, H-8, 8′), 3.76(s, 12H, 3,3′, 5, 5′-OMe), 3.85(dd, 2H,J=9.0, 2.5 Hz, H-9, 9′), 4.22(dd, 2H,J=9.0, 6.8 Hz, H-9, 9′), 4.67(d, 2H,J= 3.8 Hz, H-7, 7′), 6.53(s, 4H, H-2, 2′, 6, 6′)。13C NMR(CD3OD, 125 MHz): δC53.8(C-8, 8′), 55.8(-OMe×4), 71.3(C-9, 9′), 85.5(C-7, 7′), 102.4(C-2, 2′, 6, 6′), 131.5(C-1, 1′), 133.9(C-4, 4′), 146.8(C-3, 3′, 5, 5′),通过与文献[20]核磁数据进行对照,该化合物的结构被确定为消旋丁香脂素((-)-syringaresinol)(图1-9)。
2.2 NGF诱导神经突起生长活性测定结果
测定化合物1~4的NGF诱导神经突起生长活性测定结果(图2,图3),与空白对照0.1%DMSO(2.5%)和 20 ng/mL的NGF 对照 (16.29%)相比,化合物1~4(25 mmol/L)与 NGF(20 ng/mL)共同作用于PC-12细胞72 h后,其细胞分化率降低,分别为10.87%(化合物2)、 7.67%(化合物3)、10.47%(化合物4)。经PC-12的MTT细胞毒活性试验发现,化合物 1~9均没有细胞毒活性,且化合物2~4促进了细胞活力。所以化合物2~4(25 μmol/L)表现为明显的抑制NGF依赖的神经突起生长活性(P<0.05)。而化合物1(25 μmol/L)对 PC-12 细胞表现出强烈的NGF介导的细胞毒活性。
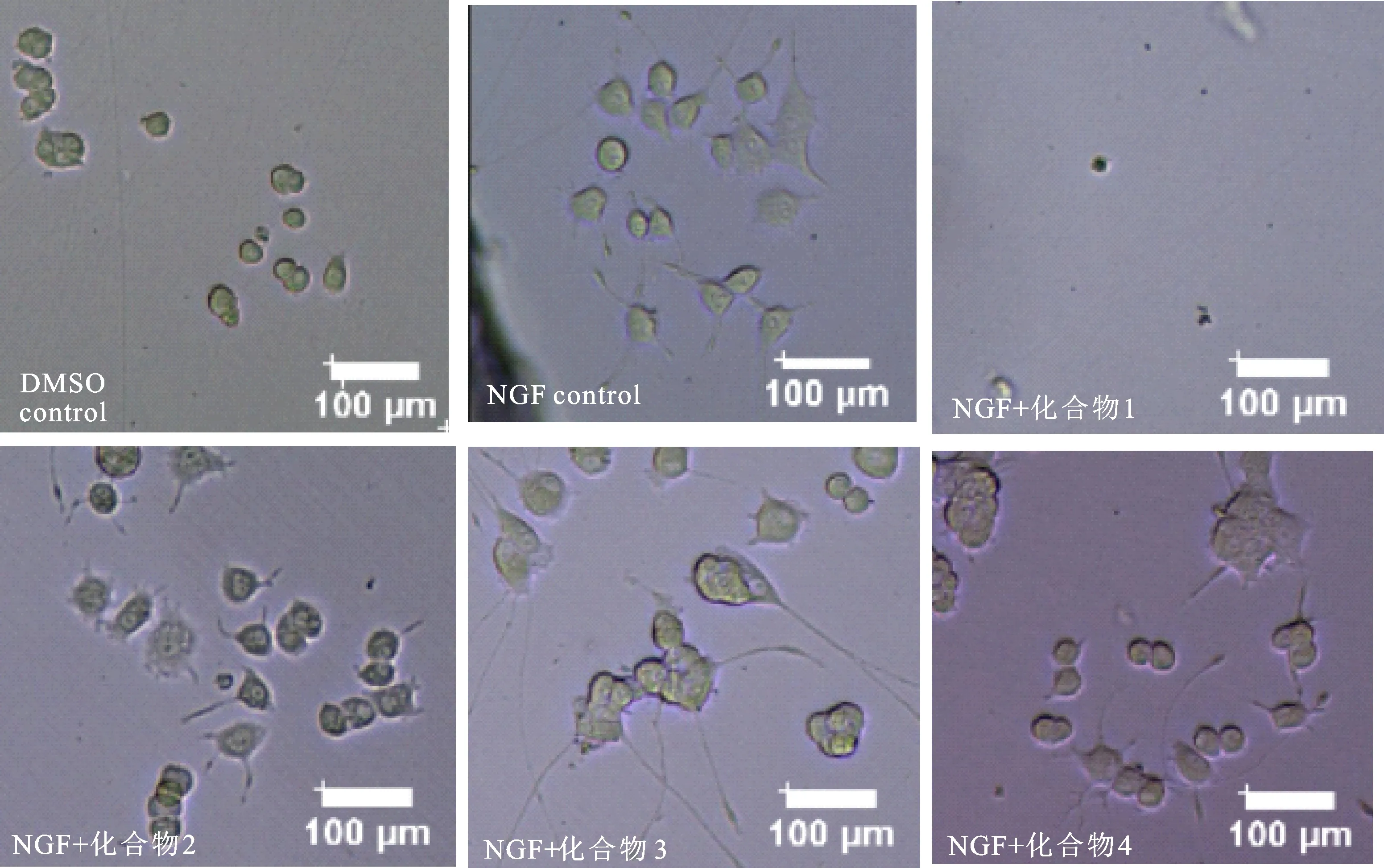
DMSO(0.1%)为阴性对照,NGF(20 ng/mL)为阳性对照
3 结 论
本研究从瑞香狼毒乙酸乙酯提取物中分离得到9个化合物,分别鉴定为Stelleralide C(1),狼毒色原酮(2),新狼毒素B(3),异新狼毒素A(4),枇杷素(5),山萘酚(6),异落叶松树脂醇(7),(-)-落叶松树脂醇(8),消旋丁香脂素(9)。化合物5、7和8为首次从该植物中分离得到。NGF诱导神经突起生长活性测定表明化合物2~4 具有抑制NGF介导的神经突起生长活性,化合物1对PC-12 细胞表现出显著的NGF介导的细胞毒 活性。
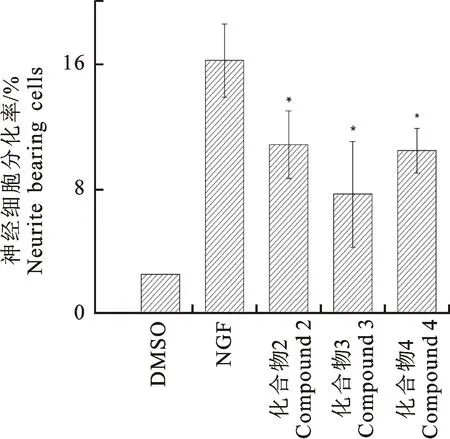
阴性对照为0.1 %的DMSO,阳性对照为20 ng/mL的 NGF。与NGF对照相比,*表示差异显著,P<0.05(单因素方差分析ANOVA)
DMSO(0.1 %DMSO) served as a negative control, NGF (20 ng/mL) served as a positive control. *P<0.05 represent significant differences compared with NGF control (ANOVA)
图3 化合物2~4(25 μmol/L)与 NGF共同作用于PC-12
细胞后对其神经突起生长的影响
Fig.3 Effects of compound 2~4(25 μmol/L) on neurite
out growth in NGF-induced PC-12 cells
4 讨 论
本研究从瑞香狼毒中分离出二萜原酸酯、黄酮类和木脂素类化合物,并进行神经突起生长活性测试。根据PC-12的MTT细胞毒活性试验发现,化合物2、3、4均促进了PC12细胞的活力,而根据神经保护试验发现,化合物2、3、4作用下的的PC12细胞神经突触均比NGF对照要长,经查阅文献,未发现有关现象的报道。
