猪ARID5B基因多态性及其与脂肪沉积性状的相关性分析
2020-06-03吴绿草董世雄段梦琪刘思源严飞飞强巴央宗
吴绿草 董世雄 段梦琪 刘思源 陈 莹 张 健 严飞飞 强巴央宗 商 鹏
(西藏农牧学院 动物科学学院,西藏 林芝 860000)
随着人民生活水平的提高,对猪肉品质要求日益提升。近年来,广大育种工作者主要围绕提高生长速度和瘦肉率等方面进行高强度选择,却带来了肉品质下降的弊端。因此,在不降低生产速度的前提下,提高肉品质是当今育种工作者重点关注的热点。脂肪沉积性状是影响猪肉品质的最关键因素,而猪肉的嫩度、风味、多汁性等主要与肌内脂肪(Intramuscular fat,IMF)含量相关[1-2]。目前已鉴定出的与猪脂肪沉积相关的基因包括:过氧化物酶增殖物激活受体G(Peroxisome proliferator-activated receptor gamma,PPARG)、脂肪酸结合蛋白(Fatty acid binding proteins,FABP)、肥胖相关基因(Fat mass and obesity associated gene,FTO)、脂肪酸合成酶(Fatty acid synthase,FASN)、脂肪细胞决定和分化因子1(Adipocyte determination and differentiation factor-1,ADD1)以及瘦素(Leptin,LP)等[3-9];在MicroRNA(miRNA)方面发现miR-27、miR-125以及miR-130家族对猪脂肪沉积发挥负调控作用[10],李美航等[11]研究发现miR-103是猪脂肪沉积的促进因子,对猪脂肪沉积起着正调控作用,并且认为PPARγ基因有助于猪原代脂肪细胞中的脂肪沉积。
富含AT的交互域5B(AT-rich interaction domain 5B,ARID5B)基因位于猪的14 号染色体上,含有7 个外显子,共编码945 个氨基酸。ARID基因家族具有高度保守性,包含15 种人类特殊蛋白质,分为7 个亚型,主要在细胞发育,组织特异性基因表达和增殖控制中具有重要作用[12]。目前,多数研究报道了ARID5B与急性淋巴细胞白血病,淋巴肿瘤发生与发展及细胞生长、分化、发育有关[13-14]。ARID5B基因也已被证实参与脂肪的形成,但关于ARID5B基因在脂肪沉积性状等方面的研究较少,大多集中在小鼠和人类肥胖症的研究上[15-16],在猪上的相关研究尚未见报道。本研究团队前期对藏猪和大白猪肌肉组织进行了转录组学(RNA-seq测序技术)和蛋白质组学(Isobaric tags for relative and absolute quantification, iTRAQ蛋白质谱技术)的联合分析,确定ARID5B为脂肪沉积性状关键差异表达基因[17],与Muoz等[18]通过转录组学鉴定伊比利亚猪背最长肌中差异表达基因的结果一致。
因此,本研究以脂肪沉积性状存在明显差异的青藏高原脂肪型猪种—藏猪和典型的瘦肉型猪种—大白猪为研究对象[19],采用混池测序后单个个体测序的方法和RT-qPCR技术分别对藏猪、大白猪ARID5B基因5′侧翼区进行单核苷酸多态性(Single nucleotide polymorphism, SNP)位点筛选和组织表达差异性分析,旨在探究ARID5B基因对猪脂肪沉积性状的初步影响,以期为开发脂肪沉积性状有效遗传标记及育种工作提供一定的思路和参考依据。
1 材料与方法
1.1 试验材料
所用的青藏高原脂肪型猪种—藏猪(TP)来源于西藏农牧学院教学实习牧场,典型的瘦肉型猪种—大白猪(LW)来源于西藏林芝市宇高农业养殖场,采用相同的日粮水平,自由采食的模式饲养。试验藏猪和大白猪各9头均为180 日龄的健康去势公猪,无亲缘关系。屠宰后,按照《瘦肉型猪胴体性状测定技术规范》(NY/T 825—2004)[20]三点法测定背膘厚;采集背脂、背最长肌、肝脏组织,液氮速冻,-80 ℃保存,用于组织表达分析;其中背最长肌1 份用于IMF含量测定,1 份用于总RNA提取。采集藏猪和大白猪69 份耳组织(藏猪33 头,大白猪36 头),置于75%酒精中,-20 ℃冰箱保存,用于基因多态性分析。
1.2 DNA和组织总RNA提取
本试验采用苯酚-氯仿法提取组织DNA;采用动物组织总RNA提取试剂盒(北京天根生化科技有限公司,DP171221)提取组织总RNA;用1%琼脂糖凝胶电泳和紫外分光光度计检测DNA和RNA的质量、浓度。
1.3 引物设计
1.3.1SNPs筛选与基因分型引物设计
下载GenBank中猪的ARID5B(登录号NC_010456.4)基因5′侧翼区DNA序列,利用Primer Premier 5.0软件设计引物(表1),用于多态性分析。由上海生工生物工程技术服务有限公司合成,用Tris和EDTA配制而成的TE缓冲液溶解,4 ℃保存。
1.3.2定量引物设计
下载GenBank中猪的ARID5B(登录号XM_003359209)mRNA序列,以HPRT(登录号NM_001032376)为内参基因,设计荧光定量引物(表2),用于组织表达分析。由上海生工生物工程技术服务有限公司合成,用Tris和EDTA配制而成的TE缓冲液溶解,4 ℃保存。
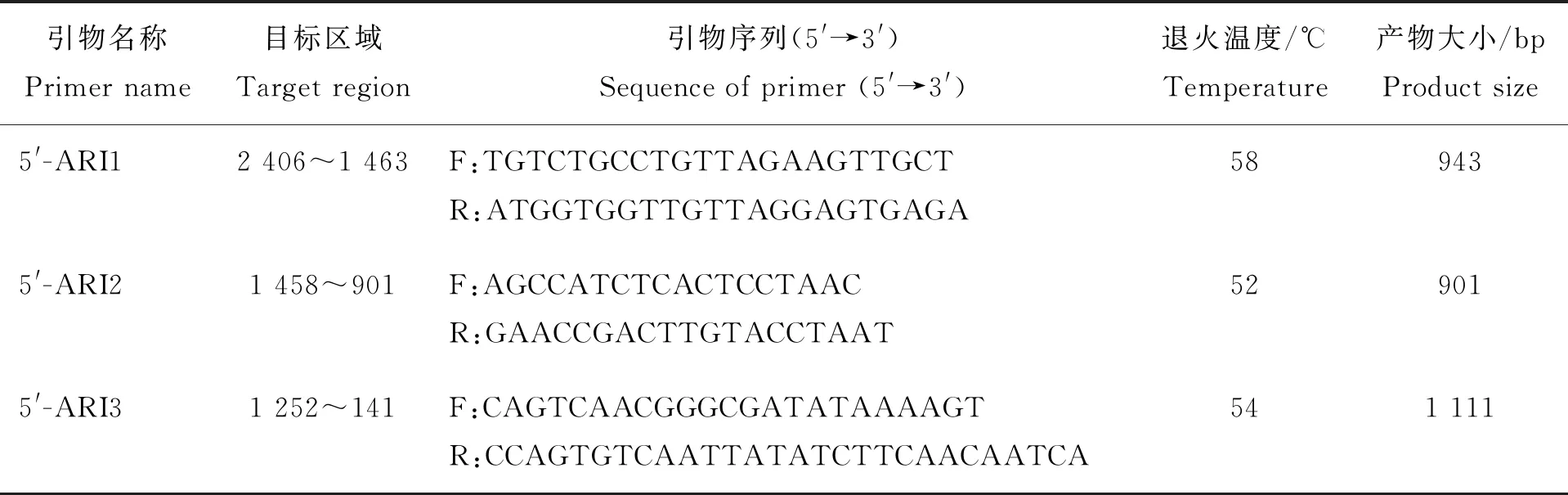
表1 ARID5B基因5′侧翼区引物Table 1 Primer sequences for amplifying the 5′-UTR of ARID5B
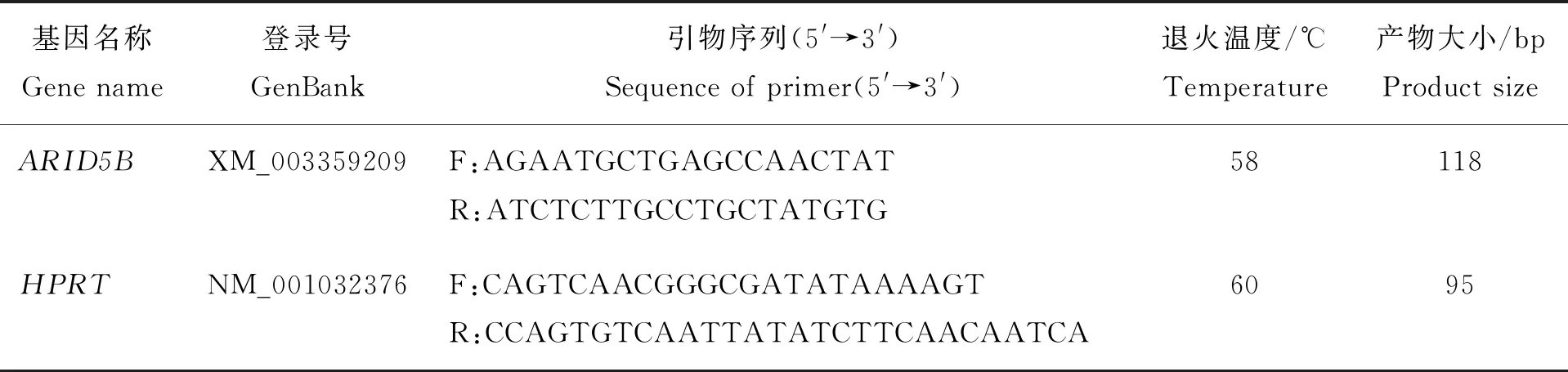
表2 ARID5B基因和HPRT基因定量引物信息Table 2 ARID5B gene and HPRT gene primers quantitative information
1.4 基因型频率与基因频率
ARID5B基因多态性分析采用混池测序,每个品种10 头,用Chromas Pro和DNAMAN 6.0软件进行序列比对分析,筛选SNPs位点后,扩大样本进行个体测序,统计基因型频率与基因频率。
1.5 反转录和荧光定量PCR
选用一步法cDNA反转录试剂盒(北京天根生化科技有限公司,KR180123)对总RNA进行反转录,将所得合格的cDNA保存于-20 ℃备用。
以cDNA为模板,对ARID5B和HPRT基因进行扩增,每个样品设置3个重复。20 μL反应体系,包括SYBR Green Mix(北京天根生化科技有限公司,FP171206)10 μL,上、下游引物(10 μmol/L)各1 μL,Ranse-free water 7 μL,cDNA模板1 μL。荧光定量PCR扩增程序为:95 ℃预变性5 min;95 ℃ 变性30 s,58 ℃退火20 s,72 ℃延伸30 s,80 ℃ 检测荧光,共38 个循环。样品mRNA的相对表达量使用2-ΔΔCt法[21]进行计算。
1.6 IMF含量测定
采用传统索氏抽提法测定IMF含量,参照《猪肌肉品质测定技术规范》(NY/T 821—2004)[22]标准执行,最后计算每个样品的IMF值。
1.7 统计分析
利用SPSS 18.0软件分别对ARID5B基因表达量进行双因素(品种和组织)分析以及背膘厚、ARID5B基因背最长肌表达量与IMF含量的相关性(Pearson相关系数)分析,使用Fisher Exact Test对ARID5B基因的基因型频率和基因频率进行显著性检验,P<0.05 时差异显著,P<0.01 时差异极显著,P>0.05 时差异不显著;测定结果以“平均值±标准误”表示。
2 结果与分析
2.1 SNPs检测
在5′侧翼区共发现2 个多态性位点(图1),其中在该基因起始密码子上游2 216 bp位置发现 T/C 突变,记为T-2 216 C(图1(a));在起始密码子上游第2 029~2 036 bp的8 个碱基(ATTTATTT)的插入/缺失突变,记为In-2 029 Del(图1(b))。在藏猪(TP) 33 个个体,大白猪(LW)36 个个体中,当T-2 216 C位点为T碱基时,在In-2 029 Del位点存在ATTTATTT;C碱基出现时,在In-2 029 Del位点就存在ATTTATTT的缺失。这2 个突变位点紧密连锁,其中-2 216 T与-2 029 In连锁,-2 216 C与-2 029 Del连锁。因此,检测T-2 216 C的基因型,即可获悉In-2 029 Del的基因型。
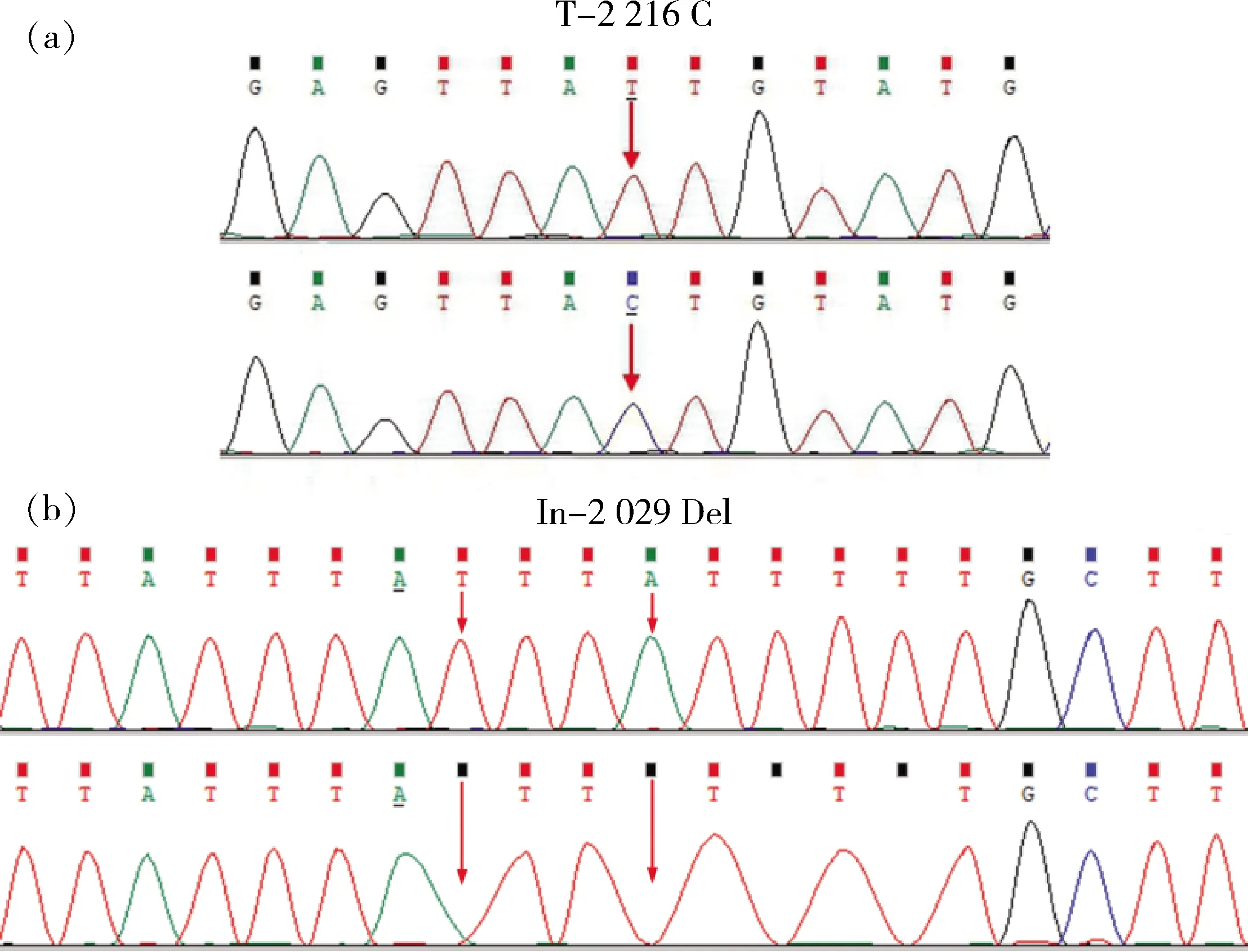
(a) T-2 216C位点T-2 216 C sites; (b) In-2 029 Del位点In-2 029 Del sites
图1ARID5B基因突变位点测序峰图
Fig.1 Sequencing peak ofARID5Bgene mutation sites
2.2 ARID5B基因型频率和等位基因频率分布
由表3可知,T-2 216 C位点的基因型分布在藏猪和大白猪内均符合Hardy-Weinberg平衡(P≥0.05);在品种间,T-2 216 C位点的基因型频率呈极显著差异(P<0.01),藏猪群体中的优势基因型为CC型,大白猪群体中的优势基因型为TT型。
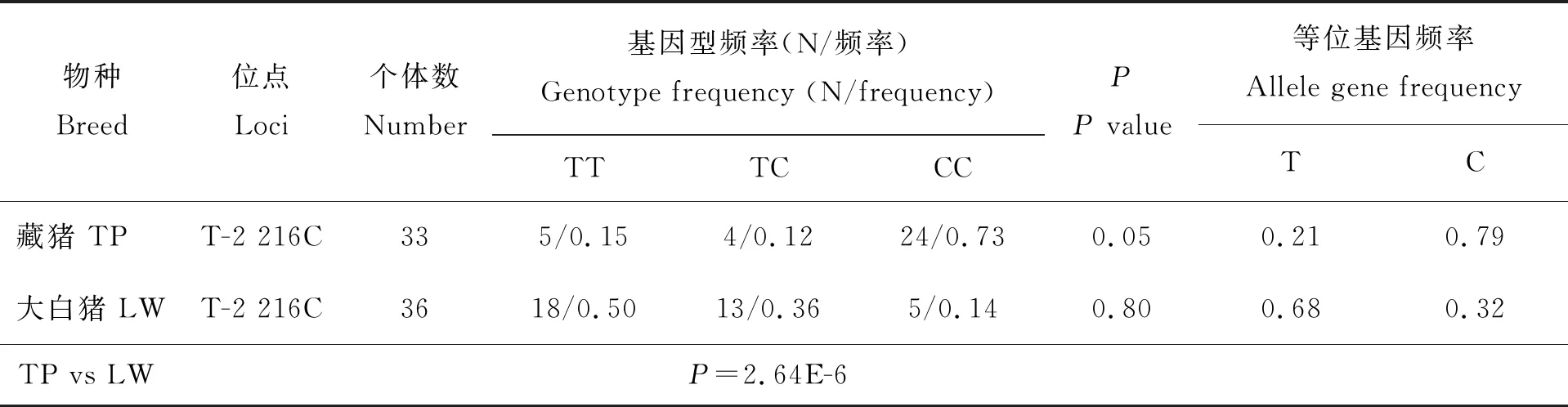
表3 ARID5B基因多态性位点基因型频率和等位基因频率Table 3 ARID5B gene polymorphism loci genotype frequency and gene frequency
2.3 不同组织ARID5B基因相对表达量变化
ARID5B基因在藏猪和大白猪的背脂、背最长肌、肝脏组织的mRNA相对表达量结果见图2。在相同品种的不同组织中,背最长肌表达量最高,其次是背脂,肝脏则最低;在相同组织的不同品种中,藏猪(TP)ARID5B基因表达量均极显著低于大白猪(LW)的表达量(P<0.01),表达趋势完全一致。
2.4 不同品种猪背膘测定
由表4可知,180 日龄藏猪、大白猪平均体重分别为39.02 和81.54 kg,藏猪体重极显著低于大白猪(P<0.01);藏猪、大白猪的平均背膘厚度分别为21.27和15.50 mm,藏猪背膘厚极显著高于大白猪(P<0.01)。
2.5 不同品种猪IMF含量测定
由表5可知,180 日龄藏猪、大白猪背最长肌IMF含量分别为4.11%和2.28%,藏猪IMF含量极显著高于大白猪(P<0.01)。
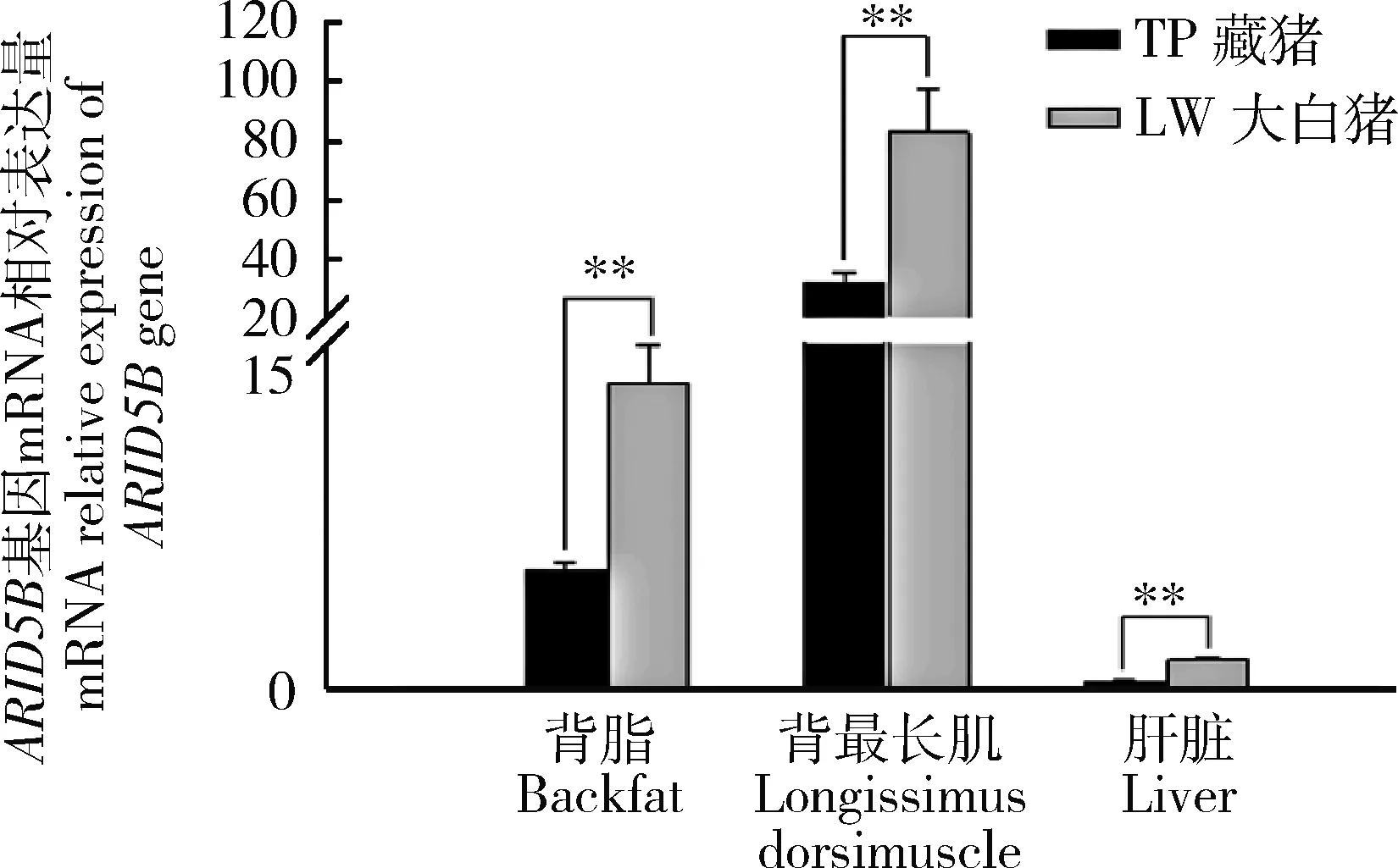
注:*为显著差异P<0.05,** 为极显著差异P<0.01 Note: * Significant differenceP<0.05, ** Extremely significant differenceP<0.01
图2ARID5B基因在TP和LW两个品种猪背脂、 背最长肌和肝脏中mRNA的相对表达量
Fig.2 Relative expression ofARID5Bgene in backfat, longissimus dorsi muscle and liver of TP And LW pigs
表4 180 日龄藏猪、大白猪背膘测定
Table 4 Backfat measurement of Tibetan pig and Large White pig at 180 days of age
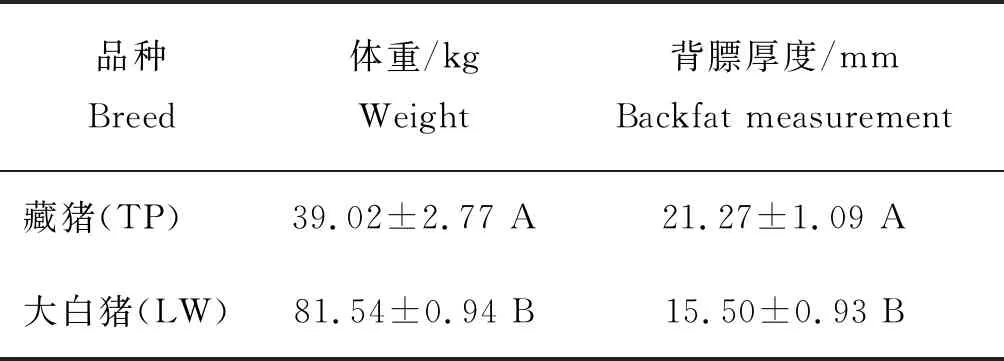
品种Breed体重/kgWeight背膘厚度/mmBackfat measurement藏猪(TP)39.02±2.77 A21.27±1.09 A大白猪(LW)81.54±0.94 B15.50±0.93 B
注:同列数据肩标大写字母不同表示差异极显著(P<0.01)。下同。
Note: The different capital letters in the same column indicate extremely significant differences between breeds (P<0.01). The same below.

表5 180 日龄藏猪和大白猪背最长肌IMF含量测定Table 5 Determination of IMF in the dorsal longest muscle of Tibetan pig and Large White pig at 180 days of age
2.6 ARID5B基因表达量与背膘厚和IMF含量相关性分析
由表6可知,ARID5B基因在背最长肌中的mRNA相对表达量与背膘厚呈显著负相关,相关系数为-0.87,差异显著(P<0.05),与IMF含量呈显著负相关,相关系数为-0.87,差异显著(P<0.05)。
3 讨 论
脂肪是机体重要的组成部分和贮能物质,可以调节机体的能量平衡,动物脂肪的分化与发育是一个复杂的过程,受多基因调控[23]。ARID5B基因表达的蛋白质参与脂肪的生成、肝脏发育的靶基因的转录以及RNA聚合酶II启动子转录的负调控[24-26]。Dong等[24]研究报道,ARID5B基因对C/EBPα与PPARγ表达具有调节作用,影响脂肪的生成,结合Claussnitzer[27]和人类CNV(Copy number variation)肥胖症的研究,发现ARID5B基因在脂肪细胞产热调节途径中具有抗肥胖作用[16,28]。推测ARID5B基因在脂肪沉积过程中发挥

表6 ARID5B基因表达量与背膘厚和IMF含量相关性分析Table 6 Analysis of correlation between ARID5B gene expression and backfat thickness and IMF content
注:r,表示相关系数;P<0.05为相关性显著,P<0.01为相关性极显著
Note:rindicates correlation coefficient;P<0.05 indicates significant correlation,P<0.01 indicates extremely significant correlation.
负调控作用。本研究发现,藏猪ARID5B基因在背脂、背最长肌和肝脏组织中的mRNA相对表达量极显著低于大白猪(P<0.01)。藏猪具有IMF含量高,肉品质好,脂肪沉积能力强的特点;大白猪具有高瘦肉率,快生长速度,低脂肪沉积能力的特性,这可能是导致藏猪表达量低于大白猪的主要因素之一。通过对ARID5B基因表达量与背膘厚和IMF含量的检测发现,背膘厚和IMF含量与ARID5B基因mRNA的相对表达量显著负相关(P<0.05),进一步证实了ARID5B基因可能在脂肪沉积过程中发挥负调控作用。ARID5B基因mRNA的相对表达量在背最长肌中最高,其次是背脂,肝脏中最低,推测主要是由于在猪的生长发育过程中,2~6 月龄是肌肉快速生长的阶段,6~12 月龄是脂肪的发育高峰期[29],本试验采用6 月龄猪为研究对象,处于脂肪组织发育的起始阶段,肌肉发育的终止阶段,试验结果符合机体发育规律。
本研究在ARID5B基因5′侧翼区发现了2 个新的SNPs(T-2 216 C和In-2 029 Del)位点,且为连锁突变(即T-2 216 C位点C碱基出现时,In-2 029 Del就存在ATTTATTT缺失),这2 个突变位点的等位基因频率和基因型频率在藏猪与大白猪存在极显著差异(P<0.01)。梁爽等[30]发现连锁突变与其抗原表型特征呈现明显的一致性规律,提出了与表型呈现规律性的SNPs可作为有效分子标记,相对于单碱基突变更为有效。另外,ARID5B基因参与RNA聚合酶II启动子转录的负调控[25],因此,T-2 216 C 位点的C等位基因可能通过抑制ARID5B基因表达,从而增强猪脂肪沉积与IMF含量。
本研究在样本含量具有统计学意义的情况下,结合前人的研究从DNA和mRNA水平对ARID5B在脂肪沉积中的作用进行了初步探究。本研究表明,ARID5B基因在藏猪和大白猪5′侧翼区存在2 个连锁突变位点,并且ARID5B基因在背最长肌中的相对表达量与猪的背膘厚以及IMF含量呈显著负相关,推测ARID5B基因可能在猪脂肪沉积中发挥负调控作用,但具体调控机制和功能尚需进一步研究。下一步将开展不同基因型个体和脂肪沉积性状的关联性分析。
4 结 论
本试验通过对ARID5B基因5′侧翼区多态性及其组织表达含量与背膘厚、IMF含量关联分析,发现ARID5B基因mRNA的相对表达量与背膘厚、IMF含量呈显著负相关,ARID5B基因可能是改善脂肪沉积性状及肉品质的重要候选基因,发现的SNPs位点可能是猪脂肪沉积性状的重要分子标记,为进一步探索猪脂肪沉积调控机制和分子辅助育种提供一定的思路和科学依据。
