设施生菜种植与T1菌肥处理对土壤微生物群落的影响
2020-06-03易欣欣石延霞钟连全徐全明胡灿丽高秀芝
高 逸 杨 悦 易欣欣 石延霞 钟连全 徐全明 胡灿丽 高秀芝*
(1.北京农学院 食品质量安全北京实验室/农产品有害微生物及农残安全检测与控制北京市重点实验室/ 微生态制剂关键技术开发北京市工程实验室/食品科学与工程学院,北京 102206;2.中国农业科学院 蔬菜花卉研究所,北京 100081;3.北京市昌平区种子管理站,102200)
生菜又名叶用莴苣(LactucasativaL.),原产于欧洲,最早自东南沿海地区传入我国[1]。随着消费者对鲜食生菜需求量增多,生菜的种植量增大,2015年叶类蔬菜总产量占蔬菜总产量的39.5%[2]。为了增加生菜产量,过度使用化肥,造成土壤氮源过剩、肥力下降以及菌群失衡的后果[3]。
为解决化学肥料过度使用对土壤造成的危害,微生物菌肥的研发成为研究热点[4]。陈璐璐等[5]研究表明芽孢杆菌对玉米纹枯病与番茄灰霉病等具有较好的抑制效果;吴越等[6]研究发现枯草芽孢杆菌HAINUP40能分泌大分子蛋白质的抑菌活性物质。实际应用中地衣芽孢杆菌与枯草芽孢杆菌均可以作为生物有机肥产品中主要功能菌[7]。
上述研究表明芽孢杆菌(Bacillus)对大部分农作物具有促生效果,但是其对于生菜的促生效果和土壤的微生物结构变化及生菜的种植对土壤菌群的影响尚未见报道。因此,本研究拟以地衣芽孢杆菌与枯草芽孢杆菌混合菌肥T1作为研究对象,设置种植生菜与不种植生菜不同处理,采用高通量技术对土壤微生物菌群变化进行分析,探究种植生菜对土壤菌群的影响以及T1在设施生菜种植过程中促生防病效果及其对土壤菌群结构的影响。
1 材料与方法
1.1 设施地点与生菜种植方案
生菜种植设施的地点位于北京市昌平区农作物品种试验展示基地,设施长50 m,宽8 m,设施土壤类型为沙壤土[8]。设施中每畦长6.5 m,宽1.2 m,生菜种植的密度为 80株/畦,株距0.3 m×0.3 m。种植生菜前施用有机肥16 kg/hm2,试验土壤基本理化指标:土壤碱解氮 142.91 mg/kg,土壤速效磷261 mg/kg,土壤速效钾302.15 mg/kg,pH 6.9。试验种植菜种为‘北生一号’(结球)。本次试验分为2组处理,空白对照处理组包括空白不种菜(CKW)、空白种菜(CKY);T1处理组包括菌肥不种菜(T1W)、菌肥种菜(T1Y)。共种植生菜12 畦,1~4 畦依次为空白不种菜(CKW)、空白种菜(CKY)、菌肥不种菜(T1W)、菌肥种菜(T1Y),5~8与9~12 畦重复2 次。试验于2018年7月18日播种,8月27日定植,收获日期为10月17日。
1.2 记录病株与土壤采集
根据卢蝶等[9]调查方法进行修改,对设施内栽培的生菜进行病害的持续调查记录:对患有链格孢属等真菌引起叶斑类病害植株记录,3 次重复,计算平均生菜病株率。计算公式:
生菜病株率/%=(病株率植株总数/80)×100
试验土壤样品组别为(2018年10月17日采样):空白对照处理包括空白不种菜(CKW)、空白种菜(CKY),T1处理包括菌肥不种菜(T1W)、菌肥种菜(T1Y)。使用五点取样法对每一畦采集生菜根系附近土壤,每个组别取3 个平行。样品采集后装入采样袋,编号标记,放入保温箱中带回试验室,置于 -40 ℃ 冰箱储藏备用[10]。
1.3 生菜浇肥方案
生菜浇水采用滴灌处理,定植后每20 d,在对生菜浇水的过程中向菌肥处理畦的水管中加入菌肥,每次施加菌肥500 mL,25 min滴灌结束后用清水冲洗浇水管5 min。菌肥登记证号:微生物肥(2019)准字(7096)号,其中有效菌种为土壤中分离出具有促生防病功能的地衣芽孢杆菌与枯草芽孢杆菌,有效活菌数浓度不低于 8.7 lg (CFU/mL)。
1.4 土壤微生物基因组DNA的提取与PCR扩增
土壤微生物DNA提取与扩增模板参考李存玉等[11]、赵辉等[12]的方法,使用338F-806R与ITS1F-ITS2引物模板。扩增后引物采用Illumina MiSeq PE300测序进行双向分析,委托上海美吉生物医药科技有限公司完成。
1.5 生菜样品产量测定
根据刘庆新等测定生菜产量方法做出修改[13],每畦随机采收9株成熟的生菜,测定生菜重量,重复3次。
1.6 数据分析
使用Excel 2007整理各项结果与作图,采用SPSS 16.0进行差异性分析的比较(P<0.05),利用R语言绘制维恩图。
2 结果与分析
2.1 土壤样品中微生物多样性指数分析
所有样品中的真菌与细菌多样性指数如表1所示:CKY与T1Y的真菌、细菌Shannon指数分别高于CKW与T1W,说明种植生菜可提高土壤中微生物多样性;经过T1处理土壤的Shannon指数介于CKY与CKW之间且无显著差异,说明T1处理可以一定程度降低的微生物多样性,但是与对照组无显著差异;4 个处理土壤样品中真菌与细菌的Sobs指数均无显著差异,说明种菜以及T1处理对土壤菌群微生物类群总数无明显影响。
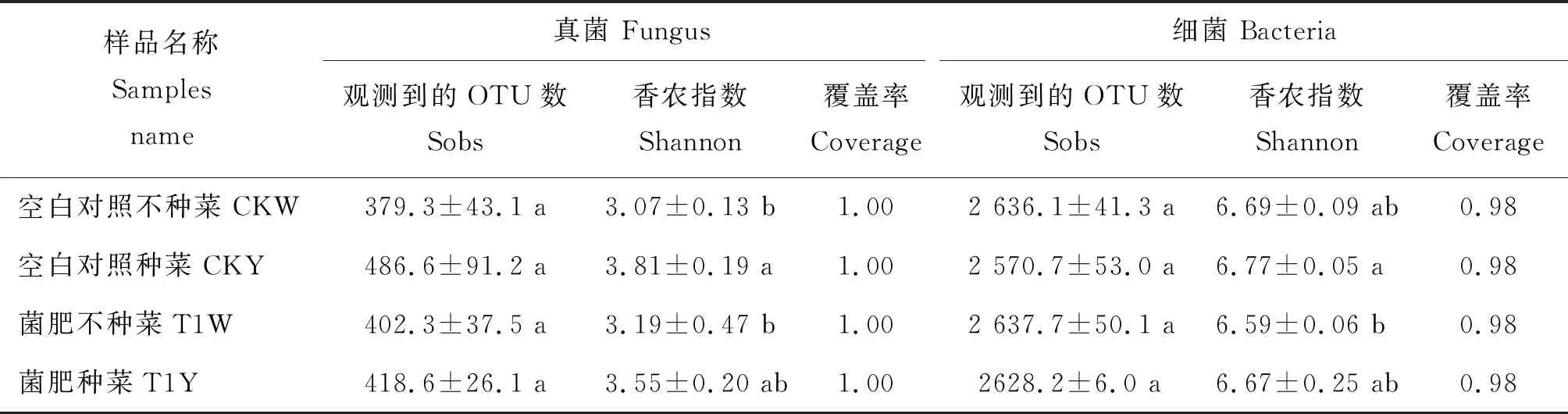
表1 各处理土壤样品中微生物多样性指数Table 1 Microbial diversity indexes in the soil samples of different treatments
注:表中同一列不同字母表示差异显著(P<0.05)。
Note: Different letters in the same column indicate significant differences (P<0.05).
2.2 真菌群落组成分析
土壤样品检测到真菌种类有7个门、23个纲、28个目、136个科,共计265个属。除未知菌外,其余菌门依次为子囊菌门(Ascomycota)、接合菌门(Zygomycota)、担子菌门(Basidiomycota)、壶菌门(Chytridiomycota)。
土壤样品中各真菌门的丰度如表2所示:在空白对照处理中子囊菌门丰度维持在85.9%左右,CKY接合菌门丰度为7.5%,CKW为9.5%,说明种菜后子囊菌门丰度无明显变化,降低了接合菌门丰度;在T1Y土壤中子囊菌门丰度为79.5%,T1W为82.6%,T1Y接合菌门丰度为8.5%,T1W为11.0%,说明T1处理可以降低土壤中子囊菌门与接合菌门丰度。
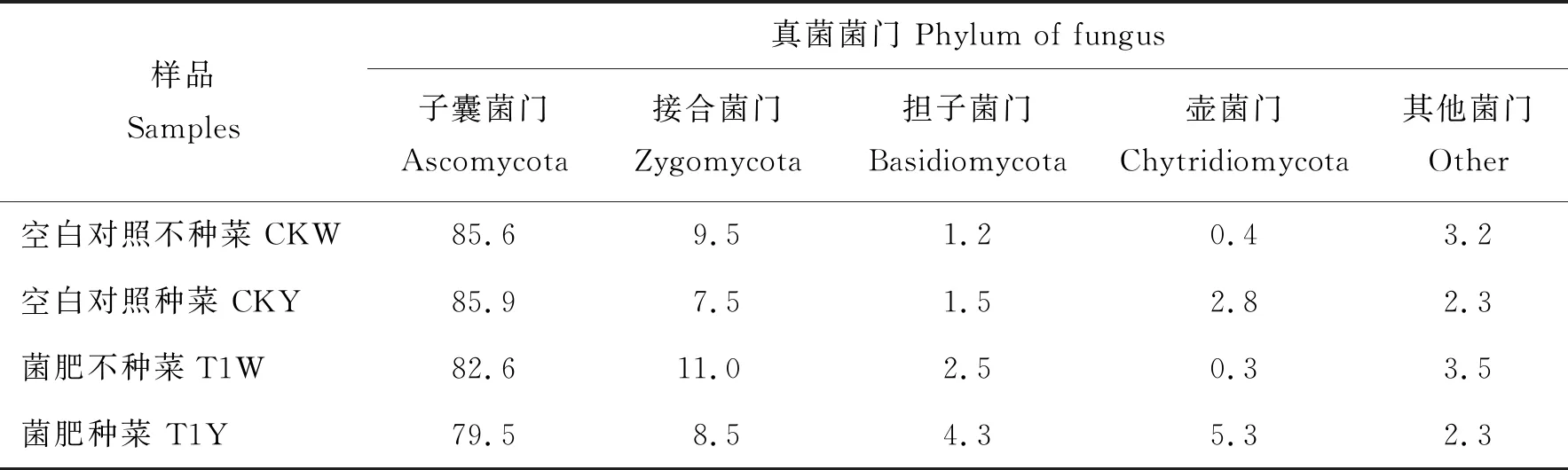
表2 各处理土壤样品中不同真菌菌门丰度Table 2 Abundance of different phylum of fungu in the soil samples under different treatments %
在属分类水平上土壤样品中真菌群落结构如图1所示:CKW土壤中假霉样真菌属(Pseudallescheria)丰度为23.9%,CKY为11.5%,T1W为18.7%,T1Y为10.8%,表明种菜降低了土壤中假霉样真菌属丰度,T1处理进一步降低了假霉样真菌属丰度;CKW土壤中毛壳菌属(Chaetomium)丰度为8.5%,CKY为7.6%,而T1Y中丰度为11.2%,T1W为9.7%,表明种菜降低了土壤中毛壳菌属丰度,而T1处理提高了土壤中毛壳菌属丰度;CKW土壤中火丝菌科(Pyronemataceae)中未分类属丰度为13.2%,CKY为3.6%,在T1W中丰度为11.6%,T1Y为8.0%,说明种菜可以明显降低土壤中其丰度,而T1处理可以改善种菜带来的不良影响;CKW土壤中粪壳菌目中未分类属丰度为1.5%,CKY为4.5%,在T1Y中为7.1%,T1W为12.5%,说明种菜可以提高土壤中粪壳菌目中未分类属丰度,T1处理进一步提高了土壤中粪壳菌目丰度;CKW土壤与T1W土壤中烟草镰刀菌属(Monographella)丰度<0.1%,但是在CKY中丰度为7.2%,T1Y中为2%,说明种菜可以提高土壤中烟草镰刀菌属丰度,而T1处理降低烟草镰刀菌属丰度;CKW土壤与CKY土壤中支顶孢菌属(Acremouium)丰度<1%(约为0.8),在T1W中为4.0%,T1Y中为1.6%,说明T1处理提高了土壤中支顶孢菌属丰度;在CKY土壤中丝孢菌属(Sedosporium)与赤霉菌属(Gibberella)分别为5.0%与1.5%,CKW、T1Y和T1W中丰度均<0.1%,说明T1处理能有效降低土壤中丝孢菌属与赤霉菌属的丰度。

图1 各土壤样品在属分类水平上真菌群落结构
Fig.1 Fungal community structure of each soil sample at the genus classification level
2.3 细菌群落组成分析
土壤样品检测到细菌种类有34 个门、78 个纲、189 个目、378 个科、共计749 个属。土壤样品细菌门水平丰度如表3所示:CKW土壤中变形菌门丰度为28.1%,CKY为30.5%,T1W中为30.1%,T1Y为32.4%,说明种菜提高土壤中变形菌门的丰度,而T1处理可以进一步提高变形菌门丰度;CKW土壤中厚壁菌门丰度为12.8%,CKY为10.1%,T1W中为13.4%,T1Y为13.0%,说明种菜降低了厚壁菌门在土壤中的丰度,而T1处理提高了土壤中厚壁菌门丰度;CKW土壤中绿弯菌门的丰度为14.9%,CKY为13.5%,T1W中丰度为13.9%,T1Y为12.1%,CKW土壤酸杆菌门丰度为13.6%,CKY为8.7%,T1W为10.3%,T1Y为8.0%,说明种菜降低了土壤中绿弯菌门与醋杆菌门的丰度,而T1处理进一步降低了土壤中绿弯菌门与醋杆菌门的丰度。
在属分类水平上土壤样品中细菌群落结构如图2 所示:CKW土壤中酸杆菌(Acidobacteria)中未分类属丰度为9.7%,CKY为5.6%,T1W中丰度为6.8%,T1Y为4.4%,说明种菜降低土壤中酸杆菌丰度,T1处理进一步降低了其丰度;CKW土壤中芽孢杆菌属(Bacillus)丰度为4.7%,CKY为3.3%,T1W中丰度为5.0%,T1Y为4.6%,说明种菜降低了芽孢杆菌属丰度,T1处理提高了土壤中芽孢杆菌属丰度;CKW土壤中硝化螺菌属(Nitrospira)丰度为2.4%,CKY为1.3%,T1W为1.8%,T1Y为1.5%,说明种菜降低了土壤中硝化螺菌属丰度,T1处理可以改善种菜带来的负面影响;CKW土壤中鞘氨醇单胞菌属(Sphingomonas)丰度为2.7%,CKY为2.4%,T1W为3.5%,T1Y为3.3%,说明种菜降低了土壤中鞘氨醇单胞菌属丰度,而T1处理能提高土壤中鞘氨醇单胞菌属丰度。

表3 各处理土壤样品中不同细菌菌门占比Table 3 Proportion of different phylum of bacteria in the soil samples with different treatments %
2.4 OTU聚类分析
对所有土壤样品进行OTU分析得到图3,可以看出:细菌、真菌共有OTU比例分别为71.50%与30.60%;CKY与CKW土壤中细菌、真菌共有OTU占比为82.1%与48.0%;T1Y与T1W为83.1%与52.0%;CKY与T1Y为85.5%与54.2%;CKW与T1W为87.1%与55.5%。以上结果表明4 个处理的土壤中真菌群落结构差异较大,细菌差异较小。
细菌与真菌特有OTU数量分析得出:CKY样品中细菌、真菌特有OTU占总OTU为1.2%与18.4%,CKW为1.6%与5.0%,T1Y为0.9%与4.5%,T1W为0.7%与8.6%,说明4 个土壤样品的细菌群落结构无明显变化,而T1处理明显改变了土壤的真菌群落结构。
2.5 LEfSe多级物种差异分析
组间样品真菌菌群差异性分析结果显示T1Y的土壤富集了17 个真菌种属,分别为假霉样真菌(Pseudallescheria)、毛壳菌属(Chaetomium)、被孢霉科(Mortierellaceae)中未分类属、小包脚菇属(Volvariella)、丝壳属(Kernia)、裸囊菌属(Gymnoascus)、Arachnomyces、Stephanonectria、Cystolepiota、粪盘菌科(Ascobolaceae)中未分类属、沃德霉属(Wardomyces)、Spizellomycetaceae中未分类属、Onygenaceae中未分类属、Gymnoascaceae中未分类属、Remersonia、毛球壳属(Zygopleurage)、小囊菌属(Microascus)。

图2 各土壤样品在属分类水平上细菌群落结构
Fig.2 Bacterial community structure of each soil sample at the genus classification level
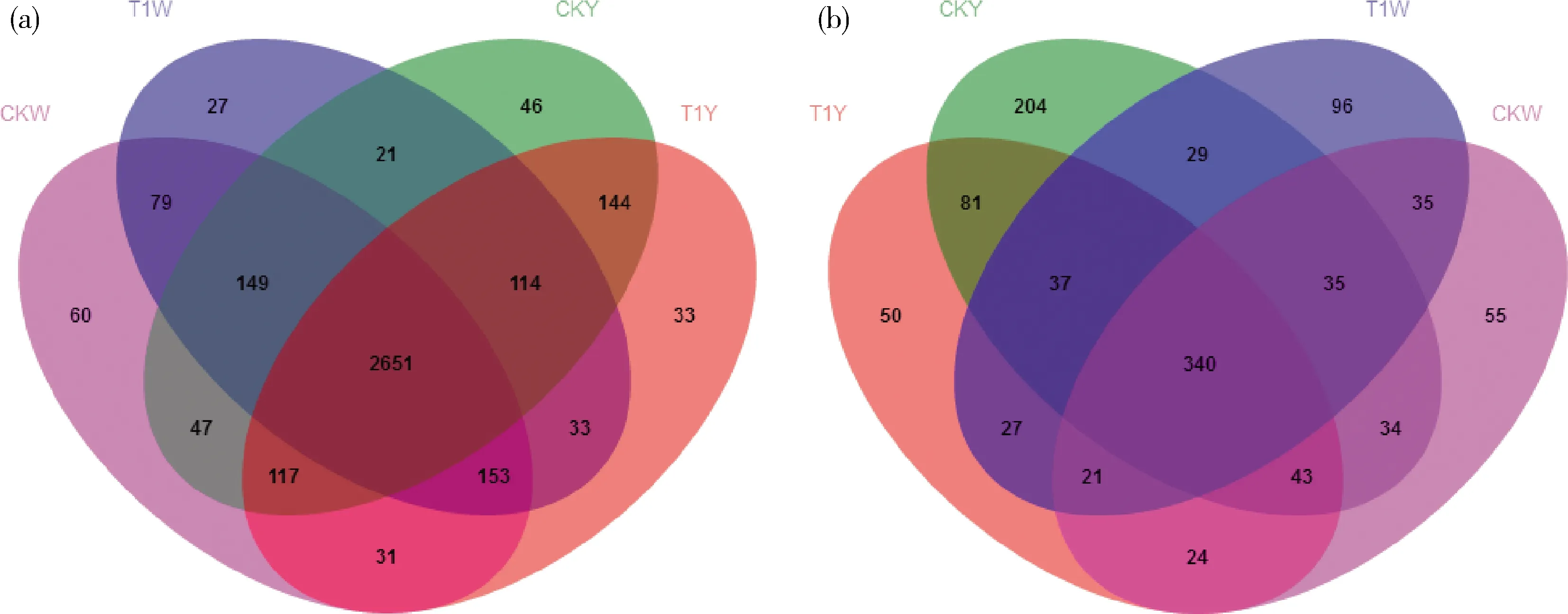
(a)细菌韦恩图;(b) 真菌韦恩图。图中数字代表其区域中OTU数目。 (a) Bacteria Venn diagram; (b) Fungus Venn diagram. The number in the figure represents the number of OTUs in its area.
图3 土壤样品中微生物多样性的相关性分析韦恩图
Fig.3 Venn diagram showing the shared eukaryotes OTUs
CKY的土壤富集了10 个真菌种属,分别为明梭孢属(Monographella)、赤霉属(Gibberella)、小羊蹄菌属(Microdochium)、Plectosphaerellaceae中未分类属、Helotiales中未分类属、Eurotiales中未分类属、棒孢属(Corynespora)、黄丝曲霉属(Talaromyces)、木霉属(Trichoderma)、Hannaella。
组间样品细菌菌群差异性分析结果显示T1Y处理的土壤富集了17 个细菌种属,分别为芽孢菌属(Bacillus)、H16、OM1_clade中未分类属、农杆菌(Planifilum)、ABS_19、微枝形杆菌属(Microvirga)、Bryobacter、Rhodobiaceae中未分类属、AKYG1722中未分类属、Ardenticatenales中未分类属、木洞菌属(Woodsholea)、Bacilli中未分类属、Xanthomonadales中未分类属、Planococcaceae中未分类属、Pontibacter、Haliangium、太平洋海洋杆菌属(Oceanobacillus)、Halobacteroidaceae中未分类属、Sphingomonadaceae中未分类属。
CKY处理的土壤富集了细菌15 个属,分别为微球菌科(Micrococcaceae)中未分类属、节杆菌属(Arthrobacter)、蓝细菌(Cyanobacteria)中未分类属、Gitt_GS_136中未分类属、JG30_KF_AS9中未分类属、鞘脂菌属(Sphingobium)、气微菌属(Aeromicrobium)、Paenarthrobacter、微杆菌科(Microbacteriaceae)中未分类属、Kribbella、慢生根瘤菌(Bradyrhizobium)、Blastocatellacea中未分类属、TK10中未分类属、KCM_B_15中未分类属、副球菌(Rhizomicrobium)。
2.6 生菜产量及生菜病株率
生菜产量与病株率如表4所示,T1Y相比CKY产量提高了11%,病株率下降了2.5%。

表4 生菜产量与病株率Table 4 Lettuce yield and morbidity
注:表中同一列不同字母表示差异显著(P<0.05)。
Note: Different letters in the same column in the Table indicate significant differences (P<0.05).
3 讨论与结论
作物种植过程中施用菌肥可以改变土壤微生物多样性,计思贵[14]发现施用枯草芽孢杆菌菌肥可以提高烟草根际土壤细菌群落多样性;Wang等[15]发现对苹果树施加菌肥可以提高苹果根部土壤细菌丰度,富集红螺菌、变形菌等。也有文献报道通过用解淀粉芽孢杆菌菌剂FH-1处理水稻,降低了水稻根部土壤的微生物α多样性[16]。
本次试验中,CKY相比CKW,Shannon指数显著提高,说明种菜可以提高土壤微生物多样性。而施加菌肥后,T1Y相比CKY的Shannon指数平均值上存在一定减小,但是无显著差异,且4 个处理土壤样品的Sobs指数无显著差异,分析可能由于本次试验采用结球生菜生长周期短,菌肥对土壤作用时间短,导致土壤微生物结构改变不明显。
本次试验中,共检测到真菌7 个门,T1处理降低了子囊菌门(Ascomycota)与接合菌门(Zygonmycota)丰度,其中寄生型子囊菌门可引起植物病害[17],接合菌门中毛霉目与植物病害直接相关[18]。土壤样品共检测到真菌265 个属,T1Y样品优势菌属(丰度占比>2%)有假霉样真菌属(Pseudallescheria)、毛壳菌属(Chaetomium)、毛壳科(Chaetomiaceae)中未分类属、火丝菌科(Pyronemataceae)中未分类属等13 种,这与王超的研究结果基本一致[19]。
T1处理相比空白对照处理降低了假霉样真菌属、烟草镰刀菌属、丝孢菌属与赤霉菌属在土壤中丰度。其中假霉样真菌属直接接触人体可能导致人体感染[20]。烟草镰刀菌属、丝孢菌属与赤霉菌属是植物的致病菌,可导致生菜霉腐病与根腐病[21]。
T1处理相比空白对照处理增加了毛壳菌属、支顶孢菌属、粪壳菌目(Sordariales)中未分类属与火丝菌科中未分类属在土壤中丰度。其中毛壳菌属丰度的增加,能够促进生菜吸收土壤中氮磷元素,加速生菜生长[22];火丝菌科部分种类与高等植物共生形成菌根,部分具有分解木质纤维素的能力[23];粪壳菌目具有降解腐烂有机质及纤维素的作用[24],有助于提高土壤肥力,进而促进生菜生长;支顶孢菌属细菌经常用于生物防治,能降低生菜发病几率[25]。
土壤样品共检测到细菌34 个门,种菜提高土壤中变形菌门(Proteobacteria)的丰度,而T1处理可以进一步提高变形菌门丰度,变形菌门具有多种生理和代谢途径,利于氮、磷、钾元素的循环[26],提高土壤肥力,利于植物生长;T1处理提高土壤中厚壁菌门(Firmicutes)丰度,厚壁菌门可以降解土壤中难溶化合物、降解原油,固定空气中氮、防治植物病虫害[27]。
土壤样品共检测到细菌749 个属,其中T1Y的优势菌属是醋杆菌属(Acidobacteria)、芽孢杆菌属、鞘氨醇单胞菌属(Sphingomonas)、节杆菌属、JG30-KF-CM45中未分类属、OM1_clade中未分类属、微球菌科(Micrococcaceae)中未分类属,与Shen等[28]人研究结果相符。
T1处理不同程度地提高了芽孢杆菌、硝化螺菌与鞘氨醇单胞菌在土壤中丰度。芽孢杆菌作为植物根际促生细菌(PGPR)具有改善土壤肥力、抑制土传病原物、提高抗病能力、促进植物生长、增加作物产量的作用[29];硝化细菌通过硝化作用为作物生长提供氮素营养[30];鞘氨醇单胞菌属可以降解由杀虫剂农药产生的芳香族污染物,并合成具有抗菌效果的胞外生物高聚物[31]。
LEfSe分析显示:T1Y相比CKY富集了真菌、细菌各17 个种属,可以看出,T1处理对土壤真菌菌群结构有更明显的影响,与OTU分析相符。T1Y样品土壤中富集芽孢菌属、毛壳菌属、鞘脂单胞菌科中未分类属、拟盐杆菌科中未分类属,它们可以通过以下途径促进作物生长:(1)分泌抑菌物质,抑制病害微生物生长,间接促进作物生长[32];(2)降解芳香化合物并产生GA、IAA促进作物生长[33];(3)提高植物防御酶活性,增加生物和非生物胁迫耐受[34]。丝孢菌属、赤霉菌属、烟草镰刀菌属这些有害真菌与克雷伯菌属(Kribbella)有害细菌在CKY土壤样品中富集,这些有害菌属的富集可导致生菜染病或停止生长。
本次试验条件下T1Y相比CKY,产量提升11.0%,病株率降低2.5%。这与赵柏霞、李凤霞、刘雪娇以及赵惠施用芽孢杆菌提升樱桃、花椰菜、大豆与番茄的产量,并且有效防治大豆与番茄病害的结论一致[35-38]。
在设施生菜种植时灌根T1菌肥,能够降低土壤中由种菜而提高的假霉样真菌属、烟草镰刀菌属、丝孢菌属、赤霉菌属与醋杆菌门等不利于生菜生长或对人体有害的微生物丰度,且富集毛壳菌属、支顶孢菌属、芽孢杆菌、硝化螺菌、鞘氨醇单胞菌等有益生菜生长的微生物,起到改善土壤微生物结构的作用,同时提高生菜产量,降低生菜患叶斑病几率。
