粉防己碱对人视网膜母细胞瘤细胞株S0-Rb50增殖凋亡影响的可能机制研究
2020-06-03马高恩焦云娟刘向玲
马高恩 焦云娟 贺 琳 刘向玲
视网膜母细胞瘤(retinoblastoma,RB)是临床常见婴幼儿眼内恶性肿瘤之一,每年新发例数约占婴幼儿恶性肿瘤总例数的3%,早期及时、有效治疗生存率高,若延误治疗时机,病灶扩展至眼外,则可能造成低视症和眼盲,甚至死亡,对患儿家庭造成严重影响[1]。目前,RB临床治疗主要包括外科手术辅助放化疗等,但由于外科手术侵袭性强,放化疗不良反应较大,且易出现化疗药物耐药性等问题,临床治疗效果不理想[2]。因此,寻找安全、有效的抗RB药物仍是临床研究的重点。粉防己碱(tetrandrine,Tet)是从天然植物中提取的一种生物碱,研究发现,Tet除具有解热镇痛、血管扩张、抗菌消炎等药理学作用外,其在抗肿瘤方面也具有潜在应用价值[3,4]。已有研究证实,Tet具有抗乳腺癌作用,但关于其对人RB增殖及凋亡影响的研究仍较少[5]。本研究设计体外实验,通过检测不同浓度Tet对人RB细胞株S0-Rb50增殖及凋亡的影响,并进一步探讨其作用机制,为Tet在RB临床治疗中的应用提供参考。
材料与方法
1.材料:人视网膜母细胞瘤细胞株S0-Rb50购自中国科学院上海细胞库。粉防己碱(Tet,美国Sigma-Aldrich公司,纯度≥90%),RPMI1640培养基、小牛血清(美国Hyclone公司),BCA蛋白定量分析试剂盒(美国Thermo公司),磷脂酰肌醇-3激酶(phosphatidylinositol 3-kinase,PI3K)、蛋白激酶B(protein kinase B,Akt)、磷酸化Akt(phosphorylated,pAkt)、B淋巴细胞瘤-2基因(B lymphocyte tumor-2 gene,Bcl-2)、Bcl-2相关X蛋白(Bcl-2 related X protein,Bax)、裂解的含半胱氨酸天冬氨酸蛋白水解酶3(cleaved caspase-3)一抗及二抗(美国Cell Signaling Technology公司),Annexin-FITC/PI凋亡试剂盒(美国BD公司);VersaMAX型酶标仪(美国Molecular Dvices公司),7500实时荧光定量PCR仪(美国ABI公司),电泳仪、Tanon 5200化学发光成像分析系统(上海天能科技有限公司)。
2.细胞培养、干预及形态学观察:人视网膜母细胞瘤细胞株S0-Rb50培养于RPMI1640培养基(含10%小牛血清、1%青链霉素)、37℃、5% CO2恒温培养箱,取对数期生长细胞,调整细胞密度,以1.5×105个/毫升接种于96孔板,随机分为4组,即对照组、Tet低、中、高剂量组,每组5个复孔;待细胞重新贴壁生长至80%时,分别更换浓度为0、2.5、5.0、10.0μmol/L Tet细胞培养液,干预24h后于倒置相差显微镜下观察细胞形态学变化。
3.MTT法检测各组细胞增殖情况:取干预24、48、72h时各组细胞,加入5mg/ml的新鲜制备的四唑盐(tetrazolium salt,MTT)溶液20μl,继续培养4h后弃去上层培养液,加入DMSO 150μl,充分震荡至澄清,测定570nm处吸光度(optical density,A)值。
4.流式细胞术检测细胞周期及细胞凋亡情况:取干预24h时各组细胞,预冷磷酸盐缓冲液(phosphate buffer,PBS)洗涤细胞2次,2000r/min离心8min,弃去上清后加入1.0ml碘化丙啶(propidium iodide,PI),混匀室温静置15min,流式细胞仪检测各组细胞周期分布情况。取干预24h时各组细胞,计数1×106个细胞与0.5ml上样缓冲液、5μl Annexin V-FITC、5μl PI充分混匀,避光孵育15min,流式细胞仪分析细胞凋亡率。
5.实时荧光定量PCR(real-time fluorescence quantitative PCR,RT-qPCR)法检测蛋白表达情况:取干预24h时各组细胞,Trizol法提取总RNA,反转录获得cDNA模板,应用SYBR Premix Ex Taq试剂盒进行RT-qPCR扩增,按照试剂盒说明书设定反应体系,反应条件为95℃预变性32min;95℃变性20s,57℃退火40s,72℃延伸40s,重复42个循环。以β-actin为内参基因,2-△△CT为目的基因的相对表达强度,计算PI3K、Akt、Bcl-2、Bax mRNA相对表达量。引物序列详见表1。
6.Western blot法检测蛋白表达情况:取干预24h时各组细胞,加入细胞裂解液,震荡混匀后4℃、12000r/min离心10min,收集上清液进行BCA蛋白定量,取15μg与等量上样缓冲液混匀后沸水浴5min,进行十二烷基硫酸钠聚丙烯酰氨凝胶电泳,转膜至硝酸纤维素膜,封闭液常温封闭2h,加入一抗4℃摇床孵育过夜,洗膜后加入对应二抗常温孵育1h,洗膜后进行曝光和显影;应用灰度值分析软件进行扫描拍照,以PI3K、pAkt、Akt、Bcl-2、Bax、cleaved caspase-3与内参β-actin灰度值比值表示蛋白相对表达量。

表1 引物序列
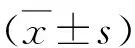
结 果
1.各组细胞形态学观察:倒置相差显微镜观察发现,对照组细胞形态规则、融合成片,不同干预组细胞随Tet浓度升高细胞体积逐渐减小、核质比例减小,不能融合成片,视野内漂浮细胞或细胞崩解碎片增多,详见图1。
2.各组MTT试验A值比较:各时刻MTT试验A值组间比较,差异均有统计学意义(P<0.05);与对照组比较,Tet高剂量组干预24h时A值较低,差异有统计学意义(P<0.05),Tet各剂量组干预48、72h时A值均较低,且随干预剂量升高呈降低趋势,差异均有统计学意义(P<0.05)。对照组MTT试验A值随干预时间的延长呈升高趋势(P<0.05),Tet高剂量组MTT试验A值随干预时间的延长无明显变化(P>0.05),详见表2。
3.各组细胞周期分布情况比较:G0/G1、S、G2/M期细胞占比组间比较,差异均有统计学意义(P<0.05);与对照组比较,Tet各剂量组G0/G1、S期细胞占比较低,G2/M期细胞占比较高,差异均有统计学意义(P<0.05);与Tet低剂量组比较,Tet中、高剂量组G0/G1、S期细胞占比较低,G2/M期细胞占比较高,差异均有统计学意义(P<0.05);与Tet中剂量组比较,Tet高剂量组G0/G1、S期细胞占比较低,G2/M期细胞占比较高,差异均有统计学意义(P<0.05),详见表3。

图1 倒置相差显微镜下观察各组细胞形态学(×400)A.对照组;B.Tet低剂量组;C.Tet中剂量组;D.Tet高剂量组
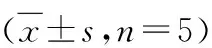
表2 各组MTT试验A值比较
与对照组比较,*P<0.05;与低剂量组比较,#P<0.05;与中剂量组比较,△P<0.05;与本组内24h比较,▲P<0.05;与本组内48h比较,&P<0.05
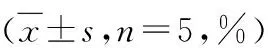
表3 各组细胞周期分布情况比较
与对照组比较,*P<0.05;与低剂量组比较,#P<0.05;与中剂量组比较,△P<0.05
4.各组细胞凋亡率比较:细胞凋亡率组间比较,差异均有统计学意义(P<0.05);与对照组比较,Tet各剂量组细胞凋亡率较高,差异均有统计学意义(P<0.05);与Tet低剂量组比较,Tet中、高剂量组细胞凋亡率较高,差异均有统计学意义(P<0.05);与Tet中剂量组比较,Tet高剂量组细胞凋亡率较高,差异有统计学意义(P<0.05),详见表4、图2。
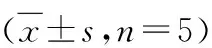
表4 各组细胞凋亡率比较
与对照组比较,*P<0.05;与低剂量组比较,#P<0.05;与中剂量组比较,△P<0.05
5.PI3K、Akt、Bcl-2、Bax mRNA表达量比较:PI3K、Bcl-2、Bax mRNA相对表达量组间比较,差异均有统计学意义(P<0.05);与对照组比较,Tet各剂量组PI3K、Bcl-2 mRNA相对表达量较低,Bax mRNA相对表达量较高,差异均有统计学意义(P<0.05);与Tet低剂量组比较,Tet中、高剂量组PI3K、Bcl-2 mRNA相对表达量较低,Bax mRNA相对表达量较高,差异均有统计学意义(P<0.05);与Tet中剂量组比较,Tet高剂量组PI3K、Bcl-2 mRNA相对表达量较低,Bax mRNA相对表达量较高,差异均有统计学意义(P<0.05),详见表5。
6.PI3K、Bcl-2、Bax、cleaved caspase-3蛋白表达量及pAkt/Akt比较:PI3K、Bcl-2、Bax、cleaved caspase-3蛋白相对表达量及pAkt/Akt组间比较,差异均有统计学意义(P<0.05); 与对照组比较,Tet各剂量组PI3K、Bcl-2蛋白相对表达量及pAkt/Akt较低,Bax、cleaved caspase-3蛋白相对表达量较高,差异均有统计学意义(P<0.05);与Tet低剂量组比较,Tet中、高剂量组PI3K、Bcl-2蛋白相对表达量及pAkt/Akt较低,Bax、cleaved caspase-3蛋白相对表达量较高,差异均有统计学意义(P<0.05);与Tet中剂量组比较,Tet高剂量组PI3K、Bcl-2蛋白相对表达量及pAkt/Akt较低,Bax、cleaved caspase-3蛋白相对表达量较高,差异均有统计学意义(P<0.05),详见表6、图3。
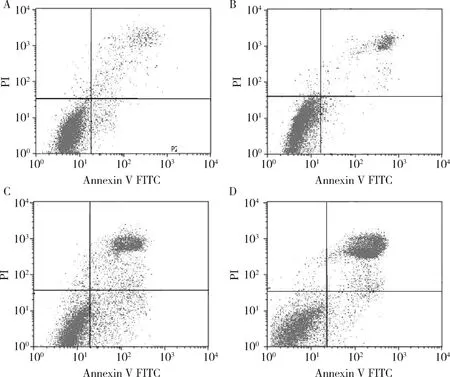
图2 Annexin Ⅴ-FITC/PI双染流式细胞仪检测细胞凋亡情况A.对照组;B.Tet低剂量组;C.Tet中剂量组;D.Tet高剂量组
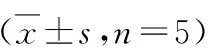
表5 PI3K、Akt、Bcl-2、Bax mRNA表达量比较
与对照组比较,*P<0.05;与低剂量组比较,#P<0.05;与中剂量组比较,△P<0.05
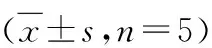
表6 PI3K、Bcl-2、Bax、cleaved caspase-3蛋白表达量及pAkt/Akt比较
与对照组比较,*P<0.05;与低剂量组比较,#P<0.05;与中剂量组比较,△P<0.05

图3 Western blot法检测蛋白表达情况A.对照组;B.Tet低剂量组;C.Tet中剂量组;D.Tet高剂量组
讨 论
RB是人类特有的一种眼内恶性肿瘤,多发生于出生后7~24个月,对患儿的视力和生命造成严重危害[6]。为提高患儿的生存质量,临床治疗主要趋势为避免眼球摘除、放疗等侵袭性强的治疗手段,尽量保留患儿视力,因此,寻找有效药物及靶向作用通路有重要意义。RB主要包括遗传性生殖细胞突变、非遗传性视网膜细胞突变两种类型,其发生和发展过程复杂,影响因素多样,目前仍未完全阐明,主要涉及癌基因激活、增殖失控及凋亡机制异常等[7,8]。因此,抑制RB细胞增殖、促进其凋亡是控制病情进展的关键。
Tet属于双苄基异喹啉碱,是从粉防己、防己等常用中草药植物根中提取的有效成分。研究表明,Tet对骨关节炎、支气管哮喘、神经母细胞瘤均有良好抑制作用[9~11]。张美峰等[12]研究发现,Tet可有效抑制人甲状腺癌细胞B-CPAP增殖、促进凋亡作用,且具有明显剂量依赖和时间依赖性,与本研究结果相似。本研究通过倒置显微镜观察发现,不同剂量Tet干预后各组细胞生长受到抑制,且呈现体积逐渐减小、核质比例减小、漂浮细胞或细胞崩解碎片增多等不良生长状态。通过MTT试验发现,Tet各剂量组干预不同时刻A值均明显降低,呈剂量依赖和时间依赖性,说明Tet可有效抑制S0-Rb50增殖。另外,本研究经流式细胞术检测发现,Tet干预24h后G0/G1、S期细胞占比均降低,G2/M期细胞占比、凋亡率均升高,且均具有剂量依赖性,提示Tet可抑制S0-Rb50增殖、促进凋亡,其中10.0μmol/L Tet干预效果最佳。由此,Tet对人RB细胞S0-Rb50具有增殖抑制和凋亡促进作用,可以看出Tet在RB治疗中疗效可观,为更多临床试验的开展提供参考。
癌细胞增殖、凋亡过程涉及多条信号通路共同调控,通过调节信号通路进而影响细胞内相关基因的表达,可间接发挥调控癌细胞增殖及凋亡过程[13]。PI3K是由调节亚单位和催化亚单位组成的异源二聚体,当胞外信号激活PI3K后,可使其下游效应分子Akt发生膜转位而磷酸化激活,Akt磷酸化进入细胞内进而调节其下游靶基因表达,参与调控细胞增殖过程[14,15]。PI3K/Akt信号通路激活后,可促进其下游Bcl-2与Bax蛋白呈游离状态,分布于线粒体内的Bcl-2可抑制细胞色素C释放,进而抑制caspase-3活化,发挥凋亡抑制作用,而Bax可通过活化死亡效应级联反应而促进凋亡进程[16,17]。本研究中Tet各剂量组干预24h后PI3K、Bcl-2 mRNA和蛋白相对表达量及pAkt/Akt均降低,Bax mRNA和蛋白、cleaved caspase-3蛋白相对表达量均升高,且均具有剂量依赖和时间依赖性,提示Tet可能通过抑制PI3K/Akt信号通路、下调Bcl-2 mRNA和蛋白、上调Bax mRNA和蛋白及cleaved caspase-3蛋白表达发挥抑制S0-Rb50细胞增殖、促进凋亡作用,可以看出Tet具有靶向作用于PI3K/Akt信号通路进而影响其抗肿瘤效果,为临床应用Tet进行靶向治疗RB提供参考依据。
综上所述,Tet可抑制人视网膜母细胞瘤细胞株S0-Rb50增殖,促进凋亡,其中10.0μmol/L Tet干预效果最佳,可能与抑制PI3K/Akt信号通路及其下游相关基因和蛋白的表达相关,在进一步的研究中应探讨Tet是否存在其他调控通路发挥增殖抑制和凋亡促进作用。本研究从体外水平验证了Tet抗视网膜母细胞瘤作用,为临床前试验的开展提供参考,同时为Tet相关药物的研发及应用于临床视网膜母细胞瘤的治疗提供数据支持。
