金雀异黄素通过ROS-NLRP3-IL-1β途径保护角膜上皮细胞免受高渗刺激诱导的损伤
2020-06-03陈婷妍美丽巴努玉素甫
周 洋 陈婷妍 美丽巴努·玉素甫
干眼(dry eye, DE)是常见的眼科疾病之一,指泪液的量、质或流体动力学异常引起的泪膜不稳定和(或)眼表损害,进而导致眼不适症状及视功能障碍[1]。干眼的发病机制复杂,炎症、细胞凋亡、性激素水平等因素均被报道参与了干眼病理过程。然而,干眼病理过程的最终通路是泪膜不稳定,泪液中电解质浓度升高导致泪液渗透压升高。因此,泪液的高渗透压引起的眼表炎症是该疾病的标志[2,3]。响应高渗应激(HS)产生的活性氧(ROS)不仅会引发眼表氧化应激,还会引发涉及核因子κB(NF-κB)和促分裂原活化蛋白激酶(MAPK)的炎症级联反应途径产生各种促炎细胞因子和趋化因子[4]。
炎性小体(inflammasome)是由多种蛋白质组成的复合体,能够调节caspase-1的活化进而在天然免疫防御的过程中促进细胞因子前体pro-IL-1β和pro-IL-18的切割成熟[5]。其还能调节caspase-1依赖的形式编程性细胞死亡,诱导细胞在炎性和应激的病理条件下死亡。其中,NLRP3炎性小体可以促进了IL-1β的成熟[6]。越来越多的证据表明,NLRP3参与了DE的发病机制。例如,在DE患者的眼表检测到了NLRP3炎性小体[7]。在大鼠 DE模型中,HS诱导产生的ROS可以激活NLRP3炎性小体[8]。此外,也有研究表明,ROS诱导的NLRP3激活通过caspase-1导致IL-1β分泌的增加,突出了ROS-NLRP3-IL-1β信号通路在DE进程中的启动作用[9,10]。因此,研究此重要步骤可能有益于控制DE中眼表炎症的发生。
金雀异黄素(genistein,Gen)是一种存在于豆类作物和齿状植物中的天然异黄酮,是有益于健康的化合物,具有抗氧化、抗炎、抗病毒感染、抑制肿瘤细胞增殖等作用[11~13]。金雀异黄素对免疫系统的影响也有广泛的研究。然而,尚未有研究金雀异黄素对DE中NLRP3炎性小体活化的影响。因此,本研究旨在研究金雀异黄素在HS诱导的NLRP3炎性小体激活中的作用及其潜在机制。
材料与方法
1.试剂与材料:金雀异黄素(genistein)、胰蛋白酶、DMEM 培养基、氯化钠、CM-H2DCFDA试剂盒、ELISA 试剂盒购自美国Sigma 公司,X-tremeGENE siRNA Transfection Reagent 购自瑞士Roche公司,超氧化物歧化酶、过氧化氢酶、谷胱甘肽还原酶测定试剂盒购自碧云天生物技术公司,兔抗人NRF2抗体、兔抗人Lamin B、山羊抗兔 IgG抗体购自美国Millipore公司,TIRzol试剂盒、Prime Script TM RT reagent Kit with gDNA Eraser 试剂盒、SYBR Premix Ex TaqⅡ 试剂盒购自日本TaKaRa公司。人永生化角膜上皮细胞(iHCEC)和原代角膜上皮细胞(priHCEC)购自美国标准生物品收藏中心。
2.细胞培养与分组处理:iHCEC和priHCEC用包含10%胎牛血清、100U/ml青霉素/链霉素的DMEM培养基,在 37℃、5%CO2培养箱中进行培养。当细胞生长至融合度达 80%~90%时,用 0.25% 胰蛋白酶消化5min。在DMEM 培养基中加入无菌饱和氯化钠溶液,分别调整培养基渗透压为 312mOsm/L(正常渗透压)和350、400、450mOsm/L(高渗透压)。将细胞随机分成3组进行对应处理:①对照组(312mOsm/L正常渗透压培养基培养细胞);②高渗刺激组(分别使用350、400、450mOsm/L高渗透压培养基培养细胞);③金雀异黄素组(细胞先在50μmol/L金雀异黄素中预处理30min,再在450mOsm/L高渗透压培养基中培养)。
3.CCK-8检测:将iHCEC和priHCEC重悬,以1×104个/孔均匀铺于 96 孔板中,在37℃、5%CO2培养箱中培养 24h。按分组给予不同处理继续培养24h后,每孔加入10μl CCK-8溶液,孵育2h,在酶标仪上450nm 处检测各组吸光光度值。
4.细胞转染 siRNA:将iHCEC以2×105个/孔接种至 24 孔板中进行相应处理后,加入100μl Opti-MEM, 5μl X-tremeGENE siRNA Transfection Reagent,混合均匀,加入1μg的NRF2 siRNA(阴性对照组加nc siRNA),短暂涡旋后室温孵育 20min。细胞在37℃、5%CO2培养箱中孵育24h后,丢弃上清,PBS洗涤3次,换用10%胎牛血清的 RPMI1640 培养液继续培养进行后续操作。
5.ROS测定:将iHCEC以2×104个/孔的密度接种在96孔板中,按分组给予不同处理后培养24h。加入10μmol/L CM-H2DCFDA在37℃下孵育30min后,用PBS洗涤两次,使用荧光显微镜进行观察拍照,并在酶标仪450nm 处检测各组吸光光度值。
6.酶活性测定:将2×104个/孔的密度接种于96孔板中的各组iHCEC进行相应处理后,加入适量的0.25%胰蛋白酶消化并收集细胞,离心弃上清,加入 RIPA 裂解液抽提各处理下的细胞总蛋白,BCA法测定蛋白浓度,之后按照试剂盒说明测定细胞中超氧化物歧化酶(SOD)、过氧化氢酶(Catalase)和谷胱甘肽还原酶(GR)的活性。
7.免疫荧光染色:按不同处理iHCEC 24h 后,用4% PFA固定15min后,将细胞在室温下用0.3% Triton X-100透化15min,加入免疫荧光封闭液,室温封闭 30min,分别加入一抗8-OHdG (1∶100)4℃孵育过夜,次日PBS 漂洗 3 次,将细胞与Alexa Fluor 488标记山羊抗兔IgG(H+L)二抗(1∶500)暗室室温孵育1h,DAPI染色10min,PBS漂洗 3 次,于荧光显微镜下观察并拍照。
8.ELISA检测:收集不同处理后iHCEC和priHCEC细胞培养上清液加入96孔板,湿盒中4℃过夜;使用PBST洗板3次,加入2%小牛血清室温封闭1h,每孔加入兔抗人IL-1β抗体(1∶100),37℃孵育1h,洗板3次,各孔加入HRP标记山羊抗兔IgG抗体(1∶5000)室温孵育1h后终止反应,洗板3次,四甲基联苯胺过氧化物酶溶液显色,于酶标仪450nm 处测各孔的吸光度值。
9.Western blot法:使用 RIPA 裂解液抽提各处理后iHCEC细胞总蛋白,BCA法测定蛋白浓度,制备SDS-PAGE胶,进行凝胶电泳分离蛋白,切胶并转移至PVDF膜,5% 脱脂奶粉室温封闭 2h。分别加兔抗NRF2 (1∶1000)、兔抗Lamin B (1∶2000) 抗体,4℃孵育过夜;HRP标记的山羊抗兔 IgG抗体(1∶5000),室温孵育 2h;采用 ECL发光显影,使用Image-Pro Plus 6.0分析蛋白质灰度值。
10.RT-PCR 检测:使用TIRzol试剂盒提取各处理下iHCEC细胞总 RNA,用 Prime Script TM RT reagent Kit with gDNA Eraser 试剂盒获取第1链 cDNA。使用SYBR Premix Ex TaqⅡ 试剂盒检测基因表达,以GAPDH 作为内参基因。扩增体系:上游引物1μl、下游引物1μl、cDNA 2μl、SYBR Premix Ex TaqⅡ 12.5μl、无酶水8.5μl。扩增条件:95℃ 3min,95℃ 30s,58℃ 30s,58℃ 30s,40个循环。表达水平均使用2-ΔΔCt法来计算。由上海吉玛公司设计并合成各个基因的引物,具体序列详见表1。

表1 各基因qPCR引物序列
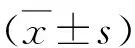
结 果
1.金雀异黄素对HS诱导的iHCEC和priHCEC细胞的保护作用:结合相关研究,本试验选择50μmol/L金雀异黄素进行预处理。将iHCEC和priHCEC在不同渗透压培养基中培养24h后,与对照组比较,在HS 450mOsm/L时iHCEC和priHCEC活力降低到58.5%、50.7%(P<0.05);而与HS 450mOsm/L比较,细胞在50μmol/L金雀异黄素预处理后再在HS 450mOsm/L培养基中培养,iHCEC和priHCEC的活性显著提高(P<0.05),细胞活性分别达到89.3%和78.9%。
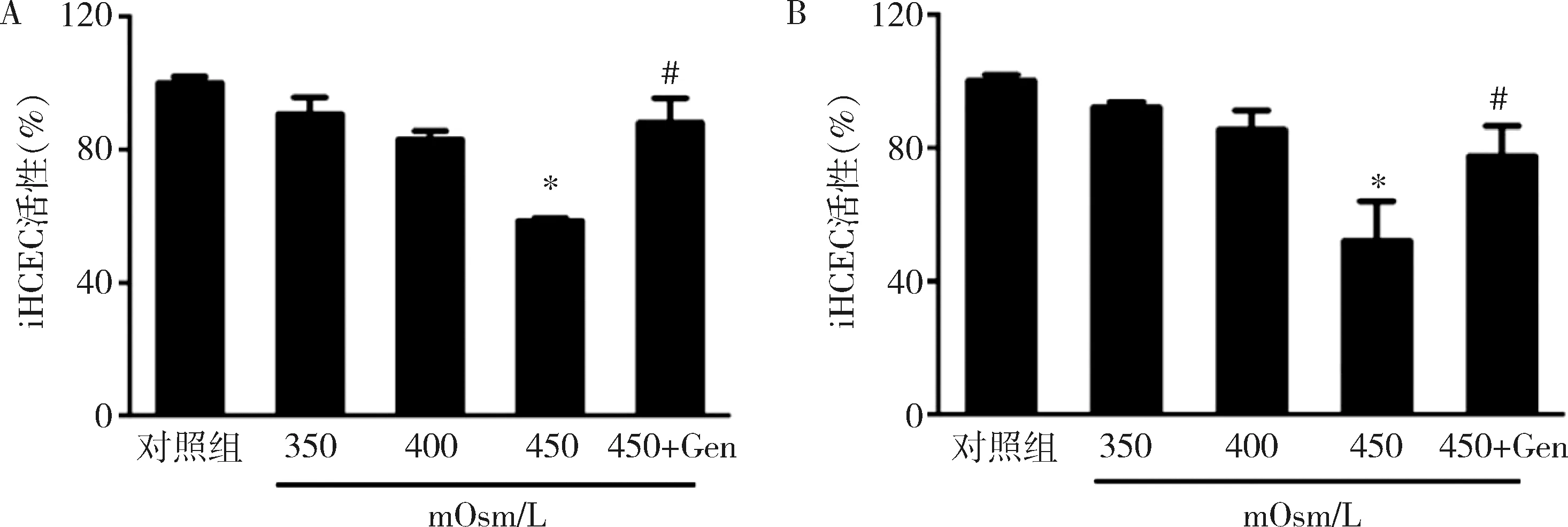
图1 CCK-8检测不同处理后iHCEC和priHCEC细胞活性A.不同处理下iHCEC活性;B.不同处理下priHCEC活性;与对照组比较,*P<0.05;与450mOsm/L组比较,#P<0.05
2.金雀异黄素抑制HS诱导的NLRP3活化:与对照组比较,在HS 450mOsm/L下iHCEC和priHCEC细胞中IL-1β的分泌水平均显著增加(P<0.01),而用50μmol/L金雀异黄素预处理细胞,IL-1β的分泌水平均显著降低(P<0.01,图2)。使用450mOsm/L的高渗培养基刺激iHCEC后,RT-PCR结果表明,在HS诱导下NLRP3、CASP1、IL-1β和IL-18mRNA的表达水平较高,而50μmol/L金雀异黄素预处理细胞后再于HS 450mOsm/L培养,这些基因的表达水平均显著下降(图3,P<0.05)。

图2 ELISA检测不同处理后iHCEC和priHCEC细胞中IL-1β的分泌水平A.不同处理下iHCEC中IL-1β的分泌水平;B.不同处理下priHCEC中IL-1β的分泌水平;与对照组比较,*P<0.01;与450mOsm/L组比较,#P<0.01

图3 RT-PCR检测不同处理iHCEC中NLRP3、CASP1、IL-1B和IL-18 mRNA的表达水平*P<0.05
3.金雀异黄素通过激活NRF2抗氧化剂信号转导来抑制HS诱导的氧化应激:ROS测定结果显示,与对照组比较,在450mOsm/L HS 培养iHCEC细胞24h后,细胞内ROS水平增加了约3倍(P<0.01),而用50μmol/L金雀异黄素预处理可以阻止ROS的升高(图4,P<0.01)。与对照组比较,在450mOsm/L HS 下,iHCEC细胞中的另一种氧化应激的生物学标志物8-OHdG升高了约6倍(P<0.01),而50μmol/L金雀异黄素预处理同样显著地抑制了8-OHdG的增加(图5,P<0.01)。与对照组比较, 450mOsm/L HS 下iHCEC细胞核中NRF2蛋白水平显著增加,而与450mOsm/L HS比较,50μmol/L金雀异黄素预处理再于HS 450mOsm/L培养,NRF2蛋白水平也显著增加(P<0.05,图6)。检测转染siRNA后iHCEC细胞,与nc siRNA比较,在转染NRF2 siRNA的细胞中NRF2 mRNA的表达水平显著下降(P<0.01,图7)。而金雀异黄素对IL-1β产生的抑制作用基本上被NRF2沉默所解除(P<0.05)。通过有关酶活性检测发现, NRF2诱导其调节的抗氧化酶的表达。与对照组比较,450mOsm/L HS 下iHCEC细胞中SOD、Catalase和GR的活性显著下降(P<0.01),而50μmol/L金雀异黄素预处理显著提高了其活性(图8,P<0.01)。
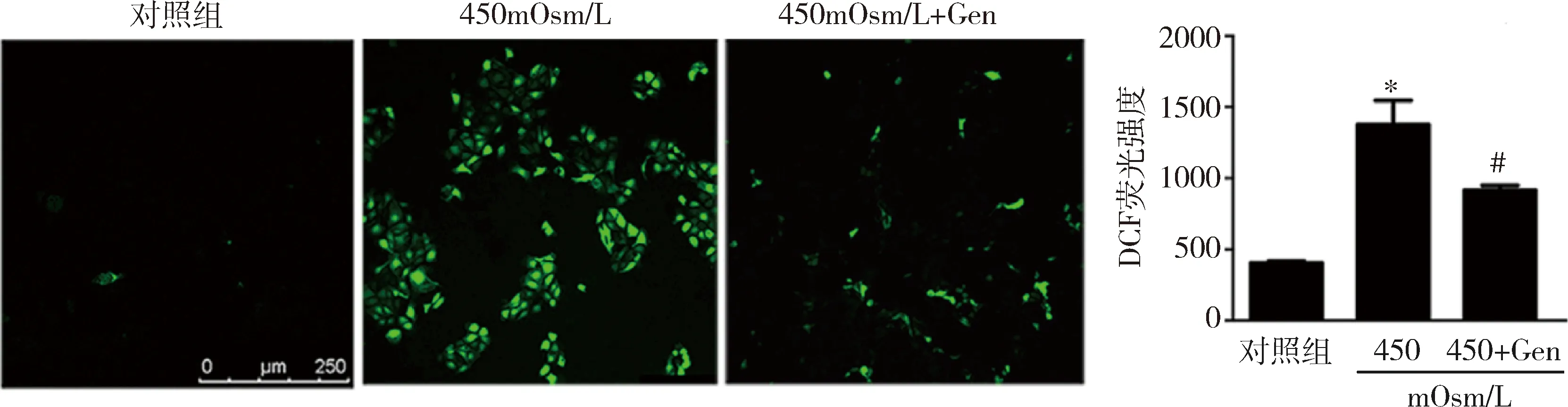
图4 CM-H2DCFDA探针检测不同处理下iHCEC细胞内ROS生成与对照组比较,*P<0.01;与450mOsm/L组比较,#P<0.01
图5 免疫荧光染色检测不同处理下iHCEC细胞中8-OHdG与对照组比较,*P<0.01;与450mOsm/L组比较,#P<0.01
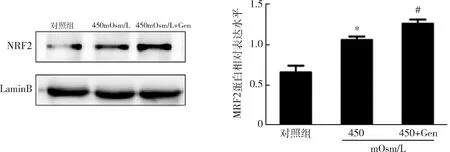
图6 Western blot法检测不同处理下 iHCEC细胞中NRF2蛋白的表达水平与对照组比较,*P<0.05;与450mOsm/L组比较,#P<0.05
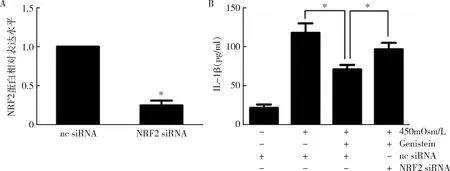
图7 不同处理iHCEC细胞转染 siRNA后NRF2 mRNA的表达水平与IL-1β分泌水平测定A.RT-PCR检测转染后iHCEC细胞中NRF2 mRNA的表达水平,与nc siRNA比较,*P<0.01;B.ELISA检测iHCEC细胞中IL-1β的分泌水平,*P<0.05

图8 不同处理iHCEC细胞中酶活性的检测A.SOD检测试剂盒检测细胞中SOD含量;B.Catalase检测试剂盒检测细胞中Catalase含量;C.GR检测试剂盒检测细胞中GR含量;与对照组比较,*P<0.01;与450mOsm/L组比较,#P<0.01
讨 论
角膜上皮屏障功能的重要结构基础是紧密连接存在于顶层角膜上皮细胞之间,而干眼会引起角膜上皮细胞脱落[14]。治疗干眼病的基本目标是改善角膜上皮细胞的病理状态,但引起这一病理改变的具体因素并不清楚。本研究通过实验研究发现,高渗环境会导致人角膜上皮细胞活性降低,而金雀异黄素可以抑制HS诱导的人角膜上皮细胞活性下降,证明了金雀异黄素可以保护细胞免受HS诱导的损伤。
非感染性炎症是干眼发病的重要因素。近年来关于泪腺、泪液以及结膜内炎性细胞和炎性介质等免疫因素的研究发现,多种类型干眼的泪腺组织、结膜组织以及泪液中T细胞增高,MHC-Ⅱ和 HLA-DR 阳性细胞增高,炎性因子 IL-1、TNF-α、MMP-9 等含量增高,均提示炎性因子在干眼发病中起重要作用[15]。炎性因子在角膜上皮细胞中高表达,参与免疫细胞向角结膜的聚集,导致了炎症的不断循环[16]。已有研究证明,在干眼相关的炎症中ROS-NLRP3-IL-1β信号通路具有引发作用。HS诱导的氧化应激,特别是ROS的产生,已被认为是引发NLRP3炎性体激活的关键触发因素,高渗刺激下可在15min内迅速诱导HCEC产生ROS,随后激活NLRP3导致pro-IL-1β mRNA和蛋白表达增加[8]。在本研究中,金雀异黄素预处理可以阻止了HS诱导的iHCEC和priHCEC细胞IL-1β分泌水平的增加,降低炎性体相关基因NLRP3、CASP1、IL1B和IL-18 mRNA的表达水平。在450mOsm/L HS 下iHCEC细胞内ROS水平显著增加,而用金雀异黄素预处理可以阻止ROS的升高。同样,金雀异黄素预处理下显著地抑制了iHCEC细胞中的另一种氧化应激的生物学标志物8-OHdG的增加。
NFR2 是内源性抗氧化防御系统的关键调节蛋白,可以抵抗氧化应激的主要细胞的防御机制,保护其免受炎症引起的氧化损伤。在氧化应激条件下NFR2发生核转位,与抗氧反应元件结合,启动抗氧化酶基因的转录从而发挥抗氧化的保护作用[17]。本研究表明,iHCEC细胞中NRF2蛋白水平在金雀异黄素预处理下较450mOsm/L HS 下仍增加,而通过转染NRF2 siRNA发现,金雀异黄素对IL-1β分泌产生的抑制作用基本上被NRF2沉默所解除,由此说明金雀异黄素的作用可能是通过激活NFR2来实现的。若 Nrf2 缺失或存在激活障碍,则会进一步加重细胞的氧化性损伤和炎性损伤,导致细胞生理功能障碍,最后甚至导致细胞凋亡或坏死,还可导致与氧化应激和炎症相关的疾病的发生[18]。本研究中iHCEC细胞在450mOsm/L HS刺激后,金雀异黄素显著促进了细胞核中NRF2表达,而同时NRF2诱导了几种抗氧化酶(SOD、Catalase和GR)的表达,且在金雀异黄素作用下这几种抗氧化酶的活性均升高。由此证明了金雀异黄素可以通过激活NRF2抗氧化剂来消除HS诱导的氧化应激。
综上所述,本研究表明,金雀异黄素可以保护HS诱导的人角膜上皮细胞的损伤,这种保护作用是通过激活NRF2抗氧化剂来抑制ROS-NLRP3-IL-1β信号通路实现的,并且诱导NRF2转运至细胞核,增强了几种抗氧化酶的活性。金雀异黄素可能会抑制HS诱导的细胞炎症的启动阶段,并具有在较早阶段预防和减轻与干眼相关的角膜炎症的潜在能力。
