vvi-miR160s介导VvARF18应答赤霉素调控葡萄种子的发育
2020-06-03白云赫王文然董天宇管乐宿子文贾海锋房经贵王晨
白云赫,王文然,董天宇,管乐,宿子文,贾海锋,房经贵,王晨
vvi-miR160s介导应答赤霉素调控葡萄种子的发育
白云赫,王文然,董天宇,管乐,宿子文,贾海锋,房经贵,王晨
(南京农业大学园艺学院,南京 210095)
【】研究vvi-miR160家族(vvi-miR160s)及其靶基因在‘魏可’葡萄种子发育过程中的作用,探究其应答赤霉素(GA)调控葡萄果实无核的潜在机理。采用miR-RACE、生物信息学分析、RT-qPCR、RLM-RACE等方法,鉴定vvi-miR160家族成员及其靶基因,分析vvi-miR160s及其靶基因应答GA的时空表达模式及其潜在功能。花前GA处理强烈抑制‘魏可’葡萄胚珠及种子发育,高效诱导其无核,且无核率达99.8%。克隆鉴定了前体基因序列(501 bp)及成熟体序列,且它们在不同物种间具有较高的保守性;基于vvi-miR160s序列,预测到靶基因,利用RLM-RACE技术检测到vvi-miR160s对的裂解位点在第10和第11位之间,裂解频度9/17,证明是vvi-miR160s的真实靶基因。该靶基因编码683个氨基酸,在398—411位存在核定位信号,且该蛋白亚细胞定位于细胞核上。VvARF18与其他物种间序列的同源保守性较高,基因结构相似,其中VvARF18蛋白与茶、烟草、梅花等物种亲缘关系较近。启动子中包含4种作用元件,且含有较多激素相关元件。RT-qPCR结果显示,随着葡萄果实的发育,vvi-miR160c/d/e呈现‘V’形表达趋势,在硬核种子发育期表达较低,而表现出与前者相反的表达趋势,在硬核种子发育期呈现高表达,表明vvi-miR160c/d/e对负调控,但vvi-miR160a/b与表达水平却不存在明显负相关。GA处理极显著地上调了vvi-miR160a/b在葡萄硬核种子发育期的表达,同时也显著抑制了在同时期的表达,且它们的表达水平呈负相关,表明GA处理促进了vvi-miR160a/b对的负调控作用;相反,GA减弱了vvi-miR160c/d/e对的负调控作用。在vvi-miR160家族中,vvi-miR160c/d/e可能介导在葡萄种子发育的特定阶段调控种子的发育形成,而vvi-miR160a/b可能主要介导参与调控GA诱导葡萄种子败育的过程。
葡萄;vvi-miR160s;;GA;种子发育
0 引言
【研究意义】MicroRNA(miRNA)是一类长度约为19—24个核苷酸的非编码RNA序列,其主要通过特异性切割或抑制靶mRNA的翻译调节靶基因的表达[1-2],在植物的多种生理代谢过程中起着重要的调节作用[3],如信号转导[4]、生长发育[5]和非生物胁迫[6]等。植物中已经鉴定了许多miRNA家族,其中microR160家族比较保守,其在调节植物形态[7],增强植物抗性[8],调节花和胚胎的发育[9-10],影响植物体内激素含量的变化[11]等过程中起着重要作用。到目前为止,miR160及其靶基因功能的研究主要集中在营养生长和生殖生长方面,笔者课题组前期研究发现葡萄miR160(vvi-miR160s)及其靶基因可能参与单性结实发育的调控,而对浆果发育,尤其是在果核发育方面尚未见报道。因此,开展miR160及其靶基因对葡萄果核发育的调控机制研究,对阐释葡萄果实核发育机制以及无核育种具有重要意义。【前人研究进展】研究发现miR160主要靶向生长素响应因子ARF(Auxin response factor,ARF)转录因子,其主要调控生长素响应基因的表达[12],能够与生长素基因启动子中的TGTCTC序列特异性结合,激活或抑制相关基因的表达[13]。目前,ARF家族已经在番茄、拟南芥、苹果、柑橘、大豆、黄瓜、谷子、白菜等作物中得到鉴定[14]。番茄miR160a通过抑制靶基因,影响叶片生长[15];拟南芥miR160负调控靶基因,参与生长素信号转导,影响植株的营养生长与生殖生长[11]。拟南芥miR160还可负调控靶基因和,通过ABA途径参与种子的萌发和休眠[16]。近期研究发现,ARF是生长素与赤霉素信号途径的交互作用因子。通过降低番茄mRNA水平可能影响GA信号通路,且仅调控番茄果实坐果及其相关的生长素信号通路[17]。例如,在拟南芥中,生长素处理导致AUX/IAA和ARF蛋白可直接调节GA代谢基因的表达,并且该结果与生长素过表达突变体相同[18]。此外,拟南芥胚珠受精可引发生长素介导的GA生物合成[19]。尽管如此,有关ARFs调控植物种子发育的研究尚未见报道。葡萄(. L)是世界上重要的经济作物之一,其栽培面积和产量仅次于柑橘,位居世界第二。葡萄是赤霉素(GA)高度敏感型果树,外源GA处理极易诱导葡萄无核或残核;另一方面,GA也可调控葡萄种子发育从而影响果实大小。尽管GA被广泛应用于葡萄无核生产或种子发育调控,但其分子机制尚不清晰。【本研究切入点】基因组测序使葡萄基因组中vvi-miR160s成熟体精确序列的鉴定及进化分析成为可能,但其对靶基因的裂解作用,以及它们在GA介导的葡萄果实发育过程中的时空表达模式尚无报道。【拟解决的关键问题】鉴定‘魏可’葡萄中vvi-miR160家族成员的精确序列,预测并验证其靶基因,分析其序列特征及其潜在功能,鉴定它们在葡萄种子发育中的时空表达特征及其应答GA的模式,为进一步认识vvi-miR160s及其靶基因在种子发育过程中的作用提供重要信息,同时也为GA诱导果实无核过程提供一定的理论依据。
1 材料与方法
试验于2017年在江苏省农业科学院葡萄科研基地进行。
1.1 试验材料
以5年生欧亚种葡萄‘魏可’为材料。选取生长势基本一致的花序,根据前人研究结果,以50 mg∙L-1赤霉素溶液(含0.2%吐温),于盛花前9 d浸沾花穗30 s,以清水为对照,分别在花后2、5、10、20、30和40 d采集样品,一部分用于体式显微镜观察,另一部分分离果皮、果肉、种子,冻存于液氮后于-80℃保存备用。
1.2 试验方法
1.2.1 vvi-miR160s成熟体序列克隆鉴定 在miRBase 22.1数据库(http://www.mirbase.org/)中搜索不同物种miR160s的成熟体序列,基于葡萄miR160s成熟体序列,利用miR-RACE在‘魏可’种子中克隆其成熟体序列,测序鉴定其精准序列[20],并在葡萄基因组中比对葡萄miR160s前体基因()。使用在线软件Primer3 Input(http:// bioinfo.ut.ee/primer3-0.4.0/)设计引物(表1),以‘魏可’葡萄总DNA为模板进行扩增(95℃预变性5 min;95℃变性30 s,58℃退火30 s,72℃延伸30 s,36个循环;72℃延伸5 min),产物经电泳回收,送公司测序。利用在线软件RNA Folding Form(http://unafold.rna.albany.edu/?q=mfold/RNA-Folding-Form)分析前体茎环结构;利用软件MapInsepet进行染色体位置的绘制。
1.2.2 vvi-miR160s靶基因预测及生物信息学分析 运用在线软件PSRNA Target(http://plantgrn.noble.org/ v1_psRNATarget/#)预测vvi-miR160s的靶基因。运用在线软件ExPASy(http://web.expasy.org/protparam/)分析VvARF18蛋白的分子式、分子质量、等电点、氨基酸含量、不稳定指数、亲疏水性;在线软件NCBI Conserved Domain Serch(https://www.ncbi.nlm.nih. gov/Structure/cdd/wrpsb.cgi)分析VvARF18蛋白的保守结构域;在线软件NLS Mapper(http://nls-mapper. iab.keio.ac.jp/cgi-bin/NLS_Mapper_form.cgi)进行核定位信号分析;Genscript(https://www.genscript.com/ wolf-psort.html)进行亚细胞定位分析。利用NCBI- BLAST寻找VvARF18蛋白的同原序列,并用MEGA 6.0 构建系统进化树。利用在线软件GSDS(http:// gsds.cbi.pku.edu.cn/)进行不同物种基因结构构建;在线软件MEME(http://meme-suite.org/tools/meme)进行不同物种作用元件motif分析;在线软件PlantCARE(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)进行启动子作用元件分析。
1.2.3启动子顺式作用元件分析 在Grape Genome Browser(http://www.genoscope.cns.fr/externe/ GenomeBrowser/Vitis/)数据库中寻找转录起始位置上游1 500 bp序列,即启动子序列,将启动子序列放入在线数据库Plant CARE中,寻找相对应的作用元件。
1.2.4 vvi-miR160s及其靶基因在葡萄果核发育过程中的表达分析 采用CTAB法提取葡萄种子总RNA,并使用abm试剂盒反转录为cDNA。根据定量引物设计的原则,利用Primer3 Input(http://bioinfo.ut. ee/primer3-0.4.0/)设计vvi-miR160家族以及的定量引物(表2)。

表1 VvMIR160sPCR扩增引物序列
按照SYPBR Premix ExTaqTM试剂盒(宝生物工程有限公司)指导,采用实时定量PCR(real-time quantitative PCR,qRT-PCR)检测基因的相对表达量。扩增体系为20 μL(1 μL cDNA,上、下游引物各0.4 μL,10 μL 2×TransStart Tip GreenqPCR SuperMix,8.2 μL ddH20)。反应程序为:94℃ 30 s;94℃5 s,60℃15 s,72℃ 10 s,40个循环。葡萄(XM002273532)为内参基因,进行3次生物学重复。采用ΔΔCT法分析数据。
1.3 数据分析
使用Excel 2017进行数据整理,SPSS 22.0进行方差分析,使用Origin 9软件进行绘图。
2 结果
2.1 GA处理对‘魏可’葡萄果核发育的影响
本试验通过花前赤霉素(GA)处理发现,花后2 d时,对照组和GA处理组均有胚珠,但是对照比GA处理组的胚珠大;到花后5 d时,对照组可明显观察到胚珠,而GA处理组胚珠发育不良,逐渐退化、缩小;在花后10、20、30和40 d中,对照组中胚珠逐渐发育成成熟种子,而GA处理组胚珠退化、消失,导致果实无核,仅可以观察到木质化的细线(图1-A)。除此之外,GA处理还增大果实纵经、减小果实横径,增大果形指数(图1-B)。以上结果表明,GA可以抑制葡萄果实胚珠及种子的发育,从而诱导果实无核,同时影响果实形状。
2.2 vvi-miR160s序列鉴定及前体基因扩增
采用miR-RACE技术,鉴定葡萄中vvi-miR160s成员的精确序列。vvi-miR160s成员的3′和5′-miR- RACE的产物分别为88 bp和62 bp(图2-A),且该序列与miRBase22.1数据库中所上传的序列一致。以‘魏可’葡萄总DNA为模板,对vvi-miR160s的前体基因进行扩增。经凝胶电泳后获得5条约501 bp的特异性条带,并且没有非特异性杂带。经纯化、测序后发现,其前体基因序列均为501 bp(图2-B)。

图1 GA处理对‘魏可’葡萄果实发育的影响
Fig. 1 Effect of GA treatment on fruit development of Wink grape

表2 vvi-miR160s及VvARF18定量引物序列
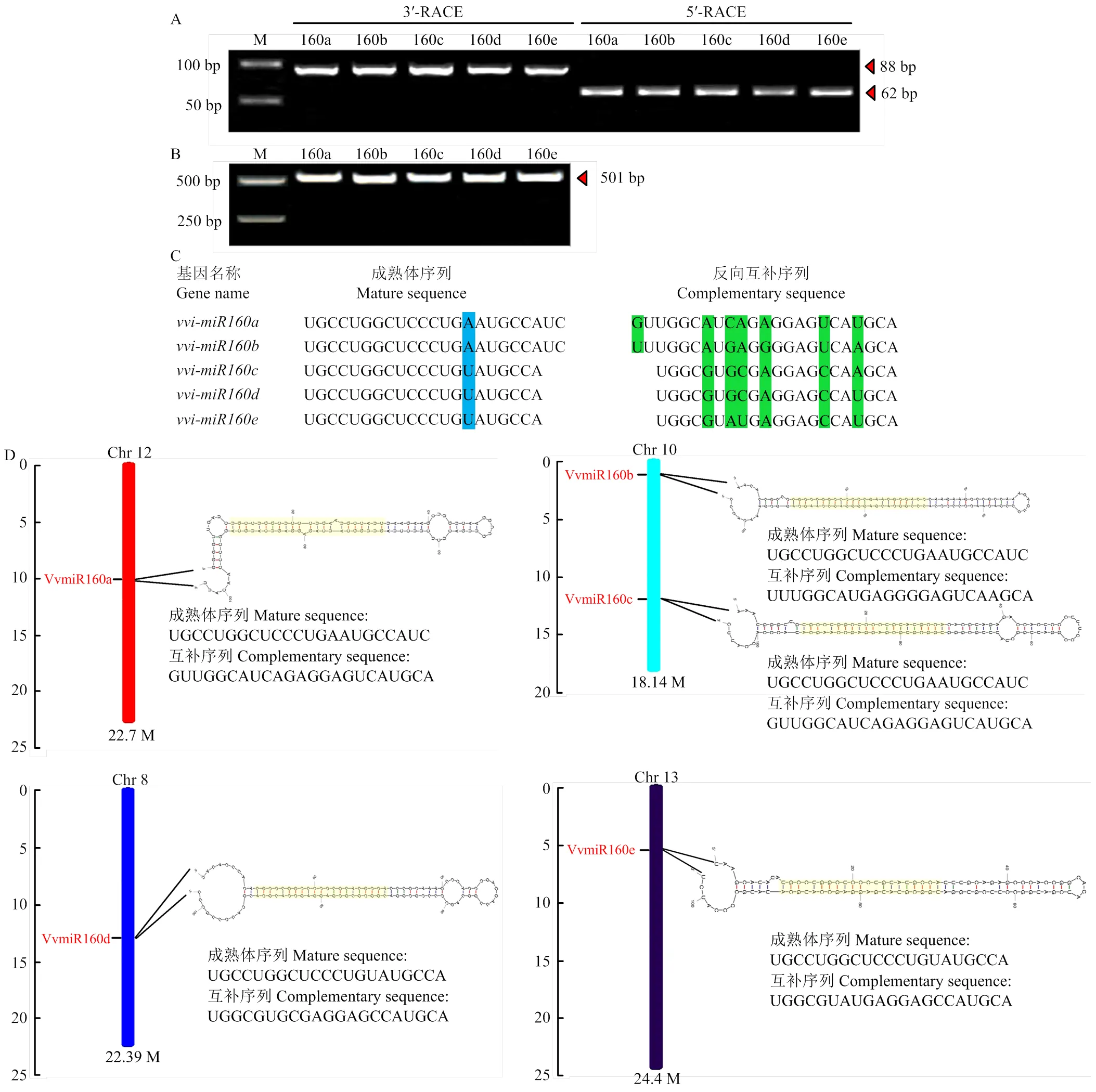
图2 vvi-miR160s成熟体序列分析和染色体分布
其中,vvi-miR160a/b成熟体序列为23 bp,而vvi-miR160c/d/e的序列长度为21 bp;vvi-miR160s成熟体序列保守程度较高,其中vvi-miR160a、b相同,vvi-miR160c、d、e序列相同;而vvi-miR160s互补序列的保守度较低(图2-C)。vvi-miR160s成员分别分布在染色体12(vvi-miR160a)、染色体10(vvi-miR160b和vvi-miR160c)、染色体8(vvi-miR160d)和染色体13(vvi-miR160e)上,其中vvi-miR160a和b成熟体序列相同,但却分布在不同染色体上,而vvi-miR160b和c成熟体序列不同,却分布在相同的染色体上,表明成熟体序列保守的miRNA在染色体上位置并不一定保守;通过在线软件RNA Folding Form分析可知,vvi-miR160s前体序列均可形成稳定的茎环结构,这为VvmiRNAs稳定存在提供了有力的证据(图2-D)。
2.3 VvMIR160s前体基因的进化分析与成熟体序列比对
利用MEGA6.0软件对拟南芥()、烟草()、番茄()、毛果杨()、水稻()等17种植物的miR160家族进行进化关系分析以及成熟体序列比对(图3)。结果表明,不同物种miR160家族成员数量不同,小麦()、棉花()、花生()、向日葵()等物种中miR160家族成员仅有1个,而水稻(6个)()、烟草(4个)()、高粱(6个)()、苹果(5个)()、毛果杨(8个)()等物种的miR160家族成员较多;除vvi-miR160a/b外,其余物种miR160家族成员成熟体序列为21个碱基。并且从进化图谱和成熟体序列比对中发现,vvi-miR160c/d/e与小麦、草莓()、玉米()、高粱、水稻等物种的亲缘关系较进,且成熟体序列相同;与向日葵、柑橘()等物种的亲缘关系较远,且成熟体序列间存在差异,而vvi-miR160a/b与毛果杨ptc-miR160e/ f/g/h、烟草nta-miR160d、甜瓜cme-miR160d亲缘关系较进,且成熟体序列相同,但值得注意的是,vvi-miR160s成员与棉花成熟体序列的差异较大,仅有9个碱基完全匹配。综上所述,尽管不同物种miR160家族成员保守性较高,但仍存在个别物种间miR160家族成员存在一定的差异,表明其序列存在较高保守性的同时也具有一定的进化多样性。
2.4 vvi-miR160s靶基因的预测
利用在线软件psRNATarget预测vvi-miR160s的靶基因(图4)。结果发现,vvi-miR160家族不同成员均有相同的靶基因(VIT213s0019g04380)、(VIT218s0001g04180)、(VIT208s0040g01810)。其中,vvi-miR160s与的错配率为2.5,与和的错配率为3。鉴于前期已有vvi-miR160s靶基因和的研究[21],因此,本研究重点对错配率最低的靶基因开展研究,分析vvi-miR160s介导的调控作用。

×:错配为1,○:错配为0.5
2.5 靶基因VvARF18的序列及潜在功能分析
2.5.1序列结构分析共编码683个氨基酸。VvARF18蛋白分子式为C3327H5169N939O1003S28,分子质量为75 268.01 Da,理论等电点pI为6.43;丙氨酸的含量最高为9.5%,其次为亮氨酸占8.9%,最低为色氨酸,仅1.6%;不稳定指数48.84,为不稳定蛋白(40以下为稳定蛋白),总平均输水指数为-0.388,表明其为亲水性蛋白。VvARF18蛋白有3个结构域,分别为B3结构域(117—218位氨基酸)、生长素响应结构域(279—362位氨基酸)和AUX-IAA结构域(604—681位氨基酸)。结构分析发现,蛋白的第398—411位存在核定位信号(PPRKKLRLQQQSEF)(图5-A)。亚细胞定位预测结果也表明,其主要定位于细胞核上。
通过基因结构分析发现,不同植物中的内含子数量从2—4个不等(图5-B),其中葡萄与榴莲()、龙眼()、番木瓜()、草莓、茶()、橡胶树()基因结构相似(均含有2个内含子、3个外显子),且每个外显子长度和分布相似,而内含子长度差异较大。特殊的是,烟草没有5′ UTR序列。这些结果表明,结构较为保守,但在进化的过程中表现出一定的多样性。
2.5.2 ARF18蛋白进化分析 利用NCBI数据库,对葡萄ARF18蛋白序列进行同源比较,使用MEGA6.0软件构建系统进化树(图6)。结果发现,VvARF18蛋白与茶、烟草、梅花等物种的亲缘关系较进,与毛白杨、番木瓜、甜樱桃、草莓等物种亲缘关系较远。
2.5.3 ARF18蛋白作用元件分析 利用在线软件MEME对ARF18蛋白进行作用元件motif分析(图7)。结果表明,VvARF18蛋白和其他14个物种ARF蛋白作用元件的数量和排列顺序完全相同,且这15个motif作用元件保守性也非常高,表明VvARF18蛋白与其他物种氨基酸序列保守性较高,功能相似。

图5 ARF序列结构分析

图6 ARF18蛋白进化分析
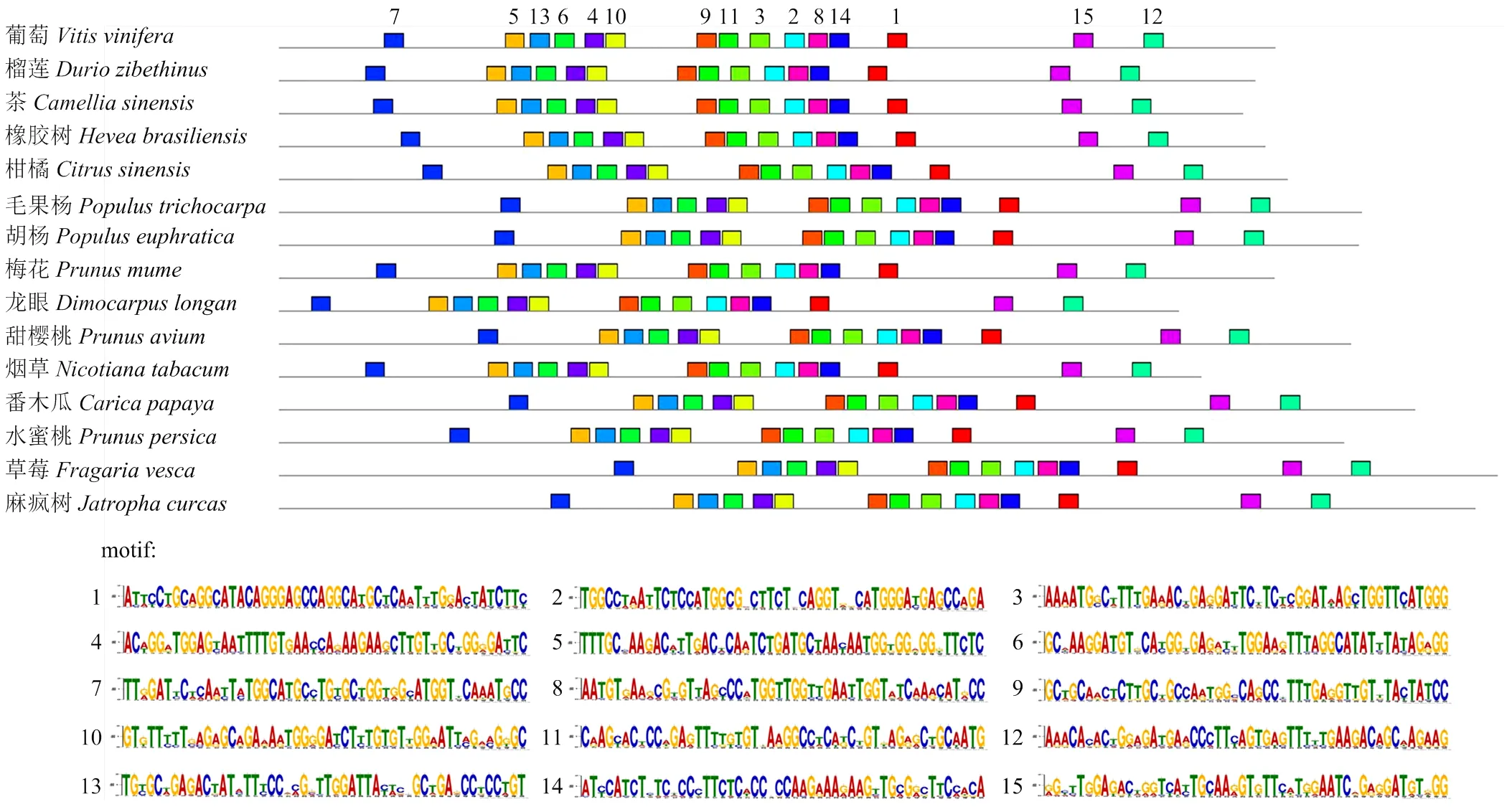
图7 ARF18蛋白作用元件
2.6 VvARF18启动子顺式作用元件分析
利用在线软件Plant CARE对启动子分析发现,在启动子中,除了含有基本的作用元件CAAT-box、TATA-box外,其余作用元件可以分为4类:光响应作用元件如3-AF1 binding site、AE-box、Box 4、G-box、GT1-motif;胁迫相关作用元件如厌氧诱导元件(ARE)、低温诱导元件(LRT);而MYBHv1结合位点(CCAAT-box)和MYB参与干旱诱导位点(MBS);在激素类响应元件中,有较多的激素类型,如脱落酸响应元件(ABRE)、生长素响应元件(AuxRR-core)、茉莉酸甲酯响应元件(CGTCA-motif和TGACG-motif)以及赤霉素响应元件(P-box)(表3),由此推测可能参与不同激素信号通路。

表3 VvARF18基因启动子顺式作用元件
2.7 vvi-miR160s及其靶基因裂解验证
鉴于植物miRNA主要通过介导靶基因的裂解调控靶基因的表达,本研究利用5′-RLM-RACE和3′-PPM- RACE技术验证vvi-miR160s的靶基因。RLM-RACE结果表明(图8),vvi-miR160a/b和vvi- miR160c/d/e均可裂解,裂解位点位于miRNA 5′端的第10位,且裂解频度为9/17;PPM-RACE结果进一步证实,vvi-miR160s均可裂解靶基因,其裂解位点相同于RLM-RACE结果,裂解频度为3/20,显著低于RLM-RACE结果,这可能是由于5′末端的裂解产物比3′末端产物更容易降解。该试验结果证明了是vvi-miR160s家族真实的靶基因。

图8 vvi-miR160s及其靶基因裂解验证
2.8 vvi-miR160s和VvARF18在葡萄种子发育过程中的时空表达模式及其相关性
在葡萄种子发育过程中,vvi-miR160a/b的表达量在花后2—10 d呈上升趋势,而在20—40 d时,表达量较低,几乎不表达;vvi-miR160c/d/e的表达量在种子发育的整个时期呈先下降后上升的变化趋势,并且在花后20 d时,表达量最低;而在种子发育的过程中呈先上升后下降的变化趋势,并在花后10 d表达量最高(图9-A)。
对比vvi-miR160s和的表达模式,发现vvi-miR160c/d/e与靶基因呈现比较显著的负相关,而vvi-miR160a/b与之间相关性较差(图9-B),表明在葡萄种子发育过程中,vvi-miR160家族可能主要通过vvi-miR160c/d/e介导起调控作用,而vvi-miR160a/b在葡萄种子发育过程的调控作用可能较弱。
2.9 vvi-miR160s和VvARF18响应GA的时空表达模式及其相关性
通过外源赤霉素处理,研究vvi-miR160s及其靶基因对葡萄种子发育的影响(图10-A)。结果表明,赤霉素处理使vvi-miR160a/b的表达呈上升趋势,尤其在花后20—40 d,表达差异达到极显著水平;相比之下,赤霉素处理对vvi-miR160c/d/e表达的影响并不太显著。有趣的是,赤霉素处理却显著上调了靶基因在花后2—5 d葡萄胚珠中的表达,而在花后10—40 d,的表达却被显著下调。对比赤霉素处理后vvi-miR160s与表达水平的相关性(图10-B),发现在赤霉素处理诱导葡萄种子败育过程中,赤霉素处理诱导了vvi-miR160a/b与表达水平的负相关,却减弱了vvi-miR160c/d/e与表达水平的负相关,表明GA增强了vvi-miR160a/b对的负调控作用,却减弱了vvi-miR160c/d/e对的负调控作用,同时也表明在vvi-miR160家族中,vvi-miR160a/b可能是主要应答GA介导葡萄种子败育的调控因子。

图9 vvi-miR160s:VvARF18时空表达模式及其相关性

图10 vvi-miR160s和VvARF18响应GA在葡萄种子发育过程中的时空表达分析
3 讨论
研究表明,施用外源GA对花发育,葡萄果实膨大、成熟以及无核化具有重要的影响[21-23]。然而,GA信号转导介导的葡萄果实种子败育的分子机制尚不清楚。近年来,microRNA通过间接或直接转录和转录基因沉默调节基因网络在各种发育和应激反应中的活性,被鉴定为基因表达的关键因子[24-26]。例如,拟南芥miR160负调控靶基因和,参与ABA途径调控种子的萌发和休眠[19];同时,miR160和miR166/165还参与了拟南芥体细胞胚胎诱导中LEC2介导的生长素反应[10]。笔者课题组前期研究揭示,外源GA的应用诱导了参与果实发育的microRNA家族的表达,如miR397[27]和miR156[28]。在本试验中,利用vvi-miR160s-研究GA介导葡萄果实发育的调节功能,发现GA可以抑制葡萄果实胚珠及种子的发育,从而诱导果实无核化,同时影响果实形状。本研究与王文然等[27]的研究结果一致,证实GA信号传导是葡萄果实无核化的重要调控因素。
MicroRNA基因家族的进化分析对全面阐述miRNA的功能具有重要作用。随着miRNA测序技术的不断进步以及基因组数据库的不断完善,许多物种中miRNA160家族不断被挖掘,如苹果[29]、柑橘[30]、草莓[31]等,并且不同物种中miR160s是一个多拷贝基因家族,具有高度保守性。基于之前对GA诱导葡萄单性结实的microRNA测序[32],本研究精确鉴定了vvi-miR160s家族的序列,同时比对了不同物种间miR160家族的进化关系,发现在不同物种间miR160s成熟体序列有9个氨基酸高度保守,但是在棉花miR160与其他miR160家族存在较大差异,说明miR160序列存在较高保守性的同时也具有一定的进化多样性。
ARF18进化树分析表明,VvARF18与茶ARF18亲缘关系最近,并且两者的基因结构相同,均含2个内含子和3个外显子,同时蛋白作用元件分析表明,两者含有的作用元件数量和排列顺序完全相同,说明VvARF18蛋白和茶ARF18蛋白具有相似的功能,进一步表明不同物种间ARF18蛋白高度保守性。启动子顺式作用元件分析表明,其含有较多的光、激素响应元件。前期研究发现miR160s中同样含有较多激素响应元件[21],表明vvi-miR160s和共同参与葡萄果实发育过程中激素信号的转导。
MiRNA家族的多个成员及其靶基因可以形成具有一些冗余或互补功能的miRNA介导的调节网络,并且不同的miRNA家族成员具有不同的时空表达模式[33]。研究表明,水稻花药的早期发育[34]、杏种子SASK的生物合成[35]及甜菜响应盐胁迫[36]等过程,均通过miR160负调控其靶基因实现。同样,本研究也表明,在葡萄种子发育过程中,vvi-miR160家族可能主要通过vvi-miR160c/d/e介导靶基因起调控作用。此外,在拟南芥中,ath-miR160a通过负调控影响胚胎的发育[37]。番茄miR160通过靶向进而影响番茄的花器官脱落和子房异常等各个方面[38],且番茄sly-miR160敲除使植物表现出异常的子房和花器官脱落。本研究发现,GA增强了vvi-miR160a/b对的负调控作用,却减弱了vvi-miR160c/d/e对的负调控作用,表明在vvi-miR160s家族中,vvi-miR160a/b可能是主要应答GA介导葡萄种子败育的调控因子。这些都表明miR160可能介导参与调控植物子房及种子的发育本研究结果为进一步开展vvi-miR160s及其靶基因如何响应GA信号调控葡萄无核果实发育的分子机制研究奠定了重要基础。
4 结论
本研究应用miR-RACE技术鉴定了葡萄miR160成员的精确序列,预测到其靶基因;利用RLM-RACE技术检测vvi-miR160s对其靶基因的裂解位点在第10和第11位之间,裂解频度9/17。在vvi-miR160家族中,vvi-miR160c/d/e可能介导在葡萄种子发育的特定阶段调控种子的发育形成,而vvi-miR160a/b可能介导主要参与调控GA诱导葡萄种子败育的过程。
[1] Park M Y, Wu G, Gonzalez-sulser A, Vaucheret H, Poethig R S. Nuclear processing and export of microRNAs in., 2005, 102(10): 3691-3696.
[2] BRODERSEN P, SAKVARELIDZE-ACHARD L, BRUUN- RASMUSSEN M, DUNOYER P, YAMAMOTO Y Y, SISBURTH L, VOINNET O. Widespread translational inhibition by plant miRNAs and siRNAs., 2008, 320(5880): 1185-1190.
[3] BUSHATI N, COHEN S M. microRNA functions., 2007, 23(1): 175-205.
[4] GOSWAMI K, TRIPATHI A, SANAN-MISHRA N. Comparative miRomics of salt-tolerant and salt-sensitive rice., 2017, 14(1): 189-197.
[5] NAG A, JACK T. Sculpting the flower; the role of microRNAs in flower development., 2010, 91: 349-378.
[6] CHEN Q S, LI M, ZHANG Z C, TIE W W, CHEN X, JIN L F, ZHAI N, ZHENG Q X, ZHANG J F, WANG R, XU G Y, ZHANG H, LIU P P, ZHOU H N. Integrated mRNA and microRNA analysis identifies genes and small miRNA molecules associated with transcriptional and post-transcriptional-level responses to both drought stress and re-watering treatment in tobacco., 2017, 18(1): 62.
[7] TURNER M, NIZAMPATNAM N R, BARON M, COPPIN S, DAMODARAN S, ADHIKARI S, ARUNACHALAM S P, YU O, SUBRAMANIAN S. Ectopic expression of miR160 results in auxin hypersensitivity, cytokinin hyposensitivity, and inhibition of symbiotic nodule development in soybean., 2013, 162(4): 2042-2055.
[8] PINWEHA N, ASVARAK T, VIBOONJUN U, NARANGAJAVANA J. Involvement of miR160/miR393 and their targets in cassava responses to anthracnose disease., 2015, 174(1): 26-35.
[9] LIU X D, HUANG J, WANG Y, KHANNA K, XIE Z X, OWEN H A, ZHAO D Z. The role of, anloss-of-function mutation in, in organogenesis and the mechanism regulating its expression., 2010, 62(3): 416-428.
[10] WÓJCIK A M, NODINE M D, GAJ M D. MiR160 and miR166/165 contribute to the LEC2-mediated auxin response involved in the somatic embryogenesis induction in., 2017, 8: 2024.
[11] MALLORY A C, BARTEL D P, BARTEL B. MicroRNA-directed regulation ofis essential for proper development and modulates expression of early auxin response genes., 2005, 17(5): 1360-1375.
[12] TIWARI S B, HAGEN G, GUILFOYLE T. The roles of auxin response factor domains in auxin-responsive transcription., 2003, 15(2): 533-543.
[13] GRAY W M, KEPINSKI S, ROUSE D, LEYSER O, ESTELLE M. Auxin regulates SCFTIR1-dependent degradation of Aux/IAA proteins., 2001, 414(6861): 271-276.
[14] 李艳林, 高志红, 宋娟, 王万许, 侍婷. 植物生长素响应因子ARF与生长发育. 植物生理学报, 2017, 53(10): 1842-1858.
Li Y L, Gao Z H, Song J, Wang W X, Shi T. Auxin response factor (ARF) and its functions in plant growth and development., 2017, 53(10): 1842-1858. (in Chinese)
[15] HENDELMAN A, BUXDORF K, STAV R, KRAVCHIK M, ARAZI T. Inhibition of lamina outgrowth followingAUXIN RESPONSE FACTOR 10 () derepression., 2012, 78(6): 561-576.
[16] LIU P P, MONTGOMERY T A, FAHLGREN N, KASSCHAU K D, NONOGAKI H, CARRINGTON J C. Repression ofby microRNA160 is critical for seed germination and post-germination stages., 2007, 52(1): 133-146.
[17] DE JONG M, WOLTERS-ARTS M, GARCIA-MARTINEZ J L, MARIANI C, VRIEZEN W H. TheAUXIN RESPONSE FACTOR 7 (SlARF7) mediates cross-talk between auxin and gibberellin signalling during tomato fruit set and development., 2011, 62(2): 617-626.
[18] FRIGERIO M, ALABADÍ D, PÉREZ-GÓMEZ J, GARCÍA- CÁRCEL L, PHILLIPS A L, HEDDEN P, BLÁZQUEZ M A. Transcriptional regulation of gibberellin metabolism genes by auxin signaling in., 2006, 142(2): 553-563.
[19] DORCEY E, URBEZ C, BLÁZQUEZ M A, CARBONELL J, PEREZ-AMADOR M A. Fertilization-dependent auxin response in ovules triggers fruit development through the modulation of gibberellin metabolism in., 2009, 58(2): 318-332.
[20] WANG C, WANG X C, KIBET N K, SONG C N, ZHANG C Q, LI X Y, HAN J, FANG J G. Deep sequencing of grape flower and berry short RNA libraries for the discovery of new microRNAs and verification of the precise sequence of grape microRNAs preserved in miRBase., 2011, 143(1): 64-81.
[21] ZHANG W Y, ABDELRAHMAN M, JIU S T, GUAN L, HAN J, ZHENG T, JIA H F, SONG C N, FANG J G, WANG C. VvmiR160s/, interaction and their spatio-temporal expression/cleavage products during GA-induced grape parthenocarpy., 2019, 19(1): 111.
[22] ABU-ZAHRA T R. Percentage of thompson seeds affected by GIBBERELLIC acid and cance GIRDLING., 2010, 42(3): 1755-1760.
[23] CHENG C X, XU X Z, SINGER S D, LI J, ZHANG H J, GAO M, WANG L, SONG J Y, WANG X P. Effect of GA3treatment on seed development and seed-related gene expression in grape., 2013, 8(11): e80044.
[24] SPANUDAKIS E, JACKSON S. The role of microRNAs in the control of flowering time., 2014, 65(2): 365-380.
[25] LUO Y, GUO Z H, LI L. Evolutionary conservation of microRNA regulatory programs in plant flower development., 2013, 380(2): 133-144.
[26] ACHARD P, HERR A, BAULCOMBE D C, HARBERD N P. Modulation of floral development by a gibberellin-regulated microRNA., 2004, 131(14): 3357-3365.
[27] 王文然, 王晨, 解振强, 贾海锋, 汤崴, 崔梦杰, 房经贵. VvmiR397a及其靶基因在葡萄果实发育中的作用分析. 园艺学报, 2018, 45(8): 1441-1455.
Wang W R, Wang C, Xie Z Q, Jia H F, Tang W, Cui M J, Fang J G.Function analysis of VvmiR397a and its target genein grape berry development., 2018, 45(8): 1441-1455. (in Chinese)
[28] CUI M J, WANG C, ZHANG W Y, PERVAIZ T, HAIDER M S, TANG W, FANG J G. Characterization of Vv-miR156:pairs involved in the modulation of grape berry development and ripening., 2018, 293(6): 1333-1354.
[29] YE K Y, CHEN Y, HU X W, GUO J C. Computational identification of microRNAs and their targets in apple., 2013, 35(3): 377-385.
[30] SONG C N, FANG J G, LI X Y, LIU H, CHAO C T. Identification and characterization of 27 conserved microRNAs in citrus., 2009, 230(4): 671-685.
[31] XU X B, YIN L L, YING Q C, SONG H M, XUE D W, LAI T F, XU M J, SHEN B, WANG H Z, SHI X Q. High-throughput sequencing and degradome analysis identify miRNAs and their targets involved in fruit senescence of., 2013, 8(8): e70959.
[32] HAN J, FANG J G, WANG C, YIN Y L, SUN X, LENG X P, SONG C N. Grapevine microRNAs responsive to exogenous gibberellin., 2014, 15(1): 111.
[33] WANG B J, WANG J, WANG C, SHEN W B, JIA H F, ZHU X D, LI X P. Study on modes of expression and cleavage role of miR156b/c/d and its target geneduring the whole growth stage of grapevine., 2016, 107(7): 626-634.
[34] WANG M, WU H J, FANG J, CHU C C, WANG X J. A long noncoding RNA involved in rice reproductive development by negatively regulating osa-miR160., 2017, 62(7): 470-475.
[35] NIU J, WANG J, AN J Y, LIU L L, LIN Z X, WANG R, WANG L B, MA C, SHI L L, LIN S Z. Integrated mRNA and miRNA transcriptome reveal a cross-talk between developing response and hormone signaling for the seed kernels of., 2016, 6: 35675.
[36] CUI J, SUN Z Y, LI J L, CHENG D Y, LUO C F, DAI C H. Characterization of miRNA160/164 and their targets expression of beet () seedlings under the salt tolerance., 2018, 36(5/6): 790-799.
[37] LIU X D, HUANG J, WANG Y, KHANNA K, XIE Z X, OWEN H A, ZHAO D Z. The role of, anloss-of-function mutation in, in organogenesis and the mechanism regulating its expression., 2010, 62(3): 416-428.
[38] DAMODHARAN S, ZHAO D Z, ARAZI T. A common miRNA160-based mechanism regulates ovary patterning, floral organ abscission and lamina outgrowth in tomato., 2016, 86(6): 458-471.
vvi-miR160s in MediatingResponse to Gibberellin Regulation of Grape Seed Development
Bai YunHe, Wang WenRan, Dong TianYu, Guan Le, Su ZiWen, Jia HaiFeng, Fang JingGui, Wang Chen
(College of Horticulture, Nanjing Agricultural University, Nanjing 210095)
【】This study was performed to investigate the roles and the modes responsive to gibberellin (GA) of the vvi-miR160 family and its target genes in the development of Wink grape seed. 【】 miR-RACE, RT-qPCR, bioinformatics and RLM-RACE were employed to identify vvi-miR160s and its target gene, and to analyze their modes responsive to GAof spatio-temporal expression and potential functions. 【】 GA treatment before flowering strongly inhibited the ovule and seed development of Wink grape and induced grape seedless berries with high efficiency, and the seedless rate of berries reached 99.8%. The precursor gene sequence (501 bp) and mature sequence of vvi-miR160s were cloned and identified, which were highly conserved across different plant species. The mature sequences of vvi-miR160s were used as queries to predict the target gene. The cleavage sites with 9/17 being their cleavage frequency of vvi-miR160s onwere detected between the 10th and 11th sites by RLM-RACE and PPM-RACE, which proved thatwas the true target gene of vvi-miR160s. VvARF18 encoded 683 amino acids, and a nuclear localization signal existed at positions 398-411, while the protein sub-cellular was localized on the nucleus. The homology of VvARF18 with other in other species was highly conserved. The VvARF18 protein was closely related to tea, tobacco, plum and other species. The number of elements and their order were the same across different species, and the genes structures were similar. Thepromoter contained four types of cis-elements, which possessed more hormone-related cis-elements. RT-qPCR analysis showed that vvi-miR160c/d/e showed a ‘V’-shaped expression trend with the development of grape berries, and the lowest expression levels were found during the stone-hardening stage.exhibited an opposite expression trend to the former, with the highest expression during stone-hardening stage, indicating that vvi-miR160c/d/e negatively regulates VvARF18, but there was no significant negative correlation between vvi-miR160a/b and VvARF18 expression levels. GA treatment significantly up-regulated the expression of vvi-miR160a/b in the development of grape hardcore seeds, and also conspicuously inhibited the expression ofunder GA treatments showed the typical negative correlation, indicating that GA treatment promoted the negative regulation of vvi-miR160a/b on; reversely, GA weakened the negative regulation of vvi-miR160c/d/e on.【】 Among the vvi-miR160 family, vvi-miR160c/d/e may mediated VvARF18 regulation of seed development during specific stages of grape seed development, whereas vvi-miR160a/b may mediated VvARF18, which might be mainly involved in the regulation of GA-induced grape seedless berry development.
grape; vvi-miR160s;; gibberellin (GA); seed development

10.3864/j.issn.0578-1752.2020.09.015
2019-09-05;
2019-12-25
江苏省自然科学基金项目(BK20181318)、国家重点研发计划项目(2018YFD1000106)、国家自然科学基金项目(31972373,31801809)
白云赫,E-mail:2017104028@njau.edu.cn。通信作者王晨,E-mail:wangchen@njau.edu.cn
(责任编辑 赵伶俐)
