大豆异黄酮对早期断奶仔猪生长性能、抗氧化功能及肠粘膜形态结构的影响
2020-06-03林厦菁陈芳蒋守群蒋宗勇
林厦菁, 陈芳, 蒋守群, 蒋宗勇
(广东省农业科学院动物科学研究所/畜禽育种国家重点实验室/农业农村部华南动物营养与饲料重点实验室/广东省畜禽育种与营养研究重点实验室,广州 510640)
0 引言
【研究意义】仔猪在正常生理状态下,体内活性氧的产生与清除处于动态平衡,当体内自由基稳衡态异常,自由基产生增多,机体清除自由基损伤的能力降低,使体内自由基进一步蓄积,导致生长抑制并可诱发疾病或者死亡[1]。目前集约化养猪生产中普遍采用的早期断奶技术易引起断奶仔猪产生氧化应激[2],而仔猪的生长性能和存活率是影响猪场经济效益的重要因素,如何降低仔猪断奶应激是提高养猪生产效率的关键。【前人研究进展】机体氧化应激会导致断奶仔猪肝脏抗氧化酶活性的降低和抑制羟自由基能力,降低空肠绒毛高度、增加隐窝深度,提高脾脏 MDA水平、减少淋巴细胞数量,影响养分的吸收与利用,降低机体免疫能力[3-4]。大豆异黄酮是存在于大豆中具有多酚结构的化合物,以3-苯并吡喃酮为基本母核,由于其侧链上具有活性羟基,能够有效清除自由基,抗氧化效果显著[5-6]。大豆异黄酮具有调控动物机体养分代谢,增强免疫力和提高生产性能等作用[7-9]。【本研究切入点】目前大豆异黄酮在猪上的研究关注点主要集中在生长性能、机体抗氧化方面,而大豆异黄酮对早期断奶仔猪肠道抗氧化作用的报道较少。【拟解决的关键问题】本试验通过在饲粮中添加不同水平大豆异黄酮,探讨其对早期断奶仔猪机体与肠道抗氧化性能的影响,为大豆异黄酮在早期断奶仔猪生产中的应用提供理论依据。
1 材料与方法
1.1 试验原料
大豆异黄酮由广东省农业科学院动物科学研究所研制开发,纯度为 98.5%。大豆浓缩蛋白购于广州菲傲生物科技有限公司,乳清粉购于 Glanbia公司,白鱼粉购于CFG公司。
1.2 试验动物分组与设计
试验选用160只胎次相近、体况良好的21日龄断奶的杜×(大×长)三元杂交仔猪(平均重为5.5 kg),采用单因子随机区组设计,根据体重和性别随机分成5个处理,每个处理4个重复,每重复8头仔猪(公母各半)。各处理组饲粮中分别添加 0(对照组)、10、20、40和80 mg·kg-1异黄酮。试验猪在同一猪舍内饲养,各处理组的饲养管理和环境条件一致。试验期为42d,试猪自由采食、饮水,饲料少量多次投喂,保持饲料的新鲜。饲养试验于2017年在广东省农业科学院动物科学研究所试验基地进行。
1.3 试验饲粮
试验基础饲粮营养水平参考NRC(1998)和中国《猪饲养标准》(2004版)仔猪的饲养标准。基础饲粮组成和营养水平见表1。
1.4 测定指标及方法
1.4.1 生长性能 试验开始、断奶7d及结束时,仔猪空腹16h称个体重,统计每重复耗料量,计算试验7及 42d仔猪平均日采食量(ADFI)、平均日增重(ADG)和料重比(F/G)。
1.4.2 抗氧化指标测定和方法 试验7d及结束时每重复选取体重接近的试验猪2只(公母各1只),前腔静脉采血,分离血清,分装于Ep管中,-20℃冻存;采血后屠宰取肝脏组织和空肠上段组织,-20℃冻存;使用南京建成生物工程有限公司试剂盒测定血清、肝脏和肠道组织超氧化物歧化酶(SOD)活性、谷胱甘肽过氧化物酶(GSH-Px)活性以及丙二醛(MDA)含量,肝脏组织金属硫蛋白(MT)含量采用镉饱和法测定[10]。
1.4.3 十二指肠粘膜形态结构电镜观察 试验猪屠宰后,小心截取十二指肠中段约1 cm,用冰冷的生理盐水冲洗干净,剪成长宽约为3 mm的正方形小块,以戊二醛溶液固定24 h后,用0.1 mol·L-1磷酸缓冲液(pH 7.35)漂洗3次,每次15min,然后用1%锇酸固定1 h,再次用0.1 mol·L-1磷酸缓冲液漂洗,用酒精梯度脱水(50%-70%-80%-90%-100%)两次。第二次脱水后加入无水硫酸铜。再用醋酸异戊酯过渡2次,每次15min,临界点干燥。装台,粘样,IB.5喷金,用电镜(XL30ESEM,日立,日本)扫描、拍照观察十二指肠粘膜形态结构。

表1 基础饲粮组成和营养水平Table 1 Composition and nutrient levels of the basal diet (as fed basis)
1.4.4 十二指肠粘膜形态结构光镜观察 试验猪屠宰后,小心截取十二指肠中段约1 cm,用冰冷的生理盐水冲洗干净,经甲醛固定、修整、水洗、脱水、浸蜡、包埋、切片、贴片、烤片,苏木素、伊红染色后,光镜(Nikon Eclipse E100,尼康公司,日本)拍照测量绒毛长度和隐窝深度,详细方法参照文献[11]。
1.4.5 外周血液 T淋巴细胞亚群参数及淋巴细胞转化率 试验猪前腔静脉采血,使用武汉博士德生物工程公司提供的即用型SABC免疫化染色试剂盒及方法(AEC显色试剂盒染色)测定血液中 T淋巴细胞CD4+、CD8+亚群比例,采用MTT法[12]测定淋巴细胞转化率(CX5型,Beckman仪器公司,美国)。
1.5 统计分析
所有数据采用SAS软件GLM进行统计分析,差异显著者进行DUNCAN多重比较,以P<0.05作为差异显著性判断标准,其中差异显著的指标再进行回归分析,得出回归方程,其中y为检测指标,x为大豆异黄酮添加水平。本试验中所有数据表示方式为:平均值±标准误(Means±S.E.)。
2 结果
2.1 大豆异黄酮对断奶仔猪生长性能的影响
由表2可见,添加大豆异黄酮未显著影响仔猪平均日增重(P>0.05),整个试验阶段添加大豆异黄酮40 mg·kg-1组平均日增重高于其它各组(15.45 %—32.59 %);断奶后8—42 d和整个试验期阶段,大豆异黄酮40 mg·kg-1组试猪平均日采食量显著高于空白对照组、10 mg·kg-1大豆异黄酮组和 20 mg·kg-1大豆异黄酮组(P<0.05),8—42 d 平均日采食量回归方程为:y= -0.1x2+1.57x+340.08(R² = 0.410P=0.590);0—42 d平均日采食量回归方程为:y= -0.008x2+1.235x+ 312.79(R² = 0.393P=0.607)。断奶后 8—42 d时,20 mg·kg-1大豆异黄酮组试验猪料重比显著低于空白对照组和80 mg·kg-1大豆异黄酮组(P<0.05),回归方程为:y= 0.0001x2- 0.007x+ 1.684(R² = 0.392P=0.608)。
2.2 大豆异黄酮对断奶仔猪血清及肝脏组织抗氧化性能的影响
由表3可见,添加大豆异黄酮对断奶7天仔猪血清MDA含量无显著影响(P>0.05)。肝脏中MDA含量随大豆异黄酮添加水平提高有降低的趋势,其中添加大豆异黄酮40和80 mg·kg-1组试验猪肝脏中的MDA含量显著低于空白对照组和10 mg·kg-1大豆异黄酮组,回归方程为:y= 0.001x2- 0.255x+ 31.32(R²= 0.955P=0.027),得到大豆异黄酮最适宜添加量为127.5mg·kg-1。添加大豆异黄酮 20mg·kg-1组仔猪血清SOD活性显著高于空白对照组、40mg·kg-1大豆异黄酮组和 80mg·kg-1大豆异黄酮组(P<0.05),回归方程为:y= -0.005x2+ 0.119x+ 61.47(R² = 0.665P=0.335)。饲粮中添加大豆异黄酮对仔猪血清GSH-Px 活性、肝脏中的SOD活性和MT含量无显著影响(P>0.05)。添加大豆异黄酮10 mg·kg-1组肝脏组织GSH-Px 活性显著高于对照组和 80 mg·kg-1大豆异黄酮组(P<0.05),回归方程为:y= -0.002x2+ 0.051x+ 65.14(R²= 0.493P=0.507)。

表2 大豆异黄酮对断奶仔猪生长性能的影响Table 2 Effects of dietary soy isoflavone supplementation on growth performance of early-weaned piglets
由表 4看出,添加大豆异黄酮添加对断奶 42d仔猪血清和肝脏组织的MDA含量没有显著影响(P>0.05),其中添加大豆异黄酮 20mg·kg-1组肝脏组织中MDA含量较空白对照组降低38.98%。添加大豆异黄酮 40mg·kg-1组血清 SOD活性显著高于空白对照组、10 mg·kg-1大豆异黄酮组和 80mg·kg-1大豆异黄酮组(P<0.05),回归方程为:y= -0.012x2+0.91x+ 69.42(R² = 0.964P=0.027),得到大豆异黄酮最适宜添加量为 37.92 mg·kg-1。添加大豆异黄酮 20 mg·kg-1组肝脏的GSH-Px活性显著高于空白对照组和80 mg·kg-1大豆异黄酮组(P<0.05),回归方程为:y= -0.006x2+0.415x+ 62.53(R² = 0.669P=0.331)。添加大豆异黄酮对断奶42d仔猪肝脏的MT含量没有显著影响(P>0.05)。
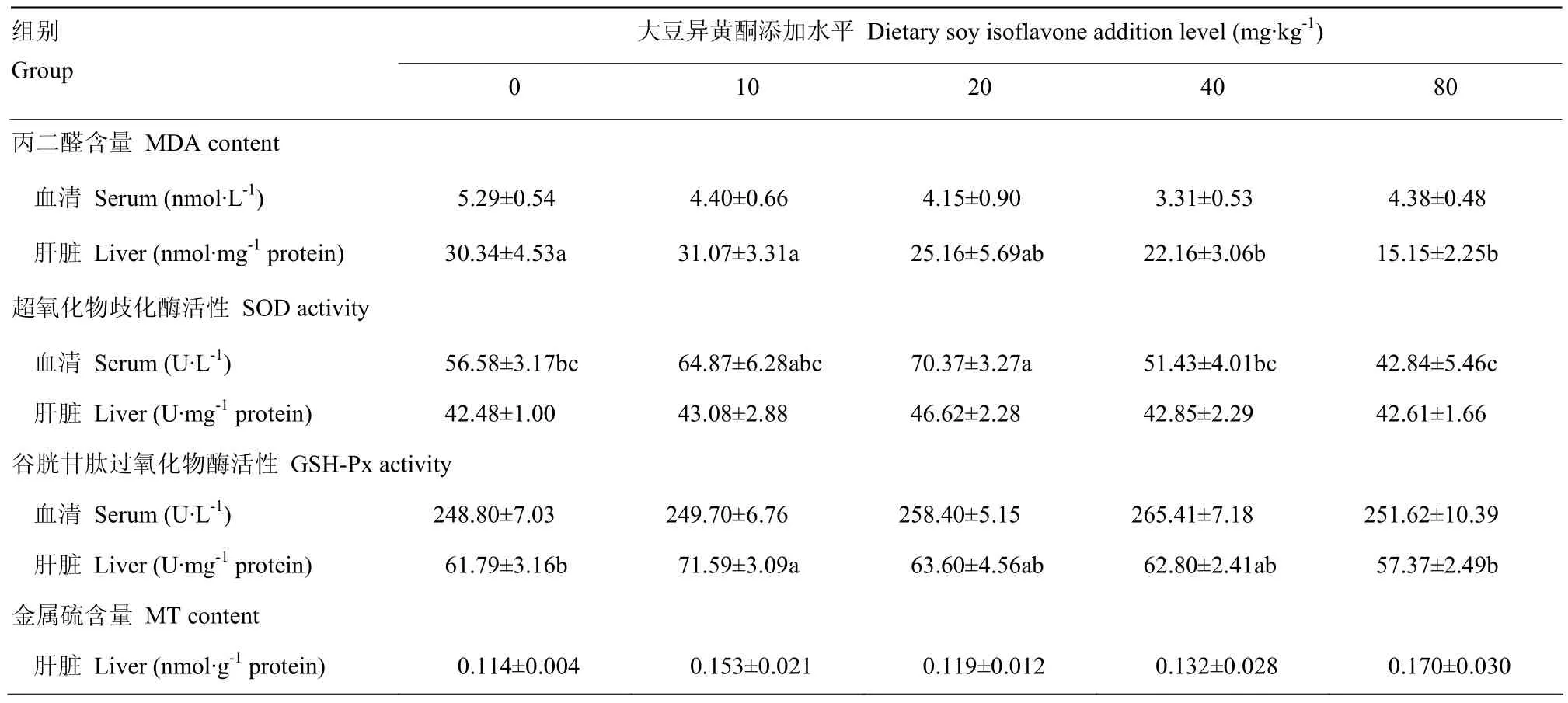
表3 大豆异黄酮对仔猪断奶后7d血清和肝脏抗氧化指标的影响Table 3 Effects of dietary soy isoflavone supplementation on antioxidative indices of early-weaned piglets on day 7 after weaning
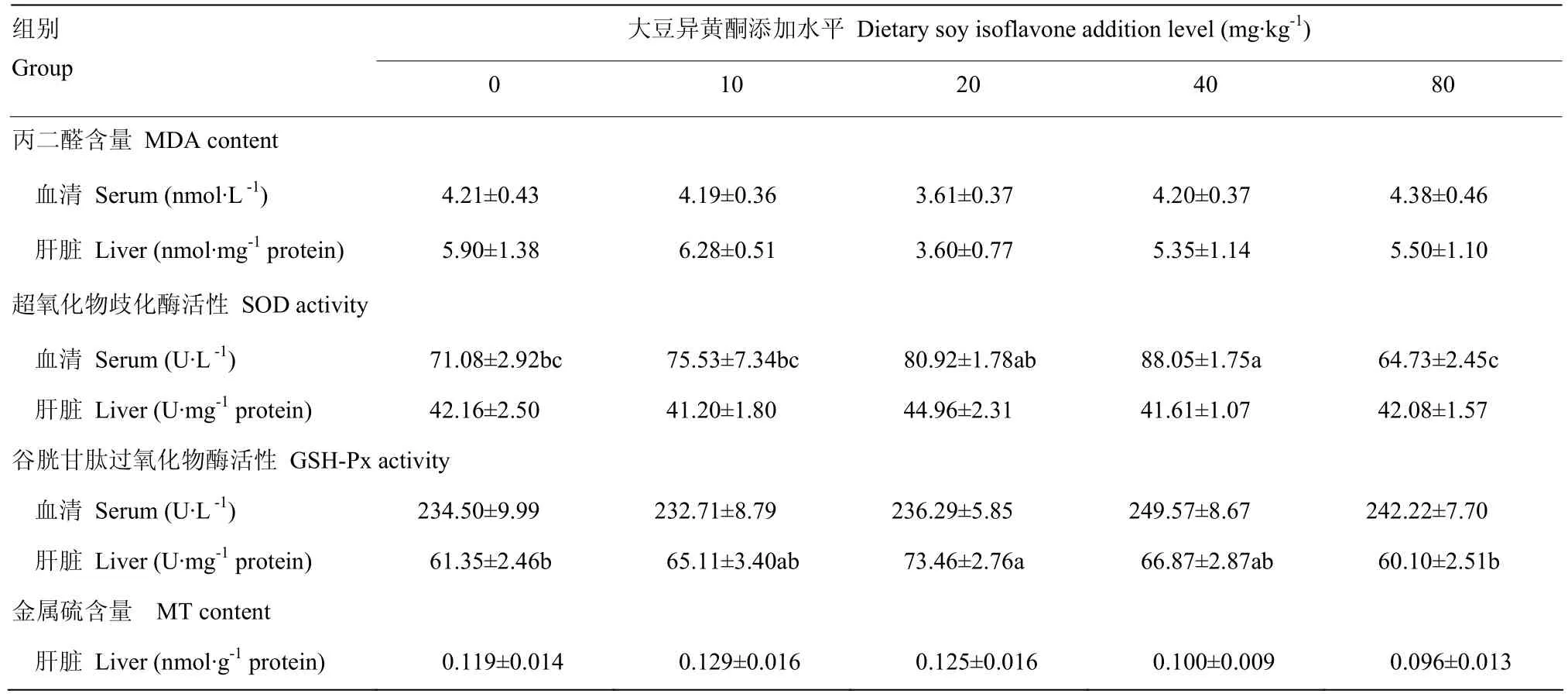
表4 大豆异黄酮对仔猪断奶后42d血清和肝脏抗氧化指标的影响Table 4 Effects of soy isoflavone on antioxidation parameters of weaned piglets on day 42 after weaning
2.3 大豆异黄酮对断奶仔猪空肠抗氧化性能的影响
由表5可知,在断奶后7d,饲粮添加大豆异黄酮对断奶仔猪空肠MDA含量、SOD活性、GSH-Px活性,MT含量无显著影响(P>0.05)。断奶后42d,添加大豆异黄酮40和80mg·kg-1组的空肠SOD活性显著高于对照组(P<0.05),回归方程为:y= -0.005x2+0.484x+ 40.66(R² = 0.860P=0.140)。添加大豆异黄酮40mg·kg-1组空肠的GSH-Px活性显著高于对照组和10mg·kg-1大豆异黄酮组(P<0.05),回归方程为:y= -0.007x2+0.635x+ 19.27(R² = 0.863P=0.137)。饲粮大豆异黄酮对空肠的MT含量有显著影响作用,其中添加大豆异黄酮10mg·kg-1组空肠的MT含量显著高于空白对照组(P<0.05),回归方程为:y= -0.002x2+0.139x+ 11.16(R² = 0.250P=0.750)。
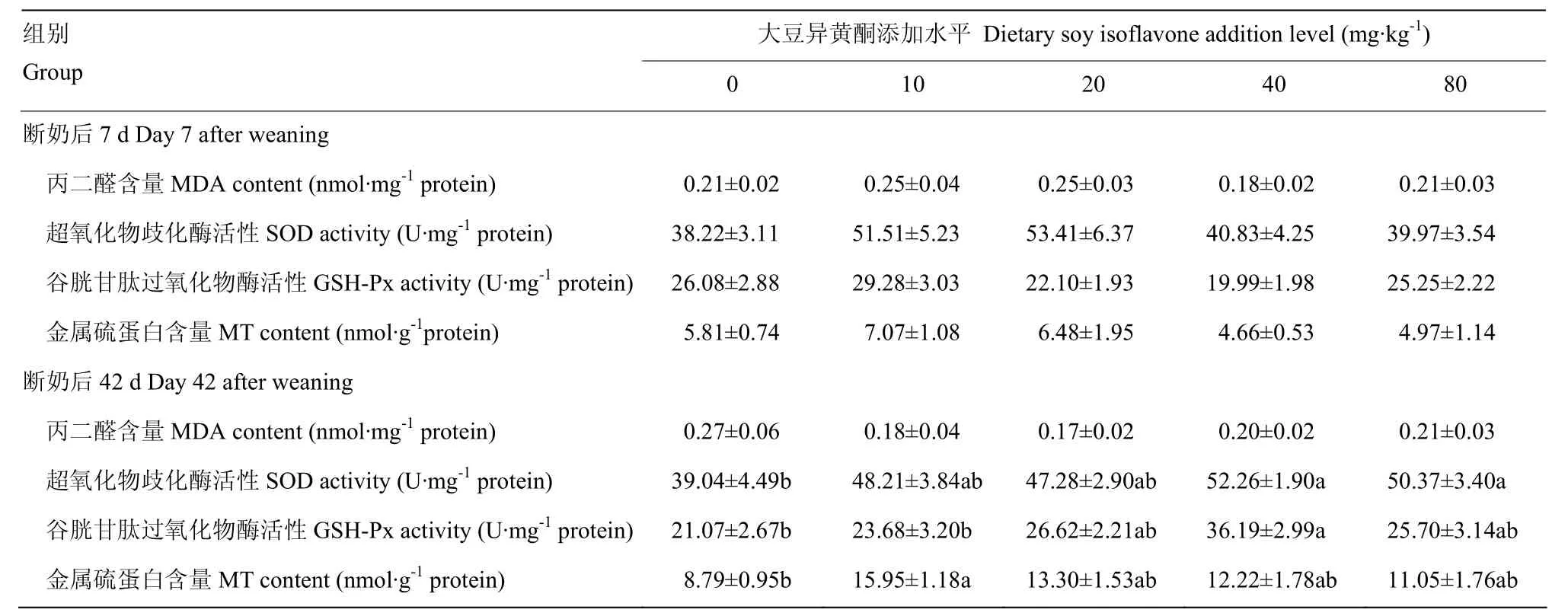
表5 大豆异黄酮对断奶仔猪小肠抗氧化指标变化的影响Table 5 Effects of soy isoflavone on small intestinal antioxidation indices of weaned piglets
2.4 大豆异黄酮对断奶仔猪十二指肠绒毛形态结构的影响
由图1可以看出,断奶后7、42d对照组仔猪十二指肠绒毛成舌状排列,绒毛顶端凹陷且脱落严重,各处理组与对照组相比,十二指肠绒毛损伤程度降低,其中添加大豆异黄酮 40mg·kg-1组仔猪十二指肠绒毛最完整,成柱状排列。
2.5 大豆异黄酮对断奶仔猪免疫指标的影响
由表6可见,添加大豆异黄酮对断奶仔猪7d血液中淋巴细胞转化率、CD4+、CD8+、CD4+/ CD8+无显著影响(P>0.05)。添加大豆异黄酮对断奶仔猪42d的血液中CD4+的水平有显著影响作用,对淋巴细胞转化率、CD8+、CD4+/ CD8+无显著影响(P>0.05),其中添加大豆异黄酮10、20 mg·kg-1组血液中CD4+水平显著低于空白对照组和 80mg·kg-1大豆异黄酮组(P<0.05),回归方程为:y= 0.002x2-0.128x+ 31.42(R² =0.288P=0.712)。
3 讨论
3.1 大豆异黄酮对断奶仔猪生长性能的影响
大豆异黄酮能与下丘脑、垂体中的雌二醇受体进行不同水平的结合,从而影响动物神经内分泌系统促进垂体生长激素的生成和释放以及刺激胰岛素样生长因子-1的增加[13-14]。也有研究表明,大豆异黄酮能够通过促进转录活性增加组织的蛋白质合成水平[15];在体外培养试验中发现大豆异黄酮能够促进离体小肠对葡萄糖的吸收和利用[16];大豆异黄酮还能够促进甲状腺分泌,使血中三碘甲状素原氨酸(T3)、甲状腺素(T4)水平明显升高,提高机体对营养物质的代谢和利用[17-18]。以上研究说明大豆异黄酮对于机体的生长性能具有促进作用。本试验结果显示,添加大豆异黄酮能够显著的提高断奶仔猪的采食量和饲料转化率,尤其是试验后期断奶7—42d的作用更加明显,说明大豆异黄酮调节动物机体的作用需要一定的时间,结合本试验肠道绒毛电镜的结果认为大豆异黄酮很有可能是通过保护肠道屏障的完整,促进营养物质的消化吸收而提高断奶仔猪的采食量和饲料转化率。CREINER等[19]分别在断奶仔猪饲粮中添加三羟基异黄酮和二羟基异黄酮(0、200、400、800 mg·kg-1),研究其对猪生长和病毒感染的影响,结果表明三羟基异黄酮与二羟基异黄酮都能减少病毒的复制,提高仔猪增重和饲料利用率。郭慧君等[20]给断奶去势仔猪饲喂5mg·kg-1大豆异黄酮,仔猪体重较空白对照组增加3.7%,饲料转化率提高33.81%。程忠刚等[21]报道仔猪日粮中添加20mg·kg-1大豆黄酮可以提高仔猪日增重,降低料重比。这些试验结果与本试验的相一致。综合分析本试验各阶段测定结果,认为断奶仔猪饲粮中添加40mg·kg-1大豆异黄酮最适宜。
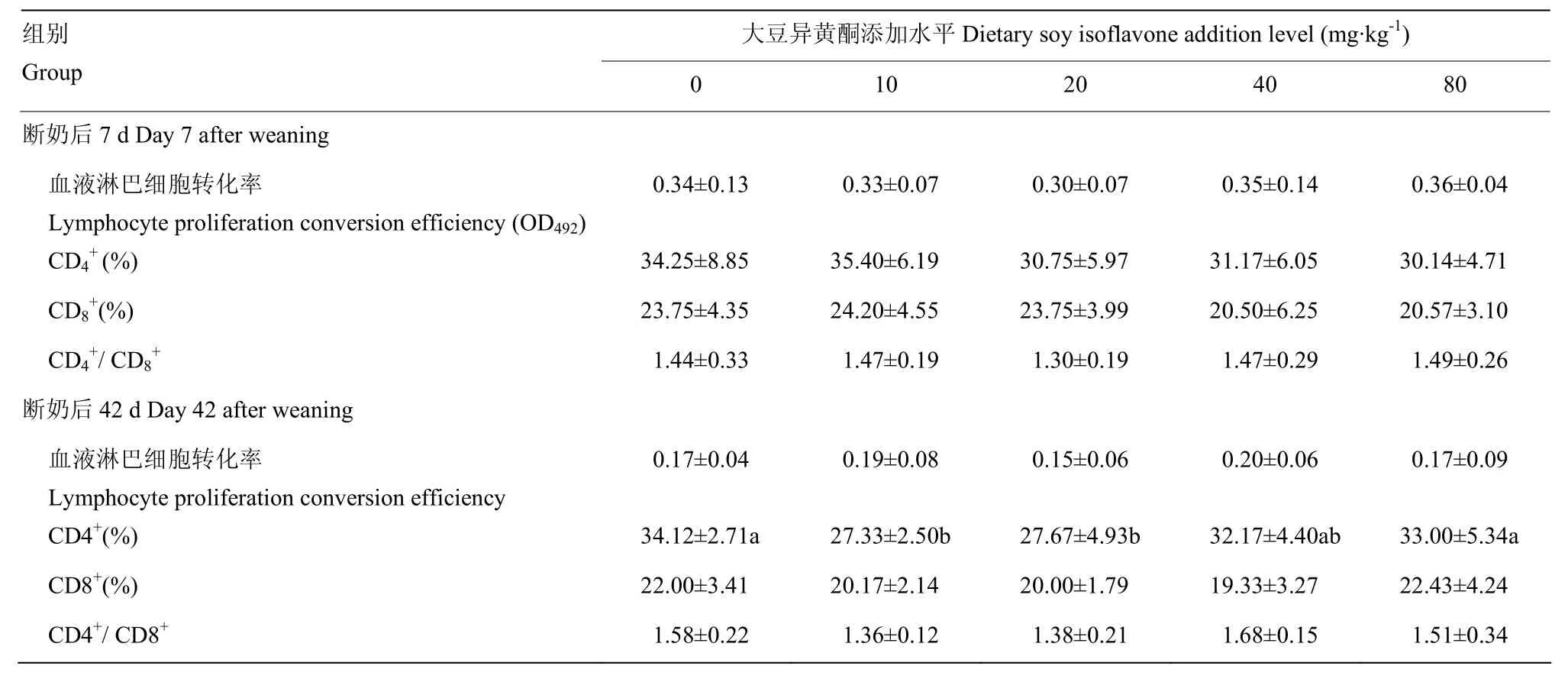
表6 大豆异黄酮对断奶仔猪免疫指标的影响Table 6 Effects of soy isoflavone on immunity index in weaned piglets
3.2 大豆异黄酮对断奶仔猪抗氧化性能的影响
断奶后营养源由母乳改为固体饲料,但是仔猪消化系统和免疫系统均发育不完善,易引起仔猪消化能力和抗逆能力差,再加之与母猪分离,诸多因素引起仔猪产生氧化应激[22]。组织和血清中MDA的含量增高反映了机体内脂质过氧化程度的增大,间接反映细胞受损的程度[23]。SOD是组织细胞内自由基清除体系中最重要的物质, SOD的活性反映了细胞内清除自由基即抗氧化的能力[24]。GSH-Px活性对于清除体内多余的自由基,恢复机体正常细胞代谢也同样具有重要作用[25]。本试验的研究结果显示,断奶仔猪饲粮中添加大豆异黄酮可以显著的降低肝脏中MDA含量,并且随着添加剂量的提高MDA含量水平逐渐降低。低水平(10—40 mg·kg-1)大豆异黄酮提高机体组织中SOD和GSH-Px活性,高水平(80 mg·kg-1)反而降低组织中SOD和GSH-Px活性,试验结果说明大豆异黄酮确实对缓解断奶仔猪应激有显著的作用,但是高水平的大豆异黄酮对机体抗氧化作用有负面影响,这个结果与肠道的电镜结果相呼应,高水平的大豆异黄酮会引起小肠绒毛的损伤,造成的原因需要进一步的研究。金属硫蛋白(MT)是与金属离子具有高度亲和性的低分子含量蛋白,具有解毒和调节体积抗氧化功能[26]。本试验数据显示,添加低水平的大豆异黄酮可以显著提高机体MT的含量,高水平大豆异黄酮反而没有明显提高作用,该结果与抗氧化酶(SOD、GDH-Px)结果一致。断奶后,肠道内环境发生各种变化:微生物、固体饲粮的刺激,使小肠吸收过程中产生大量的自由基破坏肠道细胞膜的完整性,致使肠绒毛萎缩破裂脱落,隐窝深度增大,吸收细胞减少而分泌细胞增多、营养吸收能力降低,肠道修复功能减弱,合成抗氧化酶能力减弱等[27-28]。本试验研究发现,断奶后7—42d,空白对照组试验猪十二指肠绒毛顶端凹陷萎缩、成舌叶状且出现破裂脱落,肠绒毛密度降低,而饲粮中添加 10—40mg·kg-1大豆异黄酮可以使十二指肠绒毛损伤得到缓解,呈手指状;同时可降低空肠组织 MDA含量,提高SOD、GSH-Px活性和MT含量。综合抗氧化生化检测结果和肠道绒毛电镜结果认为断奶仔猪饲粮中添加大豆异黄酮可以在机体发挥清除自由基的作用,同时增强抗氧化酶的活性、提高抗氧化蛋白MT的含量,保护肠道屏障不受到损伤,其中40 mg·kg-1大豆异黄酮的添加效果最好。
3.3 大豆异黄酮对断奶仔猪机体免疫性能的影响
根据T淋巴细胞表型和功能的不同可分为不同的亚群,只有表达CD4+和CD8+分子才表明T淋巴细胞进入成熟阶段,检测CD4+和CD8+淋巴细胞的百分率及二者的比值是评估机体的免疫状态的重要指标[29]。淋巴细胞转化率也是测定机体细胞免疫功能的主要方法之一[30]。本试验结果显示,添加大豆异黄酮对于淋巴细胞转化率、CD8+和CD4+和CD8+两者的比值没有显著的作用,还会降低血液中的CD4+含量。林映才等[31]报道大豆异黄酮提高了生长猪血液中T淋巴细胞CD4+/CD8+比值。张响英等[32]对公仔猪注射乳化后的大豆黄酮,结果胸腺、脾脏重量均有增加趋势。张汤杰等[33]试验显示,注射大豆黄酮可使公仔猪淋巴细胞增殖反应下降,机体的细胞免疫能力下降;而对母仔猪无影响,其认为植物雌激素对仔猪免疫功能的影响有性别上的差异。有研究报道大豆异黄酮提高动物免疫的机制主要可能是直接作用于免疫器官或者是免疫细胞上的雌激素受体,调节垂体生长激素或者催乳素的分泌从而间接促进免疫功能[34]。本试验设计为公母混养,可能由于机体雌激素水平不同,导致大豆异黄酮对机体的免疫性能作用不显著,具体原因有待进一步的分析研究。
3.4 大豆异黄酮在断奶仔猪饲粮中的适宜添加量
添加大豆异黄酮对断奶仔猪的平均日采食量、料重比和抗氧化生化指标有显著影响,通过回归分析得出回归方程式,其中只有断奶7d仔猪的血清MDA含量和42d血清中SOD活性这两个指标能够拟合出可信度比较高(R²>0.9,P<0.05)的方程,并得出最适宜添加量分别是127.5和39.72 mg·kg-1。结合本试验设计的添加水平和具体的试验结果,我们认为断奶仔猪大豆异黄酮最适宜添加量为40mg·kg-1。
4 结论
饲粮中添加大豆异黄酮可提高断奶仔猪的生长性能,增强血清、肝脏和肠道抗氧化水平,对肠道屏障有一定的保护作用。断奶仔猪大豆异黄酮适宜添加量为 40 mg·kg-1。
