白术内酯Ⅰ通过调低Cyclin D1/CDK4抑制胃癌细胞SGC-7901的增殖及机制
2020-06-02郭晨旭刘静波张明亮
郭晨旭,刘静波,谢 强,许 睿,张明亮,钱 军
胃癌是发病率及死亡率最高的消化系统恶性肿瘤之一,严重威胁着人们的健康。细胞周期蛋白D1(Cyclin D1)在细胞周期G1中、后期可与CDK4蛋白结合,激活并维持其活性,从而促进细胞周期的进行[1-2],在众多恶性肿瘤中都有Cyclin D1与CDK4蛋白的表达增加[3-4],并与肿瘤的恶性程度成正比。白术内酯Ⅰ为已知明确的菊科植物白术的有效成分[5],是经典的健脾益气方四君子汤的重要组成部分,有试验[6-7]证实白术内酯Ⅰ可抑制肿瘤细胞的增殖,但机制并不明确。胃癌是典型的中医脾虚类疾患,但白术内酯Ⅰ对胃癌作用的报道较少。课题组利用白术内酯Ⅰ干预胃癌SGC-7901细胞,观察其对细胞增殖、凋亡和细胞中Cyclin D1与CDK4蛋白的影响,同时检测其对细胞的周期分布的影响,探索白术内酯Ⅰ对SGC-7901细胞增殖影响的作用的可能机制,从而明确对胃癌的抗癌作用,为胃癌的综合治疗提供思路。
1 材料与方法
1.1 细胞及培养方法、主要试剂 SGC-7901细胞由江苏凯基生物技术股份有限公司提供,完全培养基为90% 1640+10%FBS,37 ℃、5%CO2条件培养。白术内酯Ⅰ标准品(购自meilunbio MB6520),MTT(购自Amresco 0793),DMSO(溶解Formazan结晶购自上海久亿化学试剂有限公司 20120322;溶解白术内酯Ⅰ购自SIGMA D2650),流式细胞仪(Becton-Dickinson FACS Calibur),Annexin V-FITC/PI细胞凋亡检测试剂盒(购自江苏凯基KGA105),细胞周期检测试剂盒(购自江苏凯基KGA511),CyclinD1蛋白(购自abcamab134175,1∶10 000稀释),CDK4(购自abcamab199728,1∶2 000稀释),全蛋白抽提试剂盒(购自江苏凯基 KGP250)。
1.2 试验方法
1.2.1 MTT细胞消化、计数 配制成浓度为5×104个/毫升的细胞悬液,96孔细胞培养板中,每孔加入100 μL细胞悬液后置于37 ℃、5%CO2培养箱中培养24 h;用完全培养基稀释药物至下述所需浓度,每孔加入100 μL白术内酯Ⅰ浓度分别为0、5、15、30、60、120 μmol/L的含药培养基,并以此浓度梯度分组,0 μmol/L为阴性对照组,往后分组及对照组同此;继续置于37 ℃、5% CO2培养箱中培养24、48、72 h,并以此为时间梯度分组;将96孔板进行MTT染色,波长490 nm处测定OD值(每孔加入20 μL 5 mg/mL MTT),继续培养4 h,弃去培养基,每孔加入150 μL DMSO溶解,摇床10 min混匀,波长490 nm处酶标仪读取OD值并计算抑制率;计算各组别增殖抑制率=(对照组OD490-实验组OD490)/对照组OD490×100%。
1.2.2 细胞凋亡检测 分组同1.2.1,不设置时间梯度,细胞消化计数后收集5×105个细胞;加入500 μL的Binding Buffer悬浮细胞;加入5 μL Annexin V-FITC混匀后,加入5 μL Propidium Iodide,混匀;室温避光反应5~15 min;流式细胞仪检测细胞凋亡的情况。
1.2.3 细胞周期检测 分组同1.2.1,同1.2.2收集5×105个细胞100 μL RNase A 37 ℃水浴30 min后加入400 μL PI染色混匀,4 ℃避光30 min;小流式细胞仪检测,记录激发波长488 nm处红色荧光。
1.2.4 Western blotting 分组同1.2.1,60 V转90 V电泳,稳流200 mA,120 min转膜,TBST洗膜。5%脱脂奶粉封闭液封闭,摇床振荡1.5~2 h后TBST洗膜。一抗4 ℃摇床振荡孵育过夜后室温振荡30 min,弃一抗,TBST洗膜。5%脱脂奶粉封闭液稀释二抗,室温摇床振荡反应1~2 h,TBST洗膜。ECL化学发光试剂盒配制工作液,滴于含有蛋白的膜正面,G:BOX chemiXR5成像,Gel-Pro32软件对结果进行灰度分析。
1.3 统计学方法 采用方差分析、Dunnett-t检验和q检验。
2 结果
2.1 MMT检测白术内酯Ⅰ抑制胃癌细胞SGC-7901的增殖 MTT结果显示,与对照组相比,白术内酯Ⅰ能够抑制细胞的增殖,且呈现时间与浓度的相关性,即随着时间的延长或浓度的增加,白术内酯Ⅰ对胃癌细胞SGC-7901的抑制作用越明显,差异有统计学意义(P<0.05~P<0.01),在120 μmol/L浓度白术内酯Ⅰ干预72 h时的最高细胞增殖抑制率达到了43.78%(见表1)。


浓度/(μmol/L)24 h OD490 增殖抑制率/% 48 h OD490 增殖抑制率/% 72 h OD490 增殖抑制率/% 02.803±0.025 — 2.751±0.005 — 2.767±0.008 — 52.798±0.0170.15 2.713±0.008△1.38 2.604±0.050*△5.88 152.696±0.040*3.81 2.577±0.034*△6.31 2.280±0.053**△17.57 302.630±0.029**6.15 2.328±0.035**△△15.38 2.055±0.036**△△25.71 602.491±0.052**11.12 2.079±0.058**△△24.44 1.845±0.022**△△33.30 1202.289±0.023**18.331.850±0.041**△△32.761.555±0.065**△△43.78F106.85 — 317.77 — 425.67 — P<0.01 — <0.01 — <0.01 — MS组内0.010 — 0.010 — 0.020 —
相同时间Dunnett-t检验:与对照组比较*P<0.05,**P<0.01;相同浓度Dunnett-t检验:与24 h比较△P<0.05,△△P<0.01
2.2 流式细胞仪检测白术内酯Ⅰ对胃癌细胞SGC-7901凋亡的影响 白术内酯Ⅰ浓度0、5、15、30、60、120 μmol/L干预后细胞的凋亡率分别为(3.36±0.23)%、(3.70±0.09)%、(4.43±0.95)%、(5.24±0.36)%、(6.88±0.69)%、(7.49±0.32)%,与对照组相比,流式细胞仪结果显示白术内酯Ⅰ能够促进胃癌细胞SGC-7910的凋亡,且凋亡率随着干预浓度的增高而升高,差异具有统计学意义(F=30.79,P<0.01,MS组内=0.279)(见图1)。
2.3 流式细胞仪检测白术内酯Ⅰ对胃癌细胞SGC-7901周期的影响 流式细胞仪细胞周期检测提示相比于对照组,经白术内酯Ⅰ干预后胃癌细胞SGC-7901中G1/S期细胞比例明显增高(P<0.01),而G2期细胞比例明显下降(P<0.01),且此种趋势随着干预浓度的增高而更加明显(P<0.05)(见表2、图2)。


干预浓度/(μmol/L)G1SG2051.34±0.84 30.32±0.72 18.34±0.12 555.02±1.01*29.32±0.5315.65±1.121557.07±0.60*△28.95±0.9713.98±1.50*3058.87±0.51*△#29.57±0.5711.56±0.57*△6066.21±1.02*△#☆27.19±0.89*△☆6.59±1.80*△#☆12070.15±0.89*△#☆▲22.97±0.62*△#☆▲6.88±1.50*△#☆F216.2140.4643.56P<0.01<0.01<0.01MS组内0.6960.5431.556
q检验:与对照组比较*P<0.05;与5 μmol/L组比较△P<0.05;与15 μmol/L组比较#P<0.05;与30 μmol/L组比较☆P<0.05;与60 μmol/L组比较▲P<0.05
2.4 Western blotting检测白术内酯Ⅰ对胃癌细胞SGC-7901中Cyclin D1与CDK4蛋白的改变 Western blotting检测不同浓度白术内酯Ⅰ干预胃癌细胞SGC-7901中Cyclin D1和CDK4蛋白的表达,与对照组相比,Cyclin D1及CDK4蛋白的表达均有被调低的现象(P<0.01),随着干预浓度的增加,相应蛋白的调低程度越明显(P<0.05)(见表3、图3)。

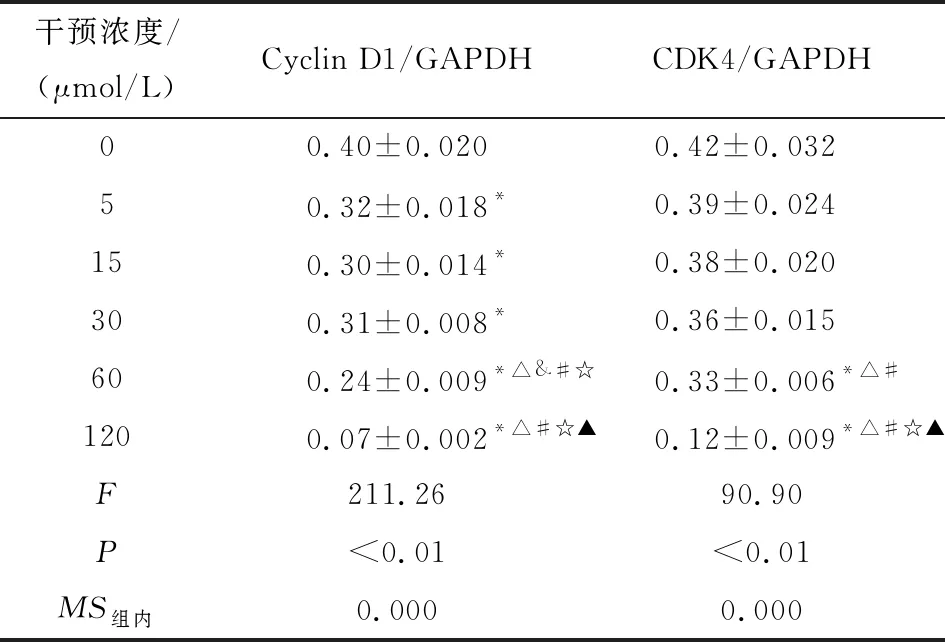
干预浓度/(μmol/L)Cyclin D1/GAPDHCDK4/GAPDH00.40±0.0200.42±0.032 50.32±0.018*0.39±0.024150.30±0.014*0.38±0.020300.31±0.008*0.36±0.015600.24±0.009*△&#☆0.33±0.006*△#1200.07±0.002*△#☆▲0.12±0.009*△#☆▲F211.2690.90P<0.01<0.01MS组内0.0000.000
q检验:与对照组比较*P<0.05;与5 μmol/L组比较△P<0.05;与15 μmol/L组比较#P<0.05;与30 μmol/L组比较☆P<0.05;与60 μmol/L组比较▲P<0.05
3 讨论
胃癌是最常见的消化道恶性肿瘤之一,除手术外,综合治疗在胃癌的治疗中占有非常重要的地位。近年来,祖国中医药对恶性肿瘤的治疗研究屡见不鲜,也着实看到了可喜的治疗效果。中药对胃癌的治疗历史悠久,而经典健脾益气重要四君子汤更是给胃癌的治疗提供了一些积极的作用,白术是其中的主要成分,用于补脾健胃、燥湿利水,已有研究证实其对一些恶性肿瘤[8]具有一定疗效,课题组也有前期实验对白术药物血清作用于胃癌细胞报道[9-11],证实了其可以抑制胃癌细胞SGC-7901的增殖,促进其凋亡。白术内酯Ⅰ是白术的有效成分之一,也有研究[6,12-13]证实了其能够抑制卵巢癌细胞、食管癌细胞等的增殖。本文从白术内酯Ⅰ为出发点,探讨其确为白术抗癌的有效成分,并初步阐述了其机制,具体如下述。
我们应用MTT证实了白术内酯Ⅰ能够明显抑制SGC-7901的增殖,并且抑制的程度与干预时间及干预浓度呈正比,虽没有达到IC50,这可能与中药有效成分作用力度较小相关,但这却从细胞层面证实了假设。进一步探讨其机制,首先细胞凋亡的诱导能从侧面反映细胞增殖数目下降的原因,流式细胞仪的结果验证了这一点,在白术内酯Ⅰ干预后细胞的凋亡比例明显增加,既然凋亡细胞比例增加,那么存在的可增殖细胞数目必然是一个下降的趋势。其次,流式细胞仪检测的细胞周期结果再一次解释了细胞增殖被抑制的原因,由于干预后G1期细胞所占比例上升,而G2期细胞所占比例下降,更多的细胞被阻滞在了G1期而无法进入到下一个阶段来完成细胞增殖,故而导致细胞增殖的抑制。最后,导致细胞周期改变的原因用Western blotting来初步判断,我们检测细胞周期关键蛋白Cyclin D1和CDK4,我们知道CyclinD1可在细胞周期G1中后期与CDK4结合后稳定其活性,从而完善细胞周期,促进细胞的增殖,而Western blotting结果显示Cyclin D1及CDK4蛋白在白术内酯Ⅰ的作用下明显调低,进而能够抑制细胞周期从G1进入下一阶段。
以上为本文初步证实了白术内酯Ⅰ抑制胃癌细胞的增殖及可能机制提供了实验室基础,并且以上结果存在着时间及干预药物剂量依赖性,干预时间越长、干预浓度越高,细胞增殖抑制越明显。因中医药在恶性肿瘤中的治疗一直处于辅助的位置,也有部分报道用于主要治疗手段,但仍存在争议,而白术及白术内酯Ⅰ对胃癌细胞SGC-7901的增殖抑制作用的研究证实了白术的有效抗癌作用,同时以有效成分白术内酯Ⅰ直接干预更是为往后白术(或四君子汤)乃至更多的中医药抗癌的治疗理念提供坚实的实验室数据和基础。
