硫化氢对糖尿病大鼠空间学习记忆和海马组织氧化应激的影响
2020-06-02刘小粉王元元马善峰
贾 强,李 焱,刘小粉,王元元,杨 锐,马善峰
糖尿病是以机体持续高血糖为主要特征的代谢性疾病[1]。长期的高血糖,会导致各种器官组织,特别是神经、肾、心血管等的慢性损害及功能障碍。糖尿病引起的认知功能障碍也是其慢性损害之一,主要表现为学习能力下降、记忆功能减退、空间定向困难等[2]。目前,关于糖尿病认知功能障碍的发病机制尚不清楚,糖代谢紊乱、氧化应激、炎症反应等均参与其中[3]。硫化氢(hydrogen sulfide,H2S)是新型气体信号分子,具有抗炎症、抗氧化等作用[4-6]。内源性H2S主要以L-半胱氨酸为底物,在胱硫醚-β-合成酶(cystathionine-β-synthetase,CBS)和胱硫醚-γ-裂解酶的催化作用下产生。其中CBS主要存在于神经系统,且在海马组织中高度表达[7]。研究证据[8]显示H2S在中枢神经系统中发挥着关键性的调节作用。硫氢化钠(sodium hydrosulfide,NaHS)常作为H2S的外源性供体。研究[9]发现,外源性H2S对糖尿病引起的抑郁症具有一定的抑制作用,但是对糖尿病大鼠认知障碍影响及作用机制尚不清楚。因此,本研究通过建立糖尿病大鼠模型,观察外源性H2S对糖尿病大鼠空间学习记忆的影响,并探讨其作用机制。
1 材料与方法
1.1 材料 雄性SD大鼠32只购于蚌埠医学院实验动物中心,体质量160~200 g,自由饮食、饮水。链脲佐菌素(steptozotocin,STZ)和NaHS购自Sigma公司;总抗氧化能力(total antioxidant capacity,T-AOC)、超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)、丙二醛(malondialdehyde,MDA)和二喹啉甲酸(bicinchoninic acid,BCA)试剂盒均购自南京建成生物工程研究所;RNA提取试剂TRIzol购自Invitrogen公司;逆转录试剂盒和实时荧光定量聚合酶链式反应(real time-quantitative polymerase chain reaction,RT-qPCR)试剂盒购自大连宝生物公司;核因子E2相关因子2 (nuclear factor erythroid 2-related factor 2,Nrf2)、血红素氧化酶1(heme oxygenase-1,HO-1)和β-actin的引物序列由上海生工生物工程股份有限公司合成,Nrf2引物序列:5′-TAG ATG ACC ATG AGT CGC TTG C-3′ (正向),5′-GCC AAA CTT GCT CCA TGT CC-3′(反向),扩增产物长度151 bp;HO-1引物序列:5′-GTG CAG AGA ATT CTG AGT TCA-3′(正向),5′-GCC GTA TAG ATA TGG TAC AAG-3′(反向),扩增产物长度100 bp;β-actin引物序列:5′-CGT AAA GAC CTC TAT GCC AAC A-3′(正向),5′-AGC CAC CAA TCC ACA CAG AG-3′(反向),扩增产物长度163 bp。
1.2 方法
1.2.1 动物分组及模型建立 所有大鼠适应性饲养1周后,进行水迷宫训练2次,选择认知能力正常的大鼠为实验大鼠,随机分为正常组和糖尿病组(STZ)。大鼠禁食12 h后,STZ组一次性腹腔注射STZ 55 mg/kg(溶于新鲜配制的pH 4.5的柠檬酸溶液中),正常组大鼠腹腔注射等体积柠檬酸溶液。3 d后,尾静脉采血测空腹血糖(fasting blood glucose,FBG),取FBG≥ 16.7 mmol/L为1型糖尿病模型。模型建立成功4周后,将STZ组大鼠随机分为糖尿病对照(STZ)组和STZ+NaHS(SH)组,正常组大鼠随机分为正常对照(CON)组和CON+NaHS(CH)组,每组均8只。SH组和CH组大鼠每天腹腔注射56 μmol/kg NaHS(溶于0.9%氯化钠溶液中,现配现用);CON组和STZ组大鼠每天腹腔注射等体积0.9%氯化钠溶液,共干预4周。每周监测大鼠FBG和体质量(body weight,BW)。
1.2.2 Morris水迷宫试验 从NaHS干预第4周的第3天上午9:00开始,进行水迷宫实验。训练时,先将大鼠放置在平台上适应30 s,然后以非平台象限为起始点,将大鼠头部朝向水池壁轻放入水中,摄像头连续记录90 s内找到平台的所需时间作为逃避潜伏期。若在90 s内大鼠仍未找到平台,则将其引导至平台上休息30 s后移出水池,将时间记为90 s。每天随机排序3个非平台象限,以每个非平台象限作为起始点,记录3次时间并计算平均值。连续训练5 d后,于第6天撤去平台。将大鼠从原先固定平台的对侧象限放入。摄像仪记录其在120 s内在水池中的路径,分析大鼠在正确象限停留时间和到达正确象限的潜伏期。
1.2.3 海马组织病理学检测 大鼠Morris水迷宫测试结束后半小时,将大鼠放入密闭容器内,充入异氟烷麻醉后,断头取全脑组织,用预冷的0.9%氯化钠溶液清洗,滤纸吸干水分。用直镊将两侧的大脑皮层拨开,暴露出双侧的海马组织,再将海马组织与大脑皮层及周围的脑组织分开(1~1.5 g),取左侧的海马组织,用4%多聚甲醛溶液固定,脱水、石蜡包埋后切片,进行HE染色。
1.2.4 试剂盒检测海马组织T-AOC、SOD、GSH-Px和MDA水平 取各组大鼠海马组织,加入9倍体积的0.9%氯化钠溶液,制备海马组织匀浆,离心后取上清,利用BCA蛋白定量试剂盒测定蛋白浓度,分别按相应试剂盒说明书方法检测T-AOC、SOD、GSH-Px和MDA水平。
1.2.5 RT-qPCR检测海马组织Nrf2和HO-1 mRNA水平 采用TRIzol试剂提取海马组织总RNA,逆转录成cDNA后,利用RT-qPCR试剂盒扩增Nrf2、HO-1和β-actin基因。扩增条件:95 ℃预变性3 min后,以95 ℃变性30 s,55 ℃ 30 s,72 ℃ 50 s,反应35个循环,最后72 ℃延伸8 min,以β-actin作为内参,按2-ΔΔCt计算相对表达量。
1.3 统计学方法 采用方差分析和q检验。
2 结果
2.1 各组大鼠FBG和BW水平比较 与CON组比较,STZ组和SH组大鼠FBG增加(P<0.01),BW降低(P<0.01)。与STZ组比较,SH组中FBG差异无统计学意义(P>0.05),BW增高(P<0.01)。CON组和CH组FBG和BW水平差异无统计学意义(P>0.05)(见表1)。

表1 各组大鼠FBG和BW水平比较
q检验:与CON组比较**P<0.01;与STZ组比较##P<0.01;与SH组比较△△P<0.01
2.2 大鼠Morris水迷宫行为学测试结果 与CON组大鼠比较,STZ组和SH组大鼠第3~5天的逃避潜伏期延长,且在第6天的空间探索实验中在正确象限停留时间减少,到达正确象限的潜伏期延长,差异均有统计学意义(P<0.01)。与STZ组比较,SH组大鼠第3~5天的逃避潜伏期缩短,且在第6天的空间探索实验中在正确象限停留时间延长,到达正确象限的潜伏期缩短,差异均有统计学意义(P<0.05~P<0.01)。CH组与CON组比较差异无统计学意义(P>0.05)(见表2)。
2.3 海马组织病理结构变化 CON组大鼠海马神经元细胞核呈圆形,大而规则,未见明显的核固缩或体积缩小。STZ组大鼠海马神经元中部分出现细胞核固缩、深染及空泡变性。与STZ组比较,SH组大鼠海马区的病变相对减轻,大鼠海马神经元形态较完整,固缩变性的神经元少见。CH组大鼠海马神经元细胞核呈圆形,未见明显的核固缩和空泡(见图1)。
2.4 海马组织T-AOC、SOD、GSH-Px和MDA水平比较 与CON组比较,CH组各项指标差异无统计学意义(P>0.05);STZ组海马组织中MDA含量升高,T-AOC、SOD和GSH-Px活性下降(P<0.01)。与STZ组比较,SH组中MDA含量降低,T-AOC、SOD和GSH-Px活性增高,差异均有统计学意义(P<0.05)(见表3)。
2.5 海马组织Nrf2和HO-1 mRNA表达水平测定 与CON组比较,STZ组Nrf2和HO-1 mRNA表达降低;与STZ组比较,SH组Nrf2和HO-1 mRNA表达增加,差异均有统计学意义(P<0.01)。CH组与CON组比较差异无统计学意义(P>0.05)(见表4)。
3 讨论
本研究通过一次性腹腔注射STZ诱导制备1型糖尿病大鼠模型,并利用Morris水迷宫对各组大鼠进行学习和空间记忆能力测试,结果显示,与CON组大鼠比较,STZ组大鼠FBG明显增加,其逃避潜伏期和到达正确象限的潜伏期明显延长,在正确象限停留时间显著减少。这表明持续高血糖会损伤大鼠的学习和空间记忆能力,出现明显的认知功能障碍。海马组织的HE染色结果显示,STZ组大鼠神经元细胞核固缩、空泡变性。因此进一步说明,糖尿病可引起海马组织病理结构异常,诱发认知功能障碍。
H2S是继一氧化氮和一氧化碳之后迄今观察到的第3种内源性气体信号分子,在神经系统发挥重要的生理调节作用。本研究结果显示,给予糖尿病大鼠外源性H2S干预后,虽然空腹血糖值无显著性差异,但大鼠BW减轻有所缓解,同时Morris水迷宫结果显示,与STZ组大鼠比较,逃避潜伏期和到达正确象限的潜伏期明显缩短,大鼠在正确象限停留时间明显延长,这提示外源性H2S具有改善糖尿病大鼠的学习和空间记忆能力。HE染色结果也进一步证实,H2S明显减轻糖尿病大鼠的海马组织病理改变。这些结果均证实,外源性H2S对糖尿病大鼠的认知功能障碍具有明显的改善作用。
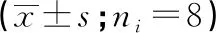
表2 各组大鼠Morris水迷宫行为学测试结果比较
q检验:与CON组比较**P<0.01;与STZ组比较#P<0.05,##P<0.01;与SH组比较△△P<0.01
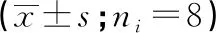
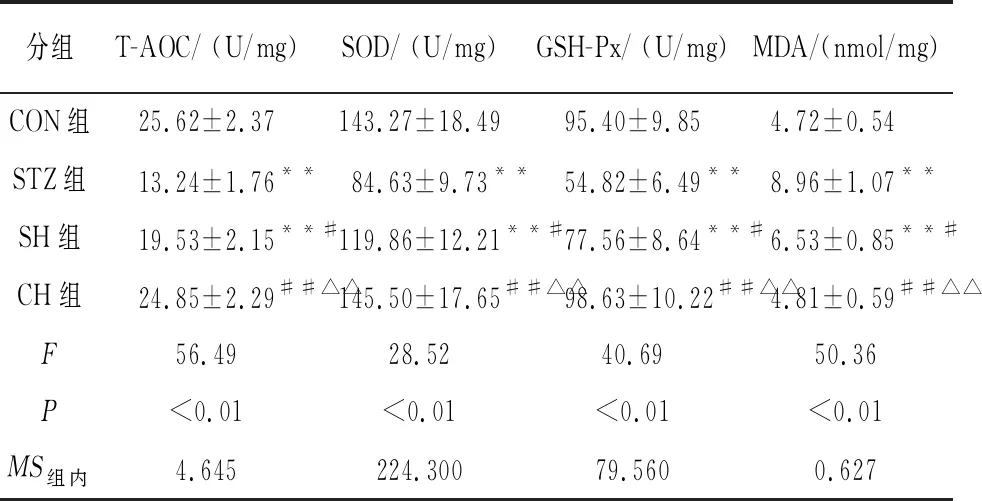
分组T-AOC/ (U/mg)SOD/ (U/mg)GSH-Px/ (U/mg)MDA/(nmol/mg)CON组25.62±2.37143.27±18.4995.40±9.854.72±0.54 STZ组13.24±1.76**84.63±9.73**54.82±6.49**8.96±1.07**SH组19.53±2.15**#119.86±12.21**#77.56±8.64**#6.53±0.85**#CH组24.85±2.29##△△145.50±17.65##△△98.63±10.22##△△4.81±0.59##△△F56.4928.5240.6950.36P<0.01<0.01<0.01<0.01MS组内4.645224.30079.5600.627
q检验:与CON组比较**P<0.01;与STZ组比较#P<0.05,##P<0.01;与SH组比较△△P<0.01
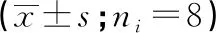
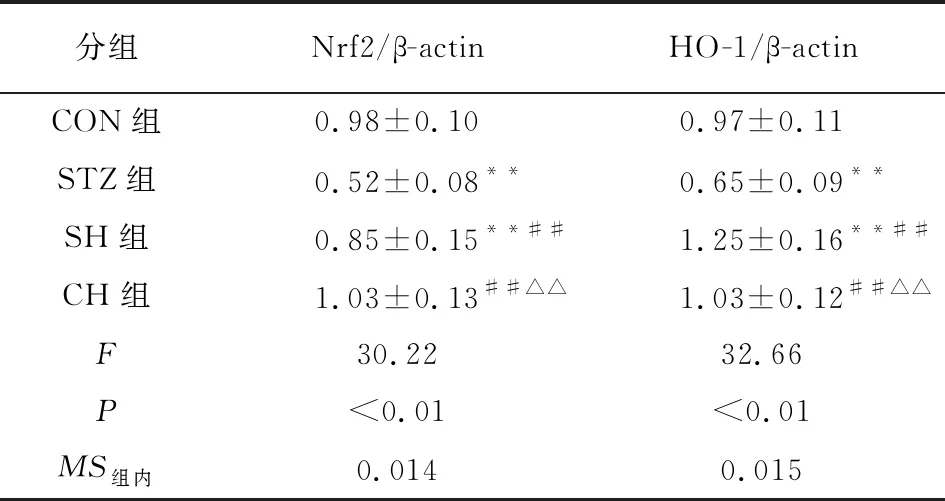
分组Nrf2/β-actinHO-1/β-actinCON组0.98±0.100.97±0.11STZ组0.52±0.08**0.65±0.09**SH组0.85±0.15**##1.25±0.16**##CH组1.03±0.13##△△1.03±0.12##△△F30.2232.66P<0.01<0.01MS组内0.0140.015
q检验:与CON组比较**P<0.01;与STZ组比较##P<0.01;与SH组比较△△P<0.01
氧化应激是糖尿病认知功能障碍的重要诱导因素[10]。当机体长期处于持续高血糖的状态下,会产生过量的活性氧簇,氧化应激损伤明显加重,进而引起海马组织结构异常,导致学习记忆功能障碍[11]。T-AOC反映组织的总抗氧化能力。SOD和GSH-Px是重要的抗氧化酶,其活性高低反映了组织抵抗氧化应激的能力。MDA是机体脂质过氧化反应的终产物,可以反映组织氧化损伤的程度。本实验结果显示,与CON组比较,STZ组大鼠海马组织中总抗氧化水平和抗氧化酶活性显著下降,MDA含量明显升高,证实糖尿病大鼠海马组织中存在氧化应激损伤。JIANG等[12]研究发现,外源性H2S可以增强创伤性脑损伤大鼠脑组织的抗氧化酶活性,减少氧化产物含量。本实验结果也显示,给予外源性H2S干预后,与STZ组相比,SH组中T-AOC水平、SOD和GSH-Px活性明显升高,MDA含量显著降低,提示外源性H2S可以通过增强抗氧化酶活性、减少脂质过氧化,抑制海马组织的氧化应激损伤。
Nrf2是细胞氧化还原稳态的主要调节因子。在生理条件下,Nrf2分布于细胞质内,当组织氧化应激增高时,Nrf2易位至细胞核,激活下游抗氧化基因HO-1的表达[13]。HO-1又称热休克蛋白32,机体各处均可见其表达,是一种受多种因素诱导的应激蛋白。在还原型辅酶Ⅱ和氧气同时存在的条件下,HO-1可催化血红素分解释放胆绿素,然后进一步降解为抗氧化活性更强的胆红素,可有效抑制脂质过氧化。因此,Nrf2/HO-1通路在体内发挥重要的抗氧化作用[14]。研究[15]表明,通过上调海马组织Nrf2/HO-1通路的表达可明显减轻因脑缺血引起的氧化应激损伤。此外,CHEN等[16]研究发现,外源性H2S可激活神经性疼痛大鼠脊髓中的Nrf2/HO-1通路,减轻大鼠的疼痛。本研究结果显示,与CON组比较,STZ组大鼠海马组织中Nrf2和HO-1表达明显降低,氧化应激损伤加重。外源性给予H2S干预后,与STZ组比较,SH组大鼠海马组织中Nrf2和HO-1表达明显升高,提示外源性H2S可通过上调海马组织Nrf2/HO-1通路,增强糖尿病大鼠海马组织抗氧化应激损伤的能力。
综上所述,外源性H2S可明显改善糖尿病大鼠的认知功能障碍,减轻海马组织的病理结构变化,其机制可能与抑制海马组织氧化应激损伤,上调Nrf2/HO-1通路表达相关。
