人参皂苷Rg1联合奈达铂通过Hedgehog通路抑制卵巢癌细胞OVCAR-3的增殖及机制探究
2020-06-02刘静波郭晨旭
刘静波,郭晨旭,马 玲
妇科肿瘤中卵巢癌的恶性程度较高,易复发转移,且发现时通常是晚期从而难治。目前卵巢癌在临床上因其首诊时通常病期较晚,通常需要新辅助化疗[1]后再评估手术机会,但在治疗上仍然缺少切实有效的靶点。
学者在果蝇中最早发现了Hedgehog通路[2],因其可致使果蝇的胚胎表面形成刺凸,外形酷似刺猬得名,在细胞增殖及分化中扮演着重要角色[3],其绝大多数时间处于静息状态,主要起修复及维持作用[4]。近年来的研究[5]认为该途径为一条促进恶性肿瘤发生发展的通路。
在卵巢癌的临床治疗中,奈达铂作为第二代铂类药物,因消化系统毒性及神经毒性均低于顺铂,从而被应用于临床[6]。同时在寻求中西医结合抗肿瘤的过程中,近些年祖国传统医学在抗肿瘤的治疗中发挥了重要的作用。人参皂苷Rg1主要存在于人参属药材中,被视作是人参的活性成分之一,也有研究者表明其具备明确的抗癌作用[7]。
本文基于奈达铂对卵巢癌的作用,同时联合人参皂苷Rg1作用于卵巢癌OVCAR-3细胞,检测对细胞增殖、周期以及Hedgehog通路蛋白的作用,进而探讨奈达铂通过该通路影响卵巢癌发生发展的机制以及人参皂苷Rg1对奈达铂作用是否具有协同增效作用。
1 材料与方法
1.1 实验材料及试剂 卵巢癌OVCAR-3细胞购自中国科学院武汉细胞库,奈达铂(H20050563)购自齐鲁制药公司,人参皂苷Rg1(MB6863)购自meilunbio公司,PTCH1抗体(17520-1-AP)购自武汉三鹰公司,SMO抗体(20787-1-AP)购自武汉三鹰公司,Gil1抗体(PB0142)购自博士德公司,GAPDH抗体(10493-1-AP)购自武汉三鹰公司,羊抗兔IgG-HRP(KGAA35)购自江苏凯基公司,OVCAR-3细胞完全培养基由江苏凯基生物技术股份有限公司提供(90% DMEM+10%FBS,37 ℃、5%CO2细胞培养箱培育),Cell Counting Kit-8(CCK-8)试剂盒(CP736)购自日本 DOJINDO Laborataries,全蛋白抽提试剂盒(KGP250)购自江苏凯基公司,BCA蛋白含量检测试剂盒(KGA902)购自江苏凯基公司,SDS-PAGE试剂盒(KGP113)购自江苏凯基公司,Western Blotting检测试剂盒(KGP1201)购自江苏凯基公司,显影定影试剂(KGP116)购自江苏凯基公司,细胞周期检测试剂盒(KGA511)购自江苏凯基公司。
1.2 实验方法
1.2.1 CCK-8 卵巢癌OVCAR-3细胞消化、计数、配制成浓度为5×104个/毫升的细胞悬液,每孔100 μL细胞悬液加入96孔板中;37 ℃,5%CO2培育24 h;实验组分别设置人参皂苷Rg1(G组)与奈达铂药物干预组(N组),使得利用完全培养基稀释的含药培养基至目的浓度,2组均选择100 μg/mL为最高浓度,向下依次设置浓度梯度,目的浓度分别为0、0.39、0.78、1.56、3.12、6.25、12.50、25.00、50.00、100.00 μg/mL,将0 μg/mL的培养基设置为空白对照组,第3组实验组为人参皂苷Rg1联合奈达铂干预组(G+N组),依据最大人参皂苷Rg1干预组实验结果确立无毒剂量(增殖抑制率<10%)控制人参皂苷Rg1的终浓度为6.25 μg/mL的培养基,分别再次调整联合奈达铂的培养基浓度分别为0、0.39、0.78、1.56、3.12、6.25、12.50、25.00、50.00、100.00 μg/mL。100 μL培养基加至实验每孔;37 ℃、5% CO2继续培育48 h后CCK-8染色,在波长450 nm处测定吸光度值;计数各组别增殖抑制率=(OD对照组-OD实验组)/OD对照组×100%,应用SPSS 19.0通过机率单位加权回归法计算半抑制浓度(IC50)。而后根据IC50值进行人参皂苷Rg1与奈达铂的联合药物组后续的细胞增殖、Western blotting与细胞周期实验。
细胞计数如上,设置无药物干预的细胞为空白对照组(Control组),依据奈达铂组IC50及人参皂苷Rg1组增殖抑制率<10%的最大无毒剂量,3组实验组分别设置为由含人参皂苷Rg1(6.25 μg/mL)、奈达铂(4.607 μg/mL)、人参皂苷Rg1(6.25 μg/mL)联合奈达铂(4.607 μg/mL),每孔100 μL加入96孔板,37 ℃、5%CO2条件下培育,于6、24、48、72、96、120、144、168 h时间点各选取5孔,分别CCK-8染色,继续培养3 h后波长450 nm处测定吸光度,绘制增殖曲线。
1.2.2 Western blotting 对照组及实验组分组同“1.3.1”,分别含人参皂苷Rg1(6.25 μg/mL)、奈达铂(4.607 μg/mL)、人参皂苷Rg1(6.25 μg/mL)联合奈达铂(4.607 μg/mL)的完全培养基干预培养48 h后的OVCAR-3细胞,干预后提取细胞样本全蛋白,BCA试剂盒进行蛋白定量后30 μg蛋白质行SDS-PAGE电泳、转膜。5%脱脂牛奶封闭2 h,加入兔抗人 PTCH1(1∶1 000)、SMO(1∶500)及 Gli1(1∶1 000)抗体,4 ℃孵育过夜,TBST洗膜。辣根过氧化酶标记的羊抗兔IgG(1∶5 000),常温孵育1h后TBST洗膜。ECL试剂盒发光显影,凝胶成像系统成像后灰度扫描。
1.2.3 细胞周期检测(PI单染法) 分组同“1.3.1”,药物干预后分别搜集不同组5×105细胞,后在细胞中加入100 μL RNase A 37 ℃水浴30 min后上400 μL PI染色,避光下4℃、30 min后上小流式细胞仪,分别记载激发波长488 nm 处的红色荧光。
1.3 统计学方法 采用方差分析和q检验。
2 结果
2.1 CCK-8法检测奈达铂联合人参皂苷Rg1对卵巢癌细胞OVCAR-3增殖的影响 4组在同浓度药物干预48 h后,与Contral组相比药物干预后的卵巢癌细胞OVCAR-3增殖能力明显有减弱,并且随着药物浓度的增加,增殖抑制作用越明显(P<0.01)。在最高浓度位置G(100 μg/mL)、N(100 μg/mL)、G(6.25 μg/mL)+N(100 μg/mL)组的增殖抑制率分别为16.50%、91.62%、95.70%;IC50分别为未达到、4.607 μg/mL、3.387 μg/mL(见表1)。
选取Control组(不含药完全培养基)、G组(6.25 μg/mL,依据增殖抑制率<10%的最大无毒剂量)、N组(4.607 μg/mL,依据IC50)、G(6.25 μg/mL)+N(4.607 μg/mL)组,CCK-8法绘制药物干预7d细胞增殖曲线,与对照组比较,各组药物干预后均有明显抑制细胞增殖的现象(P<0.05),且实验组间两两比较的差异在大多数时间点上有统计学意义(P<0.05)(见图1)。
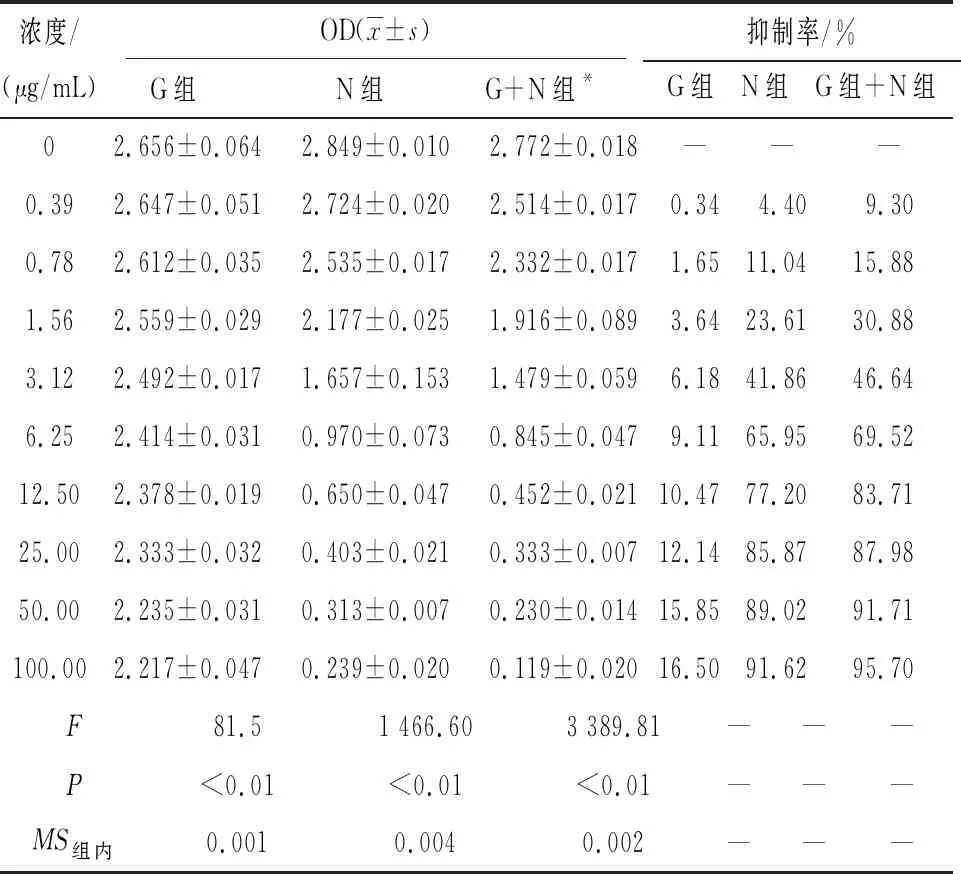
表1 不同浓度各组药物干预48 h后的细胞增殖能力(ni=5)
*:G+N组浓度为固定人参皂苷Rg1的终浓度为6.25 μg/mL,依次增加奈达铂药物浓度形成梯度
2.2 Western blotting检测奈达铂联合人参皂苷Rg1对OVCAR-3细胞中PTCH1、SMO、Gli1蛋白表达的影响 依据“2.1”实验结果,设定分组为对照组及实验组同“2.1”。PTCH1、SMO、Gli1蛋白表达(相对表达量,目的蛋白/内参)在经过G组、N组、G+N组干预后相比较对照组均有明显调低(P<0.05),趋势按次序依次降低(P<0.05)(见表2、图2)。

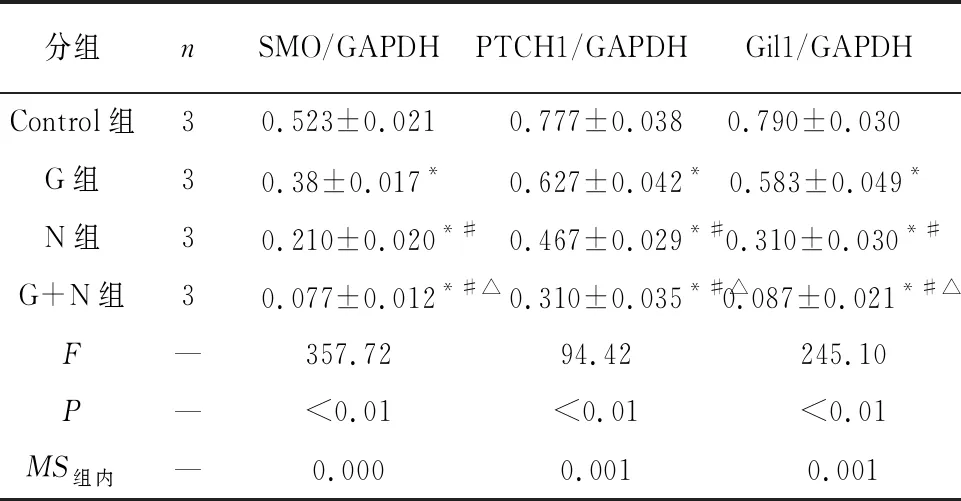
分组nSMO/GAPDHPTCH1/GAPDH Gil1/GAPDH Control组30.523±0.0210.777±0.0380.790±0.030 G组30.38±0.017*0.627±0.042*0.583±0.049* N组30.210±0.020*#0.467±0.029*#0.310±0.030*# G+N组30.077±0.012*#△0.310±0.035*#△0.087±0.021*#△F—357.7294.42245.10P—<0.01<0.01<0.01MS组内—0.0000.0010.001
注:与Control组比较*P<0.05;与G组比较#P<0.05;与N组比较△P<0.05
2.3 流式细胞仪检测奈达铂联合人参皂苷Rg1干预后卵巢癌细胞周期的变化 分组同“2.1”,不同分组药物干预后,组内比较药物干预后的细胞周期变化显示,在3组实验组中的表现均为G1、S、G2期细胞所占比例呈逐期下降趋势(P<0.01);组间比较显示,与Control组相比,G+N组中G2期细胞比例差异明显低于其他组(P<0.05)(见表3、图3)。
3 讨论
有研究发现Hedgehog通路在一些恶性肿瘤如乳腺癌[8]、基底细胞癌[9]、卵巢癌[10]中有过表达,意味着其在恶性肿瘤的发生发展中可能发挥了诱导肿瘤细胞过度增殖的作用[11]。经典Hedgehog通路由Sonic Hedgehog配体、Indian Hedgehog配体、Desert Hedgehog配体、12次跨膜蛋白PTCH1和PTCH2、Smoothened蛋白、核转录因子GLI蛋白(Gli1、Gil2、Gil3)构成。配体与PTCH的联结可解除其对SMO的抑活作用,从而SMO获得位移至纤毛,进而改变自身的构象及磷酸化。而后促使GLI入细胞核启动Gli1、PTCH1等激活Hedgehog,促使细胞的增殖[12]。在治疗卵巢癌的过程中,奈达铂的抗肿瘤作用明确,但铂类药物在卵巢癌的治疗中近年来确实没有实质性的进展。一些文献报道了抗肿瘤中药在基础研究以及临床中的应用,在此之中,人参(人参皂苷Rg1)作为健脾益气扶正的经典药物常用于抗肿瘤的辅助治疗及相关研究当中。故先应用人参皂苷Rg1作用于卵巢癌细胞,确定抗卵巢癌作用明确后应用奈达铂及与人参皂苷Rg1联合作用于卵巢癌细胞,观察对细胞增殖的影响,同时为寻求其可能机制检测干预前后细胞中Hedgehog通路的改变及细胞周期的变化,这或许能为卵巢癌的治疗提供一些新的思路。
表3 不同分组药物干预后OVCAR-3细胞周期比例
注:与Control组比较*P<0.05;与G组比较#P<0.05;与N组比较△P<0.05
课题组意图从细胞学及分子生物学角度阐述奈达铂及奈达铂联合人参皂苷Rg1对卵巢癌细胞作用的生物学机制。先利用CCK-8检测了药物干预后对细胞增殖的影响,首先不论是单用奈达铂还是联合人参皂苷Rg1均可抑制OVCAR-3细胞的增殖,再次证实了人参皂苷Rg1的抗肿瘤作用,并且在两者联合应用后可以表现出对细胞增殖抑制的增效作用。与此同时,确立了奈达铂单独作用及人参皂苷Rg1联合奈达铂(人参皂苷Rg1浓度恒定下)作用于细胞的奈达铂的IC50,发现了联合作用的IC50要低于单药作用,故联合用药可以提升奈达铂的抗肿瘤增殖作用。
因人参皂苷Rg1独立作用于细胞增殖的抑制作用较弱,进而在常规剂量中未达到IC50。以此为基础,选择奈达铂的IC50(4.607 μg/mL)为后续实验的奈达铂浓度,进而在保证安全剂量的同时为证实人参皂苷Rg1对奈达铂抗肿瘤的协同增效性,选择人参皂苷Rg1作用细胞的增殖抑制率<10%的最大无毒剂量即6.25 μg/mL后为后续实验的人参皂苷Rg1的浓度。之后进一步从分子层面检测了药物干预后Hedgehog通路相关蛋白PTCH1、SMO、Gli1在OVCAR-3细胞中表达的变化,结果显示在实验组药物干预后的3种蛋白均有被调低表达的情况,与此同时人参皂苷Rg1仍然表现了对奈达铂作用的协同效果。结合前期实验与相关学者研究,已证实PTCH1、SMO、Gli1的增高可以明显促进细胞的恶性增殖。故认为奈达铂与人参皂苷Rg1可能通过调低这三种Hedgehog通路关键蛋白抑制了细胞的增殖。了解到了增殖抑制可能的分子机制,从而继续探讨是否在药物抑制细胞增殖过程中的细胞周期的分布发生了变化,结果流式细胞仪检测到药物干预后的OVCAR-3细胞周期中G1所占比例明显增高,而同时G2比例有所下降,并且我们仅在人参皂苷Rg1联合奈达铂组得出差异的明显性,这也进一步验证了人参皂苷Rg1与奈达铂的协同作用甚至可以起到关键性作用。
结合以上进而我们推出结论,奈达铂可能通过Hedgehog通路关键蛋白PTCH1、SMO、Gli1的调低作用,改变了细胞周期的分布,使多数细胞阻断在细胞周期G1,从而抑制卵巢癌细胞的增殖。与此同时,人参皂苷Rg1在实验中显现了与奈达铂作用于细胞的协同增效作用,其可能在细胞周期的改变中起到关键作用。
以本实验为基础我们展望,对于卵巢癌尤其是晚期卵巢癌的综合治疗中,增加抗Hedgehog通路的理论靶向治疗可能会为卵巢癌病人带来新的治疗思路和希望。
