接种植物乳杆菌和蔗糖添加量对发酵香肠品质特性的影响
2020-06-01郭玲玲
郭玲玲


摘 要:研究接种植物乳杆菌6003和蔗糖添加量(0.4%和1.5%)对发酵香肠品质的影响。结果表明:接种植物乳杆菌6003,可加速发酵过程中pH值的降低;发酵香肠的硫代巴比妥酸反应物(thiobarbituric acid reactive substances,TBARs)值和总挥发性盐基氮(total volatile basic nitrogen,TVB-N)含量显著降低(P<0.05);发酵香肠菌落总数和乳酸菌数在发酵过程中迅速增加(P<0.05),在贮藏期间显著减少后趋于平稳,且菌落总数和乳酸菌数显著高于自然发酵香肠(P<0.05);此外,接种后的发酵香肠具有更高的硬度及总体可接受度评分,颜色无显著变化。发酵后,随着贮藏时间的延长,各组发酵香肠的pH值和可滴定酸度无显著变化,黏聚性、亮度值、红度值和水分活度显著降低,黄度值、TBARs值、TVB-N含量、硬度、咀嚼度和胶着度显著升高;不同添加量蔗糖对发酵香肠相关参数的影响较小。因此,选择蔗糖添加量0.4%和植物乳杆菌6003接种量7 (lg(CFU/g))的方法生产发酵香肠较为适宜。
关键词:发酵香肠;乳酸菌;植物乳杆菌6003;蔗糖
Abstract: The effects of Lactobacillus plantarum 6003 inoculation and sucrose addition (0.4% and 1.5%) on the quality of fermented sausages were studied. The results showed that this strain could accelerate the decrease of pH value during fermentation. The thiobarbituric acid reactive substances (TBARs) value and total volatile basic nitrogen (TVB-N) content were significantly reduced in the inoculated samples (P < 0.05). Total bacterial and lactic acid bacteria counts increased rapidly during the fermentation process (P < 0.05), and decreased significantly from the 4th to the 14th day of storage and then tended to be stable. The total bacterial and lactic acid bacterial counts of the inoculated samples were significantly higher than those of the naturally fermented samples (P < 0.05). The inoculated samples had higher hardness values and better overall acceptability scores, but showed no difference in color. In addition, with the increase in storage time, the pH value and acidity of each group of sausages did not change, whereas the cohesiveness, brightness value, redness value and water activity decreased significantly. The yellowness value, TBARs value, TVB-N content, hardness, chewiness and stickiness were significantly increased. There were only small effects of different sucrose levels on the investigated parameters. Therefore, addition of 0.4% sucrose and inoculation with 7 (lg (CFU/g)) of Lactobacillus plantarum 6003 were used to produce fermented sausages.
Keywords: fermented sausage; lactic acid bacteria; Lactobacillus plantarum 6003; sucrose
DOI:10.7506/rlyj1001-8123-20200106-001
中圖分类号:TS251.65 文献标志码:A 文章编号:1001-8123(2020)03-0020-07
发酵香肠也被称为生香肠[1],传统发酵香肠制作方法是将猪肉末、脂肪、盐、糖、胡椒粉和酱油等主要原料充分混合后塞入动物肠衣中,并在约(30±5) ℃条件下自然发酵成熟2~4 d[2-4]。但自然发酵过程中自发产生的部分菌群通常会导致产品品质不一致或不安全[5],即自然发酵的微生物区系可能由有助于发酵风味和产品质地的有益微生物组成,但也可能包括一些腐败或致病微生物[6]。
当前,大型工业生产系统生产的产品多在受控条件下生产,以保证产品的一致性,这些受控条件包括温度、湿度及发酵剂的应用。在肉类发酵中用作发酵剂的微生物通常由一组乳酸菌组成,例如植物乳杆菌、米酒乳杆菌、弯曲乳杆菌和戊糖乳杆菌[7]。肉类发酵过程中的微生物、理化和感官品质变化与乳酸菌活性有关。Sriphochanart等[8]总结发酵香肠发酵过程中的相关变化,包括产生有机酸、pH值降低、肌原纤维和肌浆蛋白水解增加、颜色和发酵风味的产生以及腐败和致病微生物的减少。Consuelo[9]、Spaziani[10]等指出,发酵香肠发酵过程中的结构变化可能是由于肌原纤维蛋白聚集和凝胶形成,而脱水是影响发酵后样品质地的主要因素。碳水化合物经常被用作微生物发酵中必需的碳源和能源,從而通过乳酸的积累降低pH值。Consuelo等[11]指出,高代谢性糖(如蔗糖和葡萄糖)的发酵比低代谢性糖(如糊精)的发酵酸化更快,这可能是由于它们具有通过细菌细胞壁转运的能力。
自然发酵香肠通常是小规模生产,相关报道主要集中在最佳发酵条件和感官品质研究[12]。还有一部分研究发现,使用植物乳杆菌作为香肠发酵剂会产生一些独特的特性,例如较强的蛋白水解能力、较低的pH值以及对香肠风味形成的影响[13]。此外,接种植物乳杆菌已被证明是减少发酵肉制品中生物胺及细菌素形成的方法[14-15]。植物乳杆菌和其他细菌作为外部发酵剂,可以改善泰国伊桑香肠的发酵过程[8]。本研究探究蔗糖添加量(0.4%和1.5%)和接种植物乳杆菌对发酵香肠品质特性的影响。
1 材料与方法
1.1 材料与试剂
猪瘦肉、猪背膘、大蒜粉、食盐、白胡椒粉、谷氨酸钠 当地超市。
植物乳杆菌6003 中国轻工业发酵研究所;MRS培养基 美国Merck公司。
1.2 仪器与设备
SCR20B高速离心机 日本Himac公司;MEW713绞肉机、KK500灌肠机 德国Frey公司;LHS-150SC恒温恒湿培养箱 上海一恒科学仪器有限公司;205 pH计 德国Testo公司;LabTouch水分活度仪 瑞士Novasina公司;NR-300色差计 日本Nippon Denshoku公司;微量移液器 德国Sartorius公司;U3210紫外分光光度计 日本Hitachi公司;Stomacher 80无菌均质机 英国Seward公司;A20厌氧罐培养系统 美国GeneScience公司;TA-XT2i Plus质构仪 英国Smsta公司;JB-CJ-1500FX无菌操作台 苏州佳宝净化工程设备有限公司。
1.3 方法
1.3.1 发酵剂和发酵香肠的制备
发酵剂培养:将植物乳杆菌6003在MRS肉汤中传代培养,通过在MRS琼脂平板上连续划线培养进行纯化;挑选单个菌落转移至MRS肉汤中,并在30 ℃条件下厌氧培养;温育48 h后,将菌悬液在4 ℃条件下10 000×g离心10 min,用无菌生理盐水(0.85 g/100 mL NaCl)洗涤并重悬;使用分光光度计调节OD600 nm使菌悬液中的细菌细胞数为7 (lg(CFU/mL))。
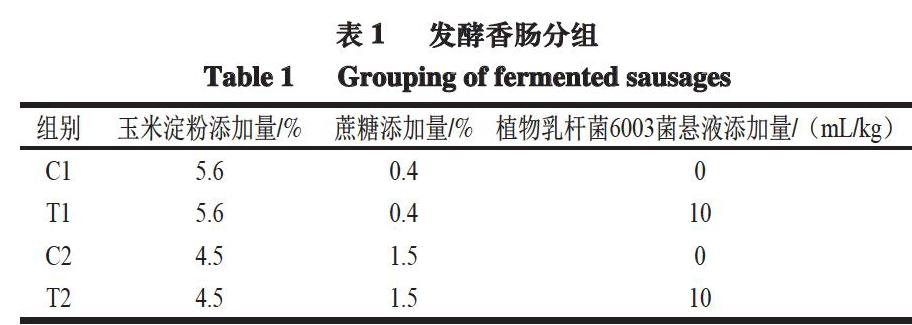
发酵香肠的制备:将猪瘦肉和猪背膘通过10 mm孔径的绞肉机搅碎,设计制备4 组发酵香肠样品(表1)。各组基础配方:猪瘦肉(60%,质量分数,下同)、猪背膘(28%)、大蒜粉(3%)、食盐(2%)、白胡椒粉(0.6%)、谷氨酸钠(0.4%)和亚硝酸钠(0.012%)。肉馅充分搅拌10 min后灌入直径2.8 cm、长度20 cm的胶原蛋白肠衣中,每组5 根,置于32 ℃和相对湿度75%的恒温恒湿培养箱中发酵4 d,取出后在4 ℃下贮藏24 d,共28 d。在灌肠后第0(发酵前)、2(发酵期间)、4(发酵结束)、7、14、21、28天(贮藏期)取样测定。
1.3.2 pH值测定
用pH计配备的肉类专用穿刺电极直接插入肠体测定。
1.3.3 可滴定酸度测定
以酚酞作为指示剂,用0.1 mol/L NaOH滴定乳酸测定可滴定酸度[5]。
1.3.4 水分活度(water activity,aw)测定
使用水活度分析仪测定。
1.3.5 颜色测定
使用色差计测定香肠切片亮度值(L*)、红度值(a*)和黄度值(b*)。
1.3.6 硫代巴比妥酸反应物(thiobarbituric acid reactive substances,TBARs)值测定根据Sawitzki等[16]的方法测定。结果以每千克样品所含丙二醛含量表示。
1.3.7 总挥发性盐基氮(total volatile basic nitrogen,TVB-N)含量测定
根据Yin等[17]的方法,使用微量移液器扩散法测定。
1.3.8 微生物数量测定
菌落总数:取10 g样品,用90 mL无菌超纯水均质90 s,进行梯度稀释,在37 ℃条件下孵育48 h,使用倾盘法在平板计数琼脂培养基上对总菌群进行计数。
乳酸菌计数:将样品均质液的稀释液倒入MRS琼脂培养基中,置于厌氧罐37 ℃条件下孵育48 h,进行乳酸菌计数。
1.3.9 质地剖面分析(texture profile analysis,TPA)
使用质构仪在20 ℃条件下测定样品质构参数,包括硬度、咀嚼度、胶着度、弹性和黏聚性。选用P50探头,测前速率1.0 mm/s、测定速率1.0 mm/s,测后速率1.0 mm/s,最大负荷2.0 kg,压缩量50%。
1.3.10 感官评定
在灌肠后第4、14和21天,将各组发酵香肠置于烤箱中(上、下火均为85 ℃)烤制,直至样品内部温度达到80 ℃,取出冷却至约(45±5) ℃,切成薄片(约1.5 cm厚),由感官小组的10 名成员随机选样进行感官评价。感官指标包括质地、色泽、风味、酸味和总体可接受度。评分标准采用10 分制,评分越高代表指标属性越好,品评期间提供温水漱口。
1.4 数据处理
各项指标均重复测定3 次,所得数据使用SPSS 19.0软件的常规线性模型进行分析,使用Duncans检验分析各组数据的差异显著性(显著性水平为0.05);使用Origin Pro 2018软件作图。
2 结果与分析
2.1 发酵及贮藏过程对香肠pH值和可滴定酸度的影响
由图1可知,发酵及贮藏过程中,所有处理组发酵香肠pH值迅速下降,尤其是在发酵过程中,随后稳定下降。灌肠后第0天,发酵香肠pH值为6.22~6.33,各组间无显著差异;未接种植物乳杆菌6003的发酵香肠(蔗糖添加量分别为0.4%和1.5%)pH值在第2天显著下降至5.21~5.24,第4天进一步下降至4.53~4.61,然后保持稳定直到第28天;接种后的发酵香肠pH值遵循相似的变化趋势,但均显著低于未接种组pH值(P<0.05),即T1组低于C1组,T2组低于C2组。接种组发酵香肠的pH值降低可能是由于乳酸菌的生长,乳酸菌在发酵过程中利用碳水化合物产生有机酸[18]。蔗糖添加量(C1、C2组)对香肠pH值没有显著影响。发酵后,所有香肠pH值均低于4.6。
小写字母不同,表示同一时间、不同处理组差异显著(P<0.05);大写字母不同,表示同一处理组、不同时间差异显著(P<0.05)。下同。
由图2可知,发酵及贮藏过程中,发酵香肠可滴定酸度变化趋势与pH值相反,可滴定酸度在发酵过程中迅速增加,然后略有增加,直到第28天。发酵过程中32 ℃的孵育可能有助于接种的发酵剂培养物的快速生长,并产生更多的酸,以降低样品pH值;但是,乳酸菌在发酵香肠4 ℃条件下贮藏过程中可能生长或适应情况欠佳,从而导致pH值变化不明显。接种发酵香肠的可滴定酸度在整个发酵及贮藏期间均高于未接种发酵香肠,而蔗糖添加量并未显著影响样品的可滴定酸度。据报道发酵香肠发酵过程中可滴定酸度增加[19]。高酸化率通常伴随着乳酸菌的快速生长,因此,微生物将能够在香肠中产生更多有机酸[10,20]。
2.2 发酵及贮藏过程对香肠aw的影响
由图3可知,在发酵过程中发酵香肠aw快速下降,而在第14天后变化不显著。不同蔗糖添加量和不同接种发酵剂处理组之间没有显著差异。Kalalou等[21]指出,发酵香肠的低aw可能会延长滞后期并缩短不良微生物的对数期,从而降低同一时期的微生物水平。因此,应尽快降低aw以抑制或延緩产品中不良微生物的生长。Roseiro等[22]研究结果表明,在加工过程中添加盐和脱水导致较高的渗透压,可能会降低发酵香肠aw。Consuelo等[9]发现,当葡萄糖添加量从0.1%增加到0.5%时,西班牙干香肠aw显著降低。但是,Qiu Chaoying等[20]报道,糖添加量为3%~12%不会显著影响广式发酵香肠aw,这与本研究结果一致。
2.3 发酵及贮藏过程对香肠颜色的影响
由图4可知,发酵香肠L*在发酵过程中持续增加,在第7天达到最高水平,此后一直下降直至贮藏期结束。发酵及贮藏过程中,所有香肠a*降低,b*升高。在发酵过程中,香肠L*的增加与pH值的快速下降相吻合。根据Visessanguan等[23]的报道,接种植物乳杆菌可加速泰国发酵香肠发酵过程中L*的增加,样品颜色的变化归因于产酸、蛋白质变性和亚硝基肌红蛋白的稳定性,发酵过程中肉蛋白质的酸化会导致肌丝晶格收缩,从而增加肉的光反射。Cavalheiro等[24]研究表明,产酸引起的蛋白质变性和凝结导致发酵肉产品颜色的变化。本研究中各组发酵香肠的L*、a*和b*未观察到显著差异。
2.4 发酵及贮藏过程对香肠微生物指标的影响
由图5~6可知,各组发酵香肠的菌落总数增长模式与乳酸菌增长模式一致。Roig-Sagués等[25]研究表明,乳酸菌与西班牙发酵香肠中需氧嗜温菌数量之间存在显著相关性(R2=0.99)。Sriphochanart等[8]指出,乳酸菌在香肠发酵过程中占主导地位。在本研究中,接种组香肠中的初始乳酸菌数量更高,在发酵结束时达到最高水平,为9.0~9.3 (lg(CFU/g)),但未接种组发酵香肠中的乳酸菌数量最高水平为7.5~7.9 (lg(CFU/g))。Lorenzo等[26]指出,发酵结束后乳酸菌数量略有下降,直到贮藏期结束均无明显变化,这可能是由于可发酵碳水化合物被消耗所致;乳酸菌能够产生某些抗微生物剂,如有机酸和细菌素,可能会抑制腐败和病原微生物的生长,使其在发酵产品中具有一定优势。酸化可能是干发酵香肠中葡萄球菌、微球菌、酵母菌和霉菌生长受到抑制的主要原因。本研究证明植物乳杆菌可被用作香肠发酵剂。
2.5 发酵及贮藏过程对香肠TBARs值和TVB-N含量的影响
由图7可知,各组发酵香肠TBARs值(脂质氧化指标)在整个发酵及贮藏过程中均逐渐增加。接种组发酵香肠的TBARs值显著低于未接种组(P<0.05)。接种发酵剂引起发酵肉制品中脂质氧化阻滞,这与Sawitzki等[16]的研究结果一致。Aksu等[27]指出,乳酸菌产生的过氧化氢酶分解过氧化氢,并降低氧化作用。Barrière等[28]指出,木糖葡萄球菌培养物中产生的超氧化物歧化酶和过氧化氢酶可以抑制脂质氧化过程中挥发性化合物的产生。不同蔗糖添加量发酵香肠TBARs值没有显著差异。
由图8可知,未接种组发酵香肠TVB-N含量从初始的2.8~3.1 mg/100 g增加到发酵后(第4天)的10.5~10.8 mg/100 g,相比之下,接种组发酵香肠TVB-N含量缓慢增加至9.7~9.8 mg/100 g。接种发酵剂后,发酵香肠TVB-N含量增速变缓,该现象在贮藏过程中更为明显,表明利用乳酸菌发酵可以显著抑制TVB-N的积累,这与Zaika[29]、Yin[17]等的研究结果一致。接种组发酵香肠TVB-N含量较低,同时微生物数量和pH值也较低。Yin等[17]指出,乳酸菌产生的乳酸和细菌素可抑制腐败和病原微生物的生长,从而在发酵过程中中和产生的TVB-N。
2.6 发酵及贮藏过程对香肠TPA的影响
由图9可知,在发酵及贮藏过程中,发酵香肠硬度、咀嚼度和胶着度显著提高,而黏聚性和弹性则先增加后缓慢降低,直至贮藏期结束,这与前人研究结果一致[20,23]。与未接种组发酵香肠相比,接种组发酵香肠的硬度和胶着度显著增加(P<0.05),这是由于酸引起的肉蛋白质变性和胶凝。硬度增加可能部分归因于加工过程中的水分流失[23]。此外,当贮藏结束时,接种组发酵香肠的弹性显著增加(P<0.05),贮藏期间,C1组发酵香肠的咀嚼度显著降低(P<0.05)。在香肠生产过程中,糖的添加可使pH值降低至肌原纤维蛋白等电点(约pH 5.1),并增加香肠硬度和咀嚼度[9-10]。在本研究中,添加1.5%蔗糖的发酵香肠具有更高的硬度和咀嚼度。这可能是由于水分含量和pH值降低(添加较高含量的糖类引起)而导致蛋白质构象致密[20]。
2.7 发酵及贮藏过程对香肠感官评分的影响
由表3可知,发酵后,接种组发酵香肠的风味评分比未接种组更高。许多因素都会影响独特发酵风味的产生,包括产品配方、发酵剂种类和加工条件等[30]。通过微生物和肉类内源酶的作用,碳水化合物、脂质和蛋白质分解,尤其是能够产生挥发性成分物质的分解,可能有助于样品发酵风味的形成[31]。T1组样品风味评分第14~21天明显下降,T2组样品风味评分随贮藏时间的延长明显下降,这与发酵香肠TBA值和TVB-N含量的升高有关。在发酵及贮藏过程中,发酵香肠质地评分的增加与TPA结果中硬度的增加相吻合,这可能是由于乳酸菌产生酸的作用[24]。第4天和第21天,接种组发酵香肠pH值的明显降低并没有影响样品酸味,这可能与人体味觉的灵敏度有关。蔗糖添加量不同对样品质量参数的影响较小,这说明0.4%的蔗糖添加量足以满足发酵香肠的发酵要求。
3 结 论
发酵过程中接种植物乳杆菌6003的发酵香肠具有更高的乳酸菌含量和可滴定酸度、更低的pH值、TBARs值和TVB-N含量,以及更好的质构特性和感官特征,L*、a*、b*和aw无显著变化。发酵香肠接种7(lg(CFU/g))
植物乳杆菌6003为发酵剂,相比于自然发酵优势明显。此外,蔗糖添加量对发酵香肠的各项指标均无显著影响,蔗糖添加量为0.4%时即可达到较好的效果。发酵后贮藏期间,随着贮藏时间的延长,各组发酵香腸的pH值和可滴定酸度无显著变化,黏聚性、L*、a*和aw显著降低,b*、TBARs值、TVB-N含量、硬度、咀嚼度和胶着度显著升高,乳酸菌数和菌落总数先降低然后趋于平稳。T1、T2组发酵香肠的总体可接受度评分在第21天时显著下降。后期将继续研究不同糖(如蔗糖和葡萄糖)以及其他发酵剂对发酵香肠品质的影响。
参考文献:
[1] 孙雷. 植物乳杆菌对猪肉蛋白提取物的分解能力及在发酵香肠中的应用[D]. 南京: 南京农业大学, 2003: 3-4.
[2] HAMMES W P, KNAUF H J. Starters in the processing of meat products[J]. Meat Science, 1994, 36(1/2): 155-168. DOI:10.1016/0309-1740(94)90039-6.
[3] PAPAMANOLI E, TZANETAKIS N, LITOPOULOU-TZANETAKI E,
et al. Characterization of lactic acid bacteria isolated from a Greek dry-fermented sausage in respect of their technological and probiotic properties[J]. Meat Science, 2003, 65(2): 859-867. DOI:10.1016/s0309-1740(02)00292-9.
[4] ADIGUZEL G C, ATASEVER M. Phenotypic and genotypic characterization of lactic acid bacteria isolated from Turkish dry fermented sausage[J]. Romanian Biotechnological Letters, 2009, 14(1): 4130-4138. DOI:10.1016/j.pep.2008.09.003.
[5] WANANGKARN A, LIU D C, SWETWIATHANA A, et al. An innovative method for the preparation of mum (Thai fermented sausages) with acceptable technological quality and extended shelf-life[J]. Food Chemistry, 2012, 135(2): 515-521. DOI:10.1016/j.foodchem.2012.04.118.
[6] TALON R, LEBERT I, LEBERT A, et al. Traditional dry fermented sausages produced in small-scale processing units in Mediterranean countries and Slovakia. 1: microbial ecosystems of processing environments[J]. Meat Science, 2007, 77(4): 570-579. DOI:10.1016/j.meatsci.2007.05.006.
[7] FREDERIC L, VERLUYTEN J, VUYST L D. Functional meat starter cultures for improved sausage fermentation[J]. International Journal of Food Microbiology, 2006, 106(3): 270-285. DOI:10.1016/j.ijfoodmicro.2005.06.027.
[8] SRIPHOCHANART W, SKOLPAP W. Characterization of proteolytic effect of lactic acid bacteria starter cultures on Thai fermented sausages[J]. Food Biotechnology, 2010, 24(4): 293-311. DOI:10.1080/08905436.2010.507163.
[9] CONSUELO G F, SANTOS E M, ROVIRA J, et al. The effect of sugar concentration and starter culture on instrumental and sensory textural properties of chorizo-Spanish dry cured sausage[J]. Meat Science, 2006, 74(3): 467-475. DOI:10.1016/j.meatsci.2006.04.019.
[10] SPAZIANI M, TORRE M D, STECCHINI M L. Changes of physicochemical, microbiological, and textural properties during ripening of Italian low-acid sausages. Proteolysis, sensory and volatile profiles[J]. Meat Science, 2009, 81(1): 77-85. DOI:10.1016/j.meatsci.2008.06.017.
[11] CONSUELO G F, SANTOS E M, JAIME I, et al. Influence of starter cultures and sugar concentrations on biogenic amine contents in chorizo dry sausage[J]. Food Microbiology, 2003, 20(3): 275-284. DOI:10.1016/s0740-0020(02)00157-0.
[12] NASSU R T, GONCALVES L A G, SILVA M A A P D, et al. Oxidative stability of fermented goat meat sausage with different levels of natural antioxidant[J]. Meat Science, 2003, 63(1): 43-49. DOI:10.1016/s0309-1740(02)00051-7.
[13] BOVERCID S, IZQUIERDOPULIDO M, VIDALCAROU M C. Effect of proteolytic starter cultures of Staphylococcus spp. on biogenic amine formation during the ripening of dry fermented sausages[J]. International Journal of Food Microbiology, 1999, 46(2): 95-104. DOI:10.1016/S0168-1605(98)00170-6.
[14] AMMOR M S, MAYO B. Selection criteria for lactic acid bacteria to be used as functional starter cultures in dry sausage production: an update[J]. Meat Science, 2007, 76(1): 138-146. DOI:10.1016/j.meatsci.2006.10.022.
[15] TOSUKHOWONG A, VISESSANGUAN W, PUMPUANG L, et al. Biogenic amine formation in Nham, a Thai fermented sausage, and the reduction by commercial starter culture, Lactobacillus plantarum BCC 9546[J]. Food Chemistry, 2011, 129(3): 846-853. DOI:10.1016/j.foodchem.2011.05.033.
[16] SAWITZKI M C, FIORENTINI ? M, CUNHA J A, et al. Lactobacillus plantarum AJ2 isolated from naturally fermented sausage and its effects on the technological properties of Milano-type salami[J]. Ciência e Tecnologia de Alimentos, 2008, 28(3): 709-717. DOI:10.1590/S0101-20612008000300030.
[17] YIN L J, JIANG S T. Pediococcus pentosaceus L and S utilization in fermentation and storage of mackerel sausage[J]. Journal of Food Science, 2001, 66(5): 742-746. DOI:10.1111/j.1365-2621.2001.tb04631.x.
[18] ESMAEILZADEH P, DARVISHI S, ASSADI M M, et al. Effect of Lactobacillus plantarum and Lactobacillus fermentum on nitrite concentration and bacterial load in fermented sausage during fermentation departement of biotechnology[J]. World Applied Sciences Journal, 2012, 18(4): 493-501. DOI:10.5829/idosi.wasj.2012.18.04.3156.
[19] DROSINOS E H, MATARAGAS M, XIRAPHI N, et al. Characterization of the microbial flora from traditional Greek fermented sausage[J]. Meat Science, 2005, 69(2): 307-317. DOI:10.1016/j.meatsci.2004.07.012.
[20] QIU Chaoying, SUN Weizheng, CUI Chun, et al. Effect of sugar level on physicochemical, biochemical characteristics and proteolysis properties of cantonese sausage during processing[J]. Journal of Food Quality, 2012, 35(1): 34-42. DOI:10.1111/j.1745-4557.2011.00420.x.
[21] KALALOU I, FAID M, AHAMI T A. Improving the quality of fermented camel sausage by controlling undesirable microorganisms with selected lactic acid bacteria[J]. International Journal of Agriculture and Biology, 2004, 6(3): 447-451.
[22] ROSEIRO L C, SANTOS C, SOL M, et al. Proteolysis in Painho de Portalgre dry fermented sausage in relation to ripening time and salt content[J]. Meat Science, 2008, 79(4): 784-794. DOI:10.1016/j.meatsci.2007.11.012.
[23] VISESSANGUAN W, BENJAKUL S, SMITINONT T, et al. Changes in microbiological, biochemical and physico-chemical properties of Nham inoculated with different inoculum levels of Lactobacillus curvatus[J]. LWT-Food Science and Technology, 2006, 39(7): 814-826. DOI:10.1016/j.lwt.2005.05.006.
[24] CAVALHEIRO C, PIOVESAN N, LOVATO M, et al. Colorimetric and sensory characteristics of fermented cured sausage with Brazilian ostrich meat addition[J]. Food Science and Technology, 2013, 33(4): 660-665. DOI:10.1590/S0101-20612013000400010.
[25] ROIG-SAGU?S A X, HERN?NDEZ-HERRERO M M, L?PEZ-SABATER E I, et al. Microbiological events during the elaboration of “fuet”, a Spanish ripened sausage Relationships between the development of histidine- and tyrosine-decarboxylase-containing bacteria and pH and water activity[J]. European Food Research and Technology, 1999, 209(2): 108-112. DOI:10.1007/s002170050467.
[26] LORENZO J M, FRANCO D. Fat effect on physico-chemical, microbial and textural changes through the manufactured of dry-cured foal sausage lipolysis, proteolysis and sensory properties[J]. Meat Science, 92(4): 704-714. DOI:10.1016/j.meatsci.2012.06.026.
[27] AKSU M ?, KAYA M. Effect of commercial starter cultures on the fatty acid composition of Pastirma (Turkish dry meat product)[J]. Journal of Food Science, 2006, 67(6): 2342-2345. DOI:10.1111/j.1365-2621.2002.tb09551.x.
[28] BARRI?RE C, CENTENO D, LEBERT A, et al. Roles of superoxide dismutase and catalase of Staphylococcus xylosus in the inhibition of linoleic acid oxidation[J]. FEMS Microbiology Letters, 2001, 201(2): 181-185. DOI:10.1111/j.1574-6968.2001.tb10754.x.
[29] ZAIKA L L, ZELL T E, PALUMBO S A, et al. Effect of spices and salt on fermentation of lebanon bologna-type sausage[J]. Journal of Food Science, 1978, 43(1): 186-189. DOI:10.1111/j.1365-2621.1978.tb09766.x.
[30] MONICA F, DURA M A, MARCO A, et al. Effect of Debaryomyces spp. on aroma formation and sensory quality of dry-fermented sausages[J]. Meat Science, 2004, 68(3): 439-446. DOI:10.1016/j.meatsci.2003.04.001.
[31] RAI K P, ZHANG Chunhui, XIA Wenshui. Effects of pure starter cultures on physico-chemical and sensory quality of dry fermented Chinese-style sausage[J]. Journal of Food Science and Technology, 2010, 47(2): 188-194. DOI:10.1007/s13197-010-0030-4.
