茶多酚对羊肉肌原纤维蛋白凝胶特性的影响
2020-06-01李立敏杨豫菘成立新姜昕禹高爱武
李立敏 杨豫菘 成立新 姜昕禹 高爱武

摘 要:研究茶多酚对羊肉肌原纤维蛋白凝胶特性的影响,将不同添加量(0.00%、0.01%、0.05%、0.10%、0.50%、1.00%)的茶多酚加入到羊肉肌原纤维蛋白中,测定肌原纤维蛋白表面疏水性、乳化性能、保水性、质构特性,观察羊肉肌原纤维蛋白凝胶微观结构。结果表明,与对照组相比,茶多酚添加量为0.10%时,羊肉肌原纤维蛋白的表面疏水性最小,疏水基团暴露程度最轻,乳化活性指数达到最大(4.88 m2/g),乳化稳定性指数(86.54%)和保水性(95.22%)均达到最佳;随着茶多酚添加量的增加,羊肉肌原纤维蛋白凝胶的硬度、咀嚼度、胶着度均显著上升(P<0.05),弹性、内聚性、回复性整体呈下降趋势(P<0.05)。结论:添加适量茶多酚可以显著改善羊肉肌原纤维蛋白的凝胶特性,并且凝胶的微观结构更加致密、空隙更小、形状规则且分布均匀;茶多酚与肌原纤维蛋白的非共价结合和共价结合可能会影响蛋白质的功能特性,并且这种作用强度随着茶多酚添加量的变化而变化。
关键词:羊肉;肌原纤维蛋白;茶多酚;凝胶特性
Abstract: In this paper, the effects of tea polyphenols on the gelation properties of mutton myofibrillar protein (MMP) were investigated. MMP added with different levels of tea polyphenols (0.00%, 0.01%, 0.05%, 0.10%, 0.50% and 1.00%) (m/m) were determined for surface hydrophobicity, emulsifying properties, water holding capacity and texture characteristics. Besides, the microstructure was observed. The results showed that compared with the control group (without adding tea polyphenols), addition of 0.10% tea polyphenols decreased the surface hydrophobicity and the exposure of hydrophobic groups to the lowest level, but increased emulsifying activity index (EAI) to the maximum (4.88 m2/g). MMP added with 0.10% tea polyphenols showed the best emusifying stability (86.54%) and water holding capacity (95.22%). With increasing concentration of tea polyphenols, the hardness, chewiness and gumminess of myofibrillar protein gels significantly increased (P < 0.05), while the springiness, cohesiveness and resilience decreased (P < 0.05). In conclusion, addition of an appropriate amount of tea polyphenols significantly improved the gelation properties of MMP, making the microstructure denser with smaller voids, and more regular in shape with a uniform distribution. Tea polyphenols and MMP can bind both non-covalently and covalently, affecting the functional properties of myofibrillar protein, and this effect varies with the concentration of tea polyphenols.
Keywords: mutton; myofibrillar protein; tea polyphenols; gelation properties
DOI:10.7506/rlyj1001-8123-20200131-030
中圖分类号: TS251.1 文献标志码:A 文章编号:1001-8123(2020)03-0008-06
肌原纤维蛋白(myofibrillar protein,MP)是一种由肌球蛋白、肌动蛋白、肌动球蛋白、肌钙蛋白及原肌球蛋白等组成的复合体,占肌肉蛋白质的50%~55%[1-2]。
同时,MP也是一类具有重要生物学功能特性的盐溶性结构蛋白,与乳化性、凝胶性等肉制品加工特性密切相关[3]。过度氧化是导致肉及肉制品品质下降的重要原因,也是目前困扰肉类工业发展的一大技术难题。因此,将蛋白质与脂质氧化程度最小化在产品商业化过程中非常重要[4]。在肉类产品中添加抗氧化剂是各种抗氧化方式中最有效的方法。随着人们生活水平和食品安全意识的提高,天然抗氧化剂因其安全健康、无毒无害的特点[5],逐渐成为肉品工业中的研究热点。根据结构类型,天然抗氧化活性物质主要分为酚酸类、黄酮类、醌类和维生素类等,其中植物多酚在作为肉制品加工天然防腐剂方面已引起广泛关注[6]。茶多酚具有低廉、安全、高效的特点,在食品工业中具有良好的应用前景。相关研究表明,天然植物提取物能有效抑制肉制品中的脂肪氧化,但是酚类物质及其氧化产物(半醌或醌类)可与蛋白质相互作用,并修饰蛋白质侧链氨基酸功能基团,进而改变蛋白质结构稳定性、溶解度及其他功能特性[7]。Hasni等[8]研究发现,茶多酚的结合会导致酪蛋白结构展开,表现为α-螺旋和β-折叠的含量减少,同时伴随着无规则卷曲的含量升高。Jongberg等[9]发现较高添加量的绿茶提取物虽然会提高肉蛋白的氧化稳定性,但是会破坏肉糜的凝胶性能。Rawel等[10]研究发现,酚酸和黄酮与大豆蛋白的共价结合降低了赖氨酸、色氨酸和半胱氨酸的含量,进而可能影响其营养价值。羊肉作为一种内蒙古的特色优质畜肉,具有高蛋白、低脂肪、低胆固醇的特点[11],但目前仍缺乏关于羊肉MP凝胶特性较为全面、系统的研究。为阐明植物多酚在肉制品中抑制脂肪和蛋白氧化过程的同时对MP凝胶特性的影响,本实验研究不同茶多酚添加量对羊肉MP凝胶表面疏水性、乳化性能、保水性、质构特性及微观结构的影响,为凝胶类肉制品的生产提供理论依据。
1 材料与方法
1.1 材料与试剂
新鲜羊肉后臀部购于呼和浩特东瓦窑批发市场;金龙鱼大豆油购于家乐福超市。
茶多酚(纯度99%) 麦克林生化科技有限公司;
牛血清白蛋白(albumin from bovine serum,BSA) 北京酷来搏科技有限公司;NaCl、KCl、MgCl2、Na2HPO4、NaH2PO4、乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)、苯甲基磺酰氟、哌嗪-1,4-二乙磺酸、十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、溴酚蓝、戊二醛、乙醇、叔丁醇(均为分析纯) 国药集团化学试剂有限公司。
1.2 仪器与设备
SQP电子天平 赛多利斯科学仪器(北京)有限公司;DZ-300N小型真空包装机 上海青葩包装机械有限公司;BCD-321WDBA电冰箱 青岛海尔股份有限公司;ST2100实验室pH计 奥豪斯仪器(常州)有限公司;FSH-2可调高速均浆机、HH-2数控精密恒温水浴锅 常州国华电器有限公司;
QL-866旋涡振荡器 其林贝尔仪器制造有限公司;TGL-20B高速台式离心机 上海安亭科学仪器厂;
U-2910紫外-可见分光光度计、TM4000 Plus新型台式扫描电子显微镜 日本日立株式会社;DGX-9143BC-1电热恒温鼓风干燥箱、DZX-6020B真空干燥箱 上海福玛实验设备有限公司;TA.XT Plus质构仪 英国Stable Micro System公司。
1.3 方法
1.3.1 MP的提取
参考Park[12]和雷娜[13]等的方法并稍作修改。将新鲜羊肉剔除多余脂肪和结缔组织,切成1cm×1 cm×1 cm左右小块,真空包装,-80 ℃贮存,使用前于0~4 ℃解冻。将完全解冻的肉样剁碎后,加入肉样4 倍体积的分离缓冲液A(含20 mmol/L Na2HPO4、20 mmol/L NaH2PO4、150 mmol/L NaCl、25 mmol/L KCl、3 mmol/L MgCl2、4 mmol/L EDTA、1 mmol/L苯甲基磺酰氟,pH 7.5),在8 000 r/min匀浆30 s,单层纱布过滤,2 282 r/min离心15 min,弃上清液。将得到的沉淀用分离缓冲液A重复上述步骤3 次,合并沉淀。沉淀经分离缓冲液A洗涤3 次后,用沉淀4 倍体积的分离缓冲液B(含20 mmol/L Na2HPO4、20 mmol/L NaH2PO4、0.1 mol/L KCl,pH 7.5)与分离缓冲液C(含20 mmol/L Na2HPO4、20 mmol/L NaH2PO4、0.1 mol/L NaCl)按上述步驟匀浆离心,重复3 次,最终所得沉淀即为MP。以BSA作为标准蛋白,采用双缩脲法[14]测定MP含量,得到标准曲线方程为y=0.039 4x+0.006 4 (R2=0.999)。
1.3.2 多酚复合体的制备
用预冷的缓冲液(含0.6 mol/L NaCl、15 mmol/L哌嗪-1,4-二乙磺酸,pH 6.0)将提取的MP稀释至30 mg/mL。以MP质量为基准,分别加入0.00%、0.01%、0.05%、0.10%、0.50%、1.00%的茶多酚,随后用1 mmol/L EDTA终止氧化。
1.3.3 MP乳化性能的测定
参考阮仕艳等[15]的方法测定MP的乳化性能。用0.1 mol/L pH 6.5磷酸盐缓冲液(phosphate buffered saline,PBS)配制质量浓度10 mg/mL的MP溶液。向MP溶液中加入体积比1∶4的大豆油,15 000 r/min匀浆1 min后立即倒入试管中。分别于静置0、10 min时,在距离试管底0.5 cm处用移液枪吸取50 μL的乳液于5 mL 0.1%的SDS溶液中,充分混匀后于500 nm波长处测定吸光度,分别记为A0和A10。MP的乳化活性指数(emulsifying activity index,EAI)和乳化稳定性指数(emulsifying stability index,ESI)分别按式(1)~(2)计算。
式中:ρ为蛋白质量浓度/(mg/mL);φ为油相体积分数0.20%;A500 nm为乳状液在500 nm波长处的吸光度;A0、A10分别为乳液在静置0、10 min时的A500 nm。
1.3.4 MP表面疏水性的测定
参考Chelh等[16]的方法,用20 mmol/L pH 7.0的PBS,配制质量浓度5 mg/mL的MP溶液,取5 mL MP溶液加入1 mL 1 mg/mL溴酚蓝溶液,充分混匀,在6 000 r/min离心15 min,收集上清。按上述步骤再次离心后,取上清液用20 mmol/L PBS稀释10 倍,于595 nm波长处测定光密度(optical density,OD),记为OD样品。以加入溴酚蓝未加MP溶液的PBS为对照,表面疏水性以溴酚蓝结合量计,按式(3)计算。
1.3.5 MP凝胶的制备
将40 mg/mL pH 7.0 MP溶液于25 ℃水浴加热形成凝胶,至凝胶中心温度达到45 ℃后恒温30 min,然后以1 ℃/min梯度升温直至凝胶中心温度达到90 ℃,恒温30 min,取出立即放入冰水混合物中冷却30 min后,4 ℃下保存过夜。
1.3.6 MP凝胶保水性的测定
将MP凝胶取出,室温静置30 min。称取离心管质量(m0,g),放入5 g用滤纸条包裹的凝胶样品后称质量(m2,g),6 000 r/min离心10 min,去除多余水分后称质量(m1,g)。保水性按式(4)计算。
1.3.7 MP凝胶质构特性的测定
将MP凝胶室温放置30 min后,选用质地剖面分析(texture profile analysis,TPA)模式,TPA测试参数:探头型号P/0.5R;测前速率2 mm/s、测试速率1 mm/s、测后速率1 mm/s;位移3 mm;触发力5 g;触发类型Auto。
1.3.8 MP凝胶微观结构的测定
参考Salvador等[17]的方法并稍作修改。将凝胶样品切块,用2.5%戊二醛溶液浸泡固定,4 ℃条件下放置24 h。室温条件下用0.01 mol/L pH 7.4 PBS漂洗10 min,重复3 次,然后分别用体积分数60%、70%、80%、90%乙醇和无水乙醇浸泡20 min梯度脱水,再用叔丁醇浸泡10 min,重复3 次。将样品于20 ℃、真空度80 Pa条件下干燥12 h,将干燥后的样品用导电双面胶固定到样品台上,置于扫描电子显微镜下观察,加速电压20 kV。
1.4 数据处理
结果以平均值±标准差表示。实验数据用SPSS Statistics 21.0统计软件进行显著性差异分析,P<0.05表示差异显著;采用Origin 8.5软件作图。
2 结果与分析
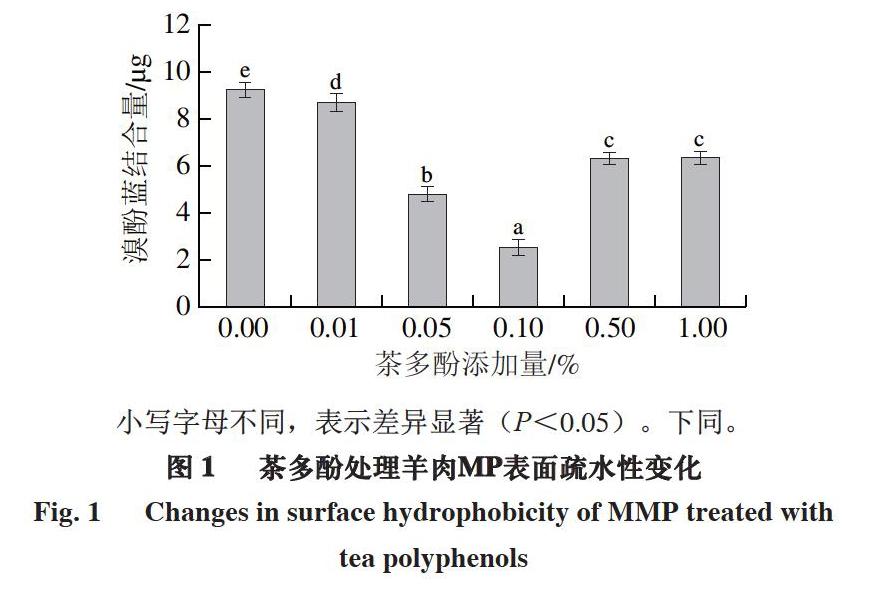
2.1 茶多酚对羊肉MP表面疏水性的影响
小写字母不同,表示差异显著(P<0.05)。下同。
由图1可知:随着茶多酚添加量的增加,羊肉MP表面疏水性呈先下降后上升的趋势;当茶多酚添加量0.00%~0.10%时,羊肉MP表面疏水性逐渐降低
(P<0.05);茶多酚添加量为0.10%时,羊肉MP表面疏水性最小,蛋白质变性程度最低;茶多酚添加量0.50%,羊肉MP表面疏水性又有所增大(P<0.05);当进一步增加茶多酚添加量至1.00%时,羊肉MP表面疏水性无显著变化。
蛋白质的表面疏水性能够反映蛋白质分子内部疏水基团的暴露程度。蛋白质结构展开程度越大,疏水基团暴露越多,蛋白质表面疏水性越大,因此,可用其反映蛋白质的变性程度。蛋白聚集被认为是MP表面疏水性降低的主要原因[18-19]。与对照组(0.00%)相比,茶多酚的添加导致MP表面疏水性显著减小(P<0.05),这可能是由于多酚作为一种抗氧化剂通过清除自由基有效减缓了氧化导致的蛋白质降解及变性,从而减少了疏水性氨基酸残基的暴露,因此,茶多酚处理组MP的表面疏水性均低于对照组。此外,多酚类化合物含有亲水性羟基和酚酸羧基,多酚与蛋白质的结合为蛋白质引入了亲水性基团,进而降低了蛋白质的表面疏水性[20]。当茶多酚添加量大于0.10%时,MP表面疏水性又有所增加,这可能是由于酚类物质与自由基结合形成醌,醌与蛋白质巯基形成了巯基-醌加成产物;当添加过量的酚类物质时,一部分多酚转变为醌类物质与MP中氨基等亲水性基团共价
结合,从而使MP的表面疏水性增大[21]。这也与Mutilangi等[18]的分析结果一致,即蛋白质经过降解和变性会使其内部分子暴露,从而導致表面疏水性增加。
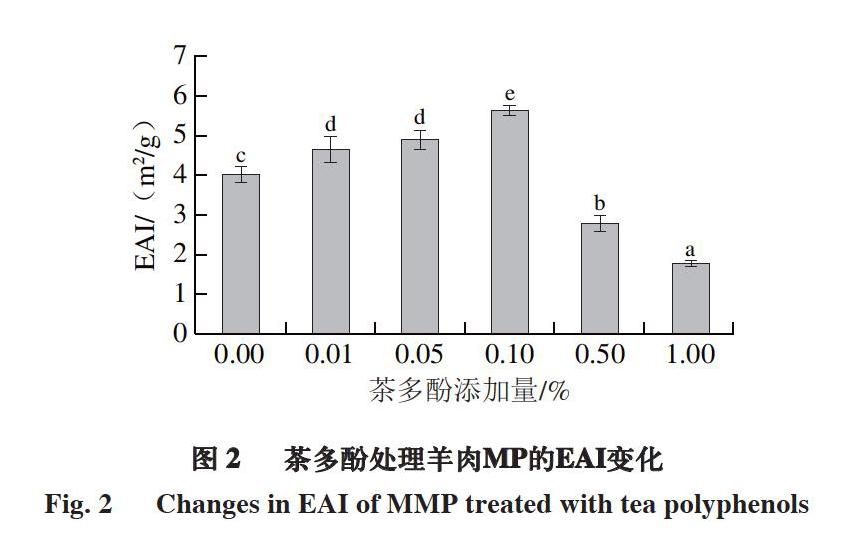
2.2 茶多酚对羊肉MP乳化性能的影响
由图2可知,羊肉MP的EAI随着茶多酚添加量的增加呈先上升后下降趋势;当茶多酚添加量为0.00%~0.10%时,羊肉MP的EAI逐渐增大(P<0.05);当茶多酚添加量为0.10%时,MP的EAI最大,达到4.88 m2/g;当茶多酚添加量继续增加至1.00%时,MP的EAI最小,为1.77 m2/g。
EAI是指蛋白质在促进油-水混合时,单位质量蛋白质能够稳定的油水界面面积[22]。蛋白质的乳化能力与其溶解度相关,溶解度越高,溶液中能参与乳化的蛋白分子越多,乳化活性越好[23]。结果表明,适量添加茶多酚可以提高羊肉MP的EAI。MP可在脂肪颗粒表面吸附伸展形成界面膜,稳定脂肪颗粒,而MP氧化会引起结构改变,使其形成稳定界面膜的能力降低,导致MP乳化性能降低。多酚作为一种抗氧化剂通过清除自由基有效抑制MP氧化,从而减缓MP乳化性能的降低[9]。但添加过量的酚类物质会使MP发生聚集,在乳化过程中难以伸展并包裹于油滴表面,最终导致难以形成界面膜。因此,过量添加茶多酚导致MP的EAI降低[20]。
ESI是指蛋白质维持油-水混合不分离时对外界条件的抗应变能力,即乳化剂保持乳化物稳定的能力[24]。由图3可知:当茶多酚添加量为0.00%时MP的ESI最小,为27.82%;随着茶多酚添加量的增加,羊肉MP的ESI呈先下降后上升的趋势;当茶多酚添加量为1.00%时MP的ESI达到最大(86.54%),说明此时蛋白质维持油水体系稳定状态的能力最强;添加0.10%茶多酚的羊肉MP的ESI与未添加时无显著差异。
蛋白质的乳化能力体现在其既能与水又能与脂肪相互作用,即一定条件下蛋白质溶液乳化脂肪的能力[25-26]。当茶多酚添加量大于0.10%,羊肉MP的ESI显著上升,可能是由于蛋白质中疏水基团的暴露增加了蛋白质与油脂间的相互作用,促进蛋白质吸附在油脂表面,形成致密稳定的蛋白质膜[27]。另一方面可能是由于多酚物质与MP发生共价结合,提高了界面膜的稳定性和MP的ESI[20]。
2.3 茶多酚对羊肉MP凝胶保水性的影响
由图4可知:随着茶多酚添加量的增加,羊肉MP凝胶保水性整体呈上升趋势;当茶多酚添加量为0.05%时,羊肉MP保水性最小(86.74%);当茶多酚添加量为1.00%时,保水性最大(95.22%);当茶多酚添加量为0.10%、0.50%时,羊肉MP保水性相对较好,且2 组间无显著差异。
保水性是评定肉类品质的重要指标之一,其大小与肉的风味、质构、凝结性及最终产品的多汁性等属性密切相关[28]。凝胶保水性反映凝胶网络结构,凝胶结构越细密、均匀,其保水性越好。保水性在MP凝胶网络结构中形成过程受氢键、疏水作用及静电作用等影响。MP直接和水相互作用产生的毛细现象也与保水性密切相关[29]。由上述实验结果可知,羊肉MP凝胶保水性随着茶多酚添加量的增加而显著增加(P<0.05),可能是由于茶多酚可以抑制蛋白氧化变性,并对蛋白质降解起保护作用,可使凝胶孔隙更加均匀和网络结构更加紧密,增强蛋白质的水合能力进而提高凝胶的保水性[30]。这与张慧芸等[31]研究结果一致,即酚类物质的适量添加能够增强蛋白质的交联能力,使其网络结构增强从而保水性更好。
2.4 茶多酚对羊肉MP凝胶质构特性的影响
凝胶硬度是衡量凝胶质构特性的重要指标之一,表示仪器探头在首次下压凝胶时压力达到的最大峰值[28]。由表1可知,随着茶多酚添加量的增加,羊肉MP凝胶硬度呈显著上升趋势(P<0.05)。凝胶弹性是指凝胶在探头第1次下压变形后的回弹程度,反映了在外力作用时凝胶变形及去力后的恢复程度。茶多酚添加量为1.00%时,羊肉MP凝胶弹性最小(P<0.05),而其余各组凝胶弹性差异不显著[32]。咀嚼度表示咀嚼固体食品所用的能量,而胶着度表示食品在一定作用力下的流动性[28]。随着茶多酚添加量的增加,MP凝胶的咀嚼度和胶着度呈增大趋势;当茶多酚添加量為1.00%时,咀嚼度和胶着度均达到最大。内聚性是指形成食品所需形态的内部结合力,回复性是指食品发生形变后在与导致变形同样的速度、压力条件下回复的程度[33-34]。羊肉MP的内聚性和回复性随着茶多酚添加量的增加呈显著下降趋势(P<0.05),且均在茶多酚添加量为1.00%时最小。
以上结果表明,随着茶多酚添加量的增加,羊肉MP凝胶的硬度、咀嚼度和胶着度整体呈显著上升趋势(P<0.05);弹性、内聚性和回复性整体呈下降趋势,这可能是由于酚类化合物抑制了蛋白质氧化变性,并对蛋白质降解具有保护作用,从而使凝胶维持良好的网状结构和提高了其质构特性[31]。相关研究表明,酚类物质可以有效提高MP的交联程度,多酚氧化生成的醌类物质与蛋白质中赖氨酸、蛋氨酸、丝氨酸等氨基酸发生交联反应,从而增强了蛋白质凝胶强度及稳定性[35-36]。当茶多酚添加量大于0.10%时,羊肉MP凝胶的硬度、咀嚼度、胶着度急剧上升,而弹性、内聚性、回复性急剧下降,可能是由于过量的茶多酚与MP共价结合引起了MP聚集,且一部分多酚屏蔽了MP中的活性基团,不利于三维网状结构的形成,最终导致MP质构特性变差[37-40]。
2.5 茶多酚对羊肉MP凝胶微观结构的影响
A~E. 茶多酚添加量分别为0.00%、0.01%、0.05%、0.10%、0.50%、1.00%。
微观结构表征是研究MP凝胶内部结构与特性的重要手段。由图5可知:未添加茶多酚的羊肉MP凝胶结构粗糙,质地疏松,存在较多不规则孔洞(图5A),随着茶多酚添加量的增加,MP凝胶结构有所改善,网状结构较致密、空隙较小、形状规则且分布均匀;这是由于茶多酚添加量的增加,导致更多结合位点与蛋白质交联形成胶束,从而使凝胶结构更加紧密[31]。另一方面可能是由于茶多酚提高了羊肉MP的胶凝能力,并增强了氧化作用在构建弹性凝胶网络中的积极作用,多酚被氧化形成的醌类物质会促使MP中的巯基向二硫键转化,而且可以作为交联剂同时与不同的亲核基团共价结合从而使MP发生交联[38-40]。
综上所述,适量添加茶多酚可以使羊肉MP形成的凝胶更加致密均匀,这与张慧芸等[31]的研究结果相似,即添加适量抗氧化酚类物质后形成的MP凝胶结构致密、孔径较小、形状规则且均匀,进而使凝胶品质得以改善。与其他处理组相比,当茶多酚添加量为1.00%时,MP凝胶孔径变大,表面凹凸不平,这表明过量添加茶多酚会破坏MP的凝胶结构,可能是由于过量的多酚物质会与MP共价结合导致蛋白质中游离氨基和巯基数量下降,MP的二级和三级结构遭到破坏,最终发生不良聚集。一部分多酚会屏蔽MP中的巯基、氨基等官能团,从而阻碍蛋白质形成有序的凝胶网状结构[37-40]。
3 结 论
通过研究不同添加量茶多酚对羊肉MP凝胶特性的影响,发现适量添加茶多酚可有效抑制羊肉MP的交联和相互作用,进而改善羊肉MP凝胶的稳定性。添加1.00%茶多酚的羊肉MP凝胶的乳化稳定性和保水性最佳;茶多酚添加量为0.50%时,羊肉MP凝胶的整体质构特性最好;当茶多酚添加量为0.10%时,羊肉MP凝胶的表面疏水性最小,蛋白质变性程度最低。因此,添加适量茶多酚可改善羊肉MP凝胶的结构及功能特性。
参考文献:
[1] LIU R, LONERGAN S, STEADHAM E, et al. Effect of nitric oxide on myofibrillar proteins and the susceptibility to calpain-1 proteolysis[J]. Food Chemistry, 2019, 276: 63-70. DOI:10.1016/j.foodchem.2018.10.005.
[2] 李玲, 季慧, 康大成, 等. 氧化条件下茶多酚对猪肉肌原纤维蛋白理化和凝胶特性的影响[J]. 食品科学, 2019, 40(2): 12-17. DOI:10.7506/spkx1002-6630-20180606-064.
[3] 韦诚, 朱丽娟, 谢月英, 等. 蛋白质在肉类加工保藏中的氧化及其不利影响的研究进展[J]. 食品科学, 2017, 38(9): 314-321. DOI:10.7506/spkx1002-6630-201709048.
[4] 王珏, 王锡昌, 刘源. 植物多酚在肉制品加工中的应用[J]. 肉类研究, 2013, 27(2): 37-41.
[5] 章林, 黄明, 周光宏. 天然抗氧化剂在肉制品中的应用研究进展[J]. 食品科学, 2012, 33(7): 299-303.
[6] 沈维治, 廖森泰, 刘吉平, 等. 植物多酚抑菌作用的研究进展[J]. 天然产物研究与开发, 2009, 21(5): 282-285.
[7] 曹云刚. 植物多酚对肉蛋白氧化稳定性和功能特性的影响机理及应用[D]. 无锡: 江南大学, 2016: 7-11.
[8] HASNI I, BOURASSA P, HAMDANI S, et al. Interaction of milk
α- and β-caseins with tea polyphenols[J]. Food Chemistry, 2011, 126(2): 630-639. DOI:10.1016/j.foodchem.2010.11.087.
[9] JONGBERG S, TERKELSEN L D S, MIKLOS R, et al. Green tea extract impairs meat emulsion properties by disturbing protein disulfide cross-linking[J]. Meat Science, 2015, 100: 2-9. DOI:10.1016/j.meatsci.2014.09.003.
[10] RAWEL H M, D?RTE CZAJKA D, et al. Interactions of different phenolic acids and flavonoids with soy proteins[J]. International Journal of Biological Macromolecules, 2002, 30(3): 137-150. DOI:10.1016/S0141-8130(02)00016-8.
[11] 馬光路, 徐红颖. 内蒙古产山羊肉和绵羊肉中脂肪和蛋白质含量的比较分析[J]. 黑龙江畜牧兽医, 2016(10): 87-88.
[12] PARK D, XIONG Y L, ALDERTON A L. Concentration effects of hydroxyl radical oxidizing systems on biochemical properties of porcine muscle myofibrillar protein[J]. Food Chemistry, 2007, 101(3): 1239-1246. DOI:10.1016/j.foodchem.2006.03.028.
[13] 雷娜. EGCG修饰巯基对肌原纤维蛋白乳化凝胶特性的影响及机制研究[D]. 杨凌: 西北农林科技大学, 2017: 14-24.
[14] GORNALL A G, BARDAWILL C J, DAVID M M. Determination of serum proteins by means of the biuret reaction[J]. Journal of Biological Chemistry, 1949, 177(2): 751-766.
[15] 阮仕艳, 彭新颜, 张淑荣, 等. 乳清抗氧化肽对冷藏猪肉糜肌原纤维蛋白功能性及品质的影响[J]. 食品科学, 2017, 38(21): 265-271. DOI:10.7506/spkx1002-6630-201721042.
[16] CHELH I, GATELLIER P, SANT?-LHOUTELLIER V. Technical note: a simplified procedure for myofibril hydrophobicity determination[J]. Meat Science, 2006, 74(4): 681-683. DOI:10.1016/j.meatsci.2006.05.019.
[17] SALVADOR P, TOLDR? M, SAGUER E, et al. Microstructure-function relationships of heat-induced gels of porcine haemoglobin[J]. Food Hydrocolloids, 2009, 23(7): 1654-1659. DOI:10.1016/j.foodhyd.2008.12.003.
[18] MUTILANGI W A M, PANYAM D, KILARA A. Functional properties of hydrolysates from proteolysis of heat-denatured whey protein isolate[J]. Journal of Food Science, 1996, 61(2): 270-275. DOI:10.1111/j.1365-2621.1996.tb14174.x.
[19] LI C, XIONG Y L, CHEN J. Oxidation-induced unfolding facilitates myosin cross-linking in myofibrillar protein by microbial transglutaminase[J]. Journal of Agricultural and Food Chemistry, 2012, 60: 8020-8026. DOI:10.1021/jf302150h.
[20] OZDAL T, CAPANOGLU E, ALTAY F. A review on protein-phenolic interactions and associated changes[J]. Food Research International, 2013, 51(2): 954-970. DOI:10.1016/j.foodres.2013.02.009.
[21] WANG X, XIONG Y L, SATO H, et al. Controlled cross-linking with glucose oxidase for the enhancement of gelling potential of pork myofibrillar protein[J]. Joumal of Agricultural and Food Chemistry, 2016, 64(50): 9523-9531. DOI:10.1021/acs.jafc.6b03934.
[22] PEARCE K N, KINSELLA J E. Emulsifying properties of proteins: evaluation of a turbidimetric technique[J]. Journal of Agricultural and Food Chemistry, 1978, 26(3): 716-723. DOI:10.1021/jf60217a041.
[23] ZORBA O, KURT S, GENCCELEP H. The effects of different levels of skim milk powder and whey powder on apparent yield stress and density of different meat emulsions[J]. Food Hydrocolloids, 2005, 19(1): 149-155. DOI:10.1016/j.foodhyd.2004.05.001.
[24] 魏朝贵. KCl和MgCl2部分替代NaCl条件下猪肉肌原纤维蛋白乳化特性及其应用研究[D]. 南京: 南京农业大学, 2014: 3-10.
[25] COFRADES S, CARBALLO J, CARECHE M, et al. Research note: emulsifying properties of actomyosin from several species[J]. LWT-Food Science and Technology, 1996, 29(4): 379-383. DOI:10.1006/fstl.1996.0059.
[26] 蔡立志, 宋玉兰, 黄丽卿. 大豆蛋白的乳化功能及表征研究[J]. 食品科学, 1999, 20(10): 20-23. DOI:10.3321/j.issn:1002-6630.1999.10.006.
[27] OMANA D A, XU Y, MOAYEDI V, et al. Alkali-aided protein extraction from chicken dark meat: chemical and functional properties of recovered proteins[J]. Process Biochemistry, 2010, 45(3): 375-381. DOI:10.1016/j.procbio.2009.10.010.
[28] 姜晴晴. 凍融过程中带鱼脂肪和蛋白氧化及其对肌肉品质影响的研究[D]. 杭州: 浙江大学, 2015: 1-9.
[29] 吕卫金, 赵进, 汪金林, 等. 茶多酚延缓冷藏大黄鱼肌原纤维蛋白变性降解机理研究[J]. 中国食品学报, 2014, 14(1): 60-67.
[30] LI Y, LI X, ZHANG C, et al. Oxidation and decrease of gelling properties for meat myofibrillar protein induced by hydroxyl radical[J].Transactions of the Chinese Society of Agricultural Engineering, 2013, 29(12): 286-292. DOI:10.3969/j.issn.1002-6819.2013.12.036.
[31] 张慧芸, 吴静娟, 郭新宇. 多酚对猪肉肌原纤维蛋白氧化和凝胶特性的影响[J]. 食品科学, 2016, 37(21): 43-47. DOI:10.7506/spkx1002-6630-201621008.
[32] MARINO R, ALBENZIO M, DELLA MALVA D A, et al. Proteolytic pattern of myofibrillar protein and meat tenderness as affected by breed and aging time[J]. Meat Science, 2013, 95(2): 281-287. DOI:10.1016/j.meatsci.2013.04.009.
[33] 王俏仪, 董强, 卢水仙, 等. 冷冻贮藏对罗非鱼肌肉质构特性的影响[J]. 广东海洋大学学报, 2011, 31(4): 86-90. DOI:10.3969/j.issn.1673-9159.2011.04.016.
[34] 徐亚丹. 基于质地及动力学特性的牛肉新鲜度检测[D]. 杭州: 浙江大学, 2006: 14-16.
[35] TEMDEE W, BENJAKUL S. Effect of oxidized kiam wood and cashew bark extracts on gel properties of gelatin from cuttlefish skins[J]. Food Bioscience, 2014, 7: 95-104. DOI:10.1016/j.fbio.2014.07.001.
[36] PRODPRAN T, BENJAKUL S, PHATCHARAT S. Effect of phenolic compounds on protein cross-linking and properties of film from fish myofibrillar protein[J]. International Journal of Biological Macromolecules, 2012, 51(5): 774-782. DOI:10.1016/j.ijbiomac.2012.07.010.
[37] JIA Na, WANG Letian, SHAO Junhua, et al. Changes in the structural and gel properties of pork myofibrillar protein induced by catechinmodification[J]. Meat Science, 2017, 127(5): 45-50.DOI:10.1016/j.meatsci.2017.01.004.
[38] JONGBERG S, LUND M N, WATERHOUSE A L, et al. 4-Methylcatechol inhibits protein oxidation in meat but not disulfide formation[J]. Journal of Agricultural and Food Chemistry, 2011, 59(18): 10329-10335. DOI:10.1021/jf202268q.
[39] CAO Yungang, XIONG YoulingL.. Chlorogenic acid-mediated gel formation of oxidatively stressed myofibrillar protein[J]. Food Chemistry, 2015, 180(1): 235-243. DOI:10.1016/j.foodchem.2015.02.036.
[40] ANVARI M, CHUNG D. Dynamic rheological and structural characterization of fish gelatin-gum arabiccoacervate gels cross-linked by tannic acid[J]. Food Hydrocolloids, 2016, 60: 516-524. DOI:10.1016/j.foodhyd.2016.04.028.
