鸡粪除臭菌的分离筛选及除臭效果分析
2020-06-01李成成张潇月张紫薇黄议漫张小平
李 玥,李成成,李 静,张潇月,张紫薇,黄议漫,刘 浩,罗 鸿,张小平,赵 珂*
(1.四川农业大学资源学院,成都 611130;2.中国农业大学资源与环境学院,北京 100094;3.旺苍县农业农村局,四川 广元628200;4.泸州市农业农村局现代农业发展促进中心,四川 泸州 646000)
随着我国养殖业的快速发展,大量畜禽排泄废物已经成为主要的环境污染源[1-2]。畜禽养殖业所产生的大量固体废弃物和废水,已经对我们日常的生产生活造成了不可忽视的影响。目前畜禽排泄物处理的方法主要有好氧堆肥发酵、厌氧消化法和烘干法等,处理后的畜禽排泄物恶臭气体排放量明显减少,并且大部分成为肥料和饲料资源。但由于畜禽排泄物成分复杂、处理周期长,在处理过程中也会产生大量的臭气,主要成分有氨、硫化物、胺类和一些低级脂肪酸类等化学物质[3],其中浓度最高、影响最大的是氨和硫化氢,这两种气体进入大气后不仅会引起一系列环境问题,同时产生的刺激性气味也会对人和家畜的健康造成极大危害[4-6]。
在各种畜禽排泄物中,鸡粪由于其强烈的恶臭而比猪粪、牛粪等危害更大、更难处理。未腐熟的鸡粪或在腐熟过程中产生的恶臭气味,是由粪便里的甲硫醇、硫化氢、氨、吲哚和丙烯醛等10 多种物质混合造成的[7]。鸡粪产生的强烈恶臭不仅污染环境,危害人畜健康,也严重影响了人们的生活质量,因而引起公众的极大关注。因此,减少鸡粪中恶臭物质的释放对解决鸡粪污染尤为重要。
研究表明,采用化学、物理及生物方法处理臭气有一定效果,但化学和物理方法除臭可能造成二次污染,且处理费用颇高,大面积使用效果不理想,多见于化工业。微生物除臭的生物处理方法具有无二次污染、处理方式温和、能耗低等特点,被广泛应用于畜禽排泄物的无害化处理,且处理效果显著[2,8],在国外已有较多的研究和应用[9]。因此,以微生物为主的生物处理方法已成为固废资源化的重要途径,而微生物除臭法也成为堆肥除臭的有效方法和研究热点。然而,受环境因素、畜禽排泄物来源及微生物特异性等因素影响,单一微生物很难高效除臭。研究表明,多种除臭菌混合培养后,各菌株相互协同作用更有利于臭气的分解,增强除臭效果[10-11]。而目前我国有关选育和复配微生物除臭剂的研究报道还较少[12-13]。因此,本研究以鸡粪堆肥为材料,从中分离筛选出具有除臭效率高、生长能力强的高效除臭菌株,并构建复合菌系,旨在为畜禽粪便特别是鸡粪的资源化和无害化处理提供菌种资源。
1 材料与方法
1.1 材料
1.1.1 样品来源
采集发酵前期、中期、后期3 个阶段的鸡粪堆肥样品装于无菌采样袋中,封口并贴上标签。将装有样品的采样袋置于冰盒中,带回实验室置于4 ℃冰箱备用。
1.1.2 培养基
(1)分离培养基。含氮富集液体培养基N1[5]:蔗糖 25 g,NH4NO32 g,KH2PO42 g,NaCl 2 g,FeSO40.1 g,CaCl20.5 g,ZnSO40.05 g,MgSO4·7H2O 0.5 g,蒸馏水950 mL,灭菌后的鸡粪浸出液50 mL,pH 7.5~8.0。
(2)纯化保种培养基。LB培养基[14]。
(3)筛选培养基。刚果红培养基[15]:CMC-Na 2 g,K2HPO40.5 g,MgSO4·7H2O 0.25 g,(NH4)2SO41 g,刚果红0.1 g,琼脂18~20 g,蒸馏水1000 mL;产气检测培养基L1:蔗糖2 g,NaCl 10 g,蛋白胨10 g,酵母浸出粉5 g,琼脂18~20 g,蒸馏水1000 mL,pH 6.5~7.0。
1.2 方法
1.2.1 样品处理
称取5 g 新鲜样品置于带有玻璃珠且装有45 mL无菌水的三角瓶中,放于28 ℃恒温摇床室振荡30 min 后,取 1 mL 接入 50 mL 富氮液体培养基 N1 中进行富集培养,3 d 后再转接到新鲜的N1 培养基中培养,连续转接3次。
1.2.2 分离纯化菌种
将新鲜样品和富集后的溶液进行梯度稀释,分别取稀释浓度为 10-4、10-5、10-6的培养液 0.1 mL 涂布于LB 培养基上,于28 ℃和45 ℃的恒温培养箱进行培养,待菌长出后挑取单个菌落在LB 培养基上纯化保种,于4 ℃冰箱保藏。
1.2.3 除臭微生物的初筛
(1)产气筛选
将纯化后的菌株接种在产气检测培养基L1 上,放入30 ℃恒温培养箱扩培,待菌长出后,小心将湿润的红色石蕊试纸、醋酸铅试纸插入培养皿内让其贴在皿盖,3~5 min后观察试纸是否发生颜色变化,菌株生长过程中产生氨红色石蕊试纸将变为蓝色,产生硫化氢气体醋酸铅试纸将变为黑色[8]。
(2)除氨检测
将不产生氨和硫化氢气体的菌株在液体培养基中扩培3 d 制成菌悬液,取10 mL 接入100 g 新鲜鸡粪中;将此鸡粪放入2 L 的密闭塑料罐,并在罐中放入1 个装有30 mL 1 mol·L-1稀硫酸溶液的小烧杯,以此吸收鸡粪产生的氨;空白对照组是将菌悬液换为10 mL 无菌水,每处理分别设置3 个平行。将此装置放置在25 ℃的恒温培养箱中培养20 d 后,用凯氏定氮法测定吸收液中吸收氨的量[1,16]。按下述公式计算其除氨率。

式中:CNH3空为空白组氨的含量,CNH3处为处理组氨的含量,mg·L-1;c为硫酸溶液摩尔浓度,mol·L-1;v为消耗硫酸溶液的体积,mL;17为氨的质量分数,g·mol-1;V为2%硼酸吸收液体积,mL。
(3)除硫化氢检测
将上述除氨检测中所用菌悬液,取10 mL 接入100 g新鲜鸡粪中;将此鸡粪放入2 L的不透光密闭塑料罐,并在罐中放入1个装有30 mL 1 mol·L-1碱性锌铵络溶液的小烧杯,以此吸收鸡粪产生的硫化氢气体;空白对照组是将菌悬液换为10 mL 无菌水,每处理分别设置3 个平行。将此装置放置在25 ℃的恒温培养箱中培养14 d后,用亚甲基蓝分光光度法测定吸收液中硫化氢的含量[13]。按下述公式计算除硫化氢率。

式中:CH2S为空白组硫化氢的含量,CH2S处为处理组硫化氢的含量,mg·m-3;A为样品显色液吸光度;A0为空白溶液吸光度;BS为计算因子,斜率的倒数,μg·吸光度-1;VS换算成标准状况下的采样体积,L。
1.2.4 除臭菌株的复筛
将上述初筛获得的同时具有除氨和除硫化氢能力的菌株于LB 液体培养基中培养3 d。取10 mL 菌悬液接入装有100 g新鲜鸡粪的2 L塑料罐中,并将吸收液,即装有30 mL 1 mol·L-1稀硫酸溶液的小烧杯和装有30 mL 1 mol·L-1碱性锌铵络溶液的小烧杯同时放入塑料罐中,密封好后放置于25 ℃的恒温培养箱中培养,24 h后取出吸收液,同时放置新的吸收液,将取出的吸收液分别测定其吸收的氨或硫化氢气体含量,连续测定 10 d[1,13]。
1.2.5 纤维素降解实验
将初筛获得的效果较好的菌株接种于刚果红培养基中,28 ℃恒温培养48 h 后观察其菌落周围是否产生水解圈,并测量水解圈的直径[15],同时参照李静等[15]的实验方法定量测定各菌株的羧甲基纤维素酶(CMCase)活性,设置3个重复。
1.2.6 除臭菌株系统发育分析
对筛选出具有除臭效果的菌株进行DNA 提取,采用 16S rRNA 基因序列通用引物 Eubac 27F(5′-AGAGTTTGATCCTGGCTCAG-3′)和Eubac 1492R(5′-CGGTTACCTTGTTACGACTT-3′)[17-18]对 DNA 进 行PCR扩增,扩增产物送往上海生工生物有限公司进行测序。测序结果通过Blast 软件与Genbank 数据库进行比对,根据Blast软件的结果,选择与目标菌株同源性较高的菌株的16S rRNA 序列,用MEGA 6.0 软件通过邻近法构建目标菌株的系统发育树,确定其种属。
1.2.7 拮抗实验
将筛选出具有除臭效果的菌株分别均匀地涂布于固体培养基上,待菌长满平板后,用5 mm的无菌打孔器取下菌饼,将菌饼倒置于刚均匀涂布有另一菌液的平板上,28 ℃恒温培养72 h,待另一种菌完全长出后观察是否有拮抗现象[19]。
1.2.8 除臭菌系的构建
根据各菌株的除臭效果,结合拮抗实验结果,构建复合菌系。将各组合菌株的菌悬液按照体积比1∶1混合后,按上述除臭检测步骤测定各组合菌株的除臭能力,筛选出除臭效果好的复合菌系。
1.2.9 数据分析
试验数据通过 SPSS 20.0 软件(SPSS Inc.,Chica⁃go,US)进行分析。
2 结果与分析
2.1 菌株的分离与产气筛选
本研究从不同处理时期的鸡粪堆肥中共分离获得200 株菌株,其中细菌146 株,真菌54 株。试纸检测结果表明,200株菌仅有15株不产生氨和硫化氢气体,其中细菌10 株(MS03、MS07、MS11、MS42、MS51、MS60、MS61、MS82、MS88 和 MS92),真菌 5 株(Z14、Z24、Z26、Z35和Z38)。
2.2 除臭检测
对筛选获得的不产生恶臭气体的15 株菌进行除氨、除硫化氢能力的检测。结果显示除菌株MS88 以外,其余14株菌对氨或硫化氢气体均有一定的去除能力,但各菌株对两种恶臭气体的去除效果有较大差异,除臭率表现为除硫化氢率大于除氨率,而两种气体的减少量则表现为氨气远高于硫化氢气体(表1)。
2.3 除臭菌复筛
为了进一步明确除臭菌株的除臭能力,本研究连续10 d 对初筛中除臭效果较好的5 株菌(MS03、MS07、MS11、MS42、MS82)分别进行氨及硫化氢释放量的测定。结果表明,各菌株氨和硫化氢释放量均明显低于CK。说明这5 株菌均有较好抑制鸡粪在发酵过程中释放恶臭气体的能力,但各菌株在鸡粪发酵过程抑制氨和硫化氢释放作用中存在差异(图1)。菌株MS03 和菌株MS07 对氨和硫化氢的抑制量表现出与初筛较为一致的结果,这两株菌对氨和硫化氢的抑制量均较高,并且在接种第6 d 后氨和硫化氢的释放量均呈现出明显下降后趋于稳定的状态,菌株MS11、MS42 和MS82 虽然对氨和硫化氢的产生有明显抑制作用但效果不稳定,如菌株MS42 和MS82 在鸡粪发酵过程中抑制氨和硫化氢释放量均呈现出了先下降后升高的趋势,而菌株MS11 在鸡粪发酵过程中抑制氨和硫化氢释放量总体是呈下降趋势,但存在较大波动。结果表明,菌株MS03 和MS07 对氨和硫化氢的释放均有显著的抑制效果。
表1 菌株除臭结果Table 1 Deodorization result of strains
2.4 拮抗试验
选取初筛表现较好的菌株MS03、MS07、MS11、MS42 和MS82 进行拮抗实验,结果表明菌株MS82 与菌株 MS42、MS07 之间有拮抗作用,MS11 与 MS42、MS07相互拮抗,其余菌株间互不拮抗(表2)。

图1 除臭效果测定Figure 1 Deodorization effect
表2 菌株间的拮抗试验Table 2 Antagonistic experiment of strains
2.5 复合菌系构建及除臭能力检测
因为不同菌株对两种恶臭气体有不同的除臭效果,据此将相互不拮抗的菌株两两组合,构建出5组复合菌系,分别为:C1(MS03+MS42)、C2(MS03+MS07)、C3(MS03+MS11)、C4(MS03+MS82)、C5(MS11+MS82)。由图2可以看出,5个复合菌系均表现出一定的除臭能力,但不同组合之间,除臭能力存在较大差异,其中C2 和C4 组去除两种恶臭气体的能力显著高于其他组,去除率均高于60%,综合除臭效果极显著高于其他组合(P<0.01)。但值得注意的是,复合菌系如C1 和C3 组虽然也表现出一定的除臭能力,但除臭率与相应单菌株相比并无明显差异,除臭效果并无明显变化,甚至C3组除臭率显著低于其单一菌株。
2.6 纤维素降解结果
刚果红平板筛选结果表明,除菌株M42 外,其余4 株菌均能在刚果红培养基上形成水解圈,同时也具有产生羧甲基纤维素酶的能力,而水解圈大小与其所产生的CMCase活力之间并无明显的相关性(表3)。
2.7 除臭菌株系统发育分析
对除臭效果较好的5 株菌进行16S rRNA 测序。将测序结果通过Blast 软件与Genbank 数据库进行比对,根据Blast软件的结果,用MEGA6.0软件通过邻近法构建目标菌株的系统发育树(图3)。鉴定结果如下:MS03为芽孢杆菌属(Bacillussp.),MS07为贝莱斯芽孢杆菌(Bacillus velezensis),MS11 为耐寒短杆菌(Brevibacterium frigoritolerans),MS42为木糖葡萄球菌(Staphylococcus xylosus),MS82 为变异棒杆菌(Coryne⁃bacterium variabile)。
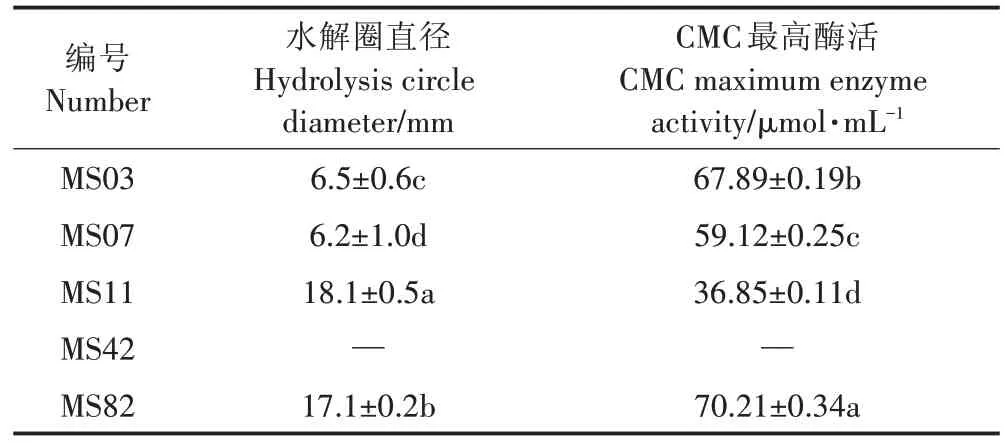
表3 纤维素降解结果Table 3 The result of cellulose degradation
3 讨论
畜禽排泄物和堆肥中营养丰富且存在大量的微生物,虽然大部分微生物都具有产生恶臭气体的能力,但恶臭的环境中可能孕育出可以除去恶臭气体的微生物,因此可以将此类微生物分离出来作为筛选除臭菌的潜在菌种。本研究从不同处理时期的鸡粪堆肥中分离获得200株菌,通过产气初筛获得15株具有除臭潜力的菌株,进一步检测这些菌株的除氨率和除硫化氢率后,发现有14 株具有除臭效果,除臭菌获得率为7%。相较于顾文杰[13]、简保权等[20]、高华等[21]、魏良[22]所采用的硼酸吸收法和锌铵络盐比色法筛选除臭菌,本试验采用湿润的红色石蕊试纸和醋酸铅试纸法对菌株进行产气初筛,方法简单、便捷,能大幅减少初筛时耗费的时间和精力,提高了定量检测时获得除臭菌的机会。然而,由于大部分微生物在生长过程中或多或少会有一定量氨或硫化氢气体产生,因此本研究所采用的试纸初筛方法在筛选过程中会淘汰一些具有除臭能力的微生物,导致筛选所获得的除臭菌数量较少。通过复筛获得5 株具有较好除臭效果的菌株,对菌株16S rRNA 序列分析,确定这5 株除臭菌分属于芽孢杆菌属(Bacillussp.)、贝莱斯芽孢杆菌(Ba⁃cillus velezensis)、耐寒短杆菌(Brevibacterium frigoritol⁃erans)、木糖葡萄球菌(Staphylococcus xylosus)、变异棒杆菌(Corynebacterium variabile)。已有研究表明芽孢杆菌属在恶臭气体处理中具有重要作用,如芽孢杆菌属的枯草芽孢杆菌有很强的生物同化作用,能有效降低粪便中产生的氨、吲哚等有害气体浓度,减轻粪便臭味[23]。杨柳等[24]从猪粪堆肥以及土壤中分离获得了5 株分属于芽孢杆菌属和短杆菌属(Brevibacteriumsp.)的高效除臭菌株。此外,本研究结果表明除菌株MS42 外,其余4 株菌还有很强的纤维素降解能力。杨伟平等[25]从鹅粪便中筛选出具有纤维素分解能力的芽孢杆菌属,其可用作动物微生态添加剂和除臭剂。黄旺洲[26]将高效纤维素分解菌用于猪粪和牛粪的堆肥发酵,发现粪便中的粗纤维和有机质被有力地分解和降解,从而抑制了粪便中的氨和硫化氢气体的释放。徐杰等[27]从土壤、秸秆、牛粪等样品中分离得到3 株具有木质纤维素降解能力的细菌,其具有使堆肥快速升温和有效除臭的潜力,经鉴定均为芽孢杆菌属。由此可见,芽孢杆菌属和短杆菌属不仅可以通过生物同化作用有效减轻粪便臭味,同时还可以通过对鸡粪中纤维素的降解,提高易利用营养物质的C/N 进而减少氨的释放,在畜禽粪便除臭方面具有良好的应用前景。
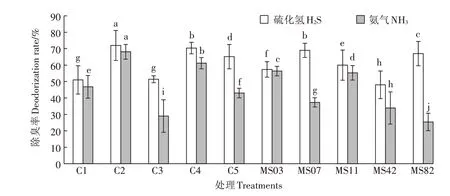
图2 单菌与复合菌系除臭率Figure 2 Deodorization rate of single bacteria and complex microbial system
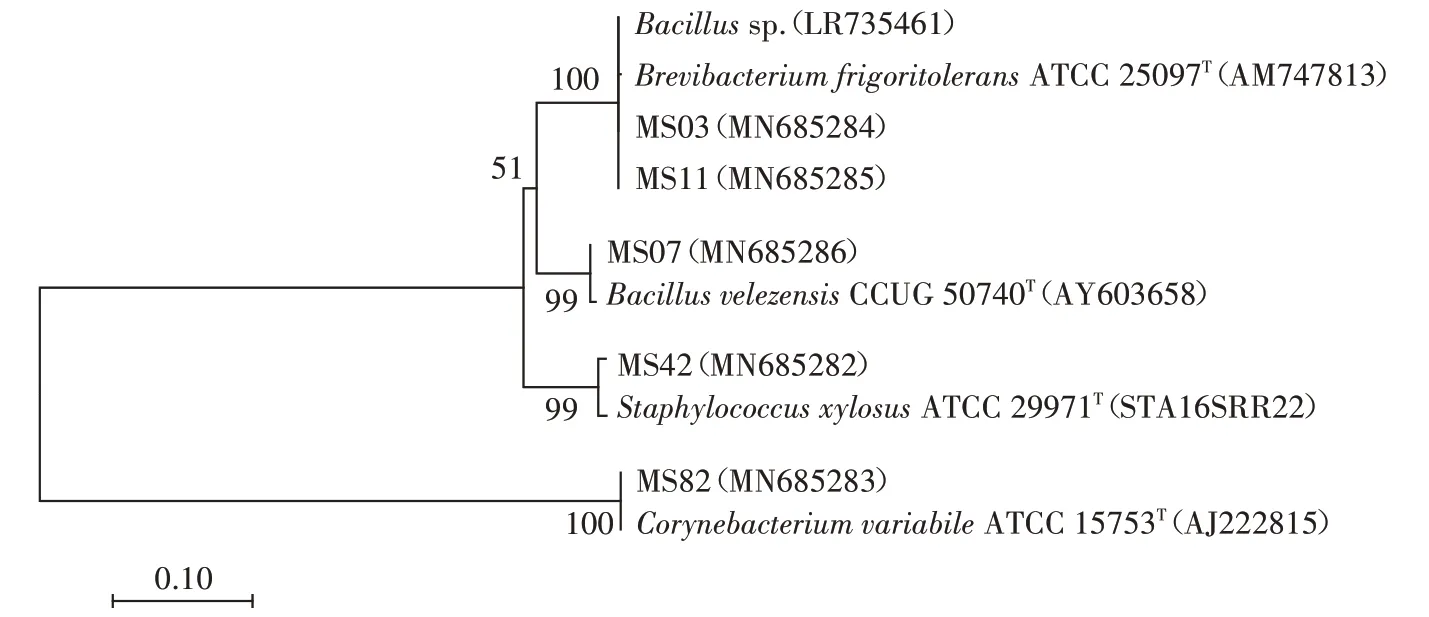
图3 除臭菌16S rRNA序列系统发育树Figure 3 Phylogenetic tree of 16S rRNA of deodorizing strains
研究表明除臭是多种微生物共同作用的结果,复合菌系的除臭效果要优于单一菌株。顾文杰[13]的研究表明,在相同的培养时间下,复合菌系除臭效果要优于单株菌的效果。廖瀚峰等[28]将两种能降解纤维素的除臭菌混合培养后,除臭效果好于单株菌。赵晨曦等[2]也同样是将筛选出的单株除臭菌进行混合培养,然后应用于鸡粪发酵处理,取得了满意的鸡粪无害化处理除臭效果。本研究选取互不拮抗的除臭菌株两两组合,构建5组复合菌系,进行除臭检测,C2和C4 组对两种恶臭气体的去除率均高于60%,其中对硫化氢的去除率均高于70%,综合除臭效果显著高于其他组合,也显著高于欧亚铃[8]、魏良[22]筛选的鸡粪除臭菌的除臭效果。这是由于鸡粪成分复杂,其本身就有许多微生物,微生物间相互关系也较为复杂,改变一种微生物的数量都可能引起微生物群落的改变,而将除臭菌组合后添加入鸡粪可能更易对鸡粪中的微生物菌群结构造成影响,有利于除臭菌成为优势菌群并发挥相应功能,从而达到提升除臭率的目的。同时,鸡粪中的恶臭气体属于多种臭气的混合物,单一微生物很难将臭气全部除去。因此,将具有除臭效果的优良菌株构建复合菌系处理鸡粪,对减少恶臭气体的排放,减少氮素损失,提升堆肥的质量具有广阔的应用前景。但值得注意的是,并不是所有复合菌系的除臭效果都高于单菌株,如组合C1和C3虽然表现出一定的除臭能力,但除臭率与相应单菌株相比并无明显差异,甚至C3组的除臭率显著低于其单一菌株,虽然构建这两个复合菌系的各菌株其除臭效果并不差,为什么会出现复合菌系除臭效果还低于单一菌株的现象呢?究其原因很有可能是组合菌株之间存在生存空间、营养物质等因素的竞争,导致各菌株均不能达到最佳生长状态,从而无法达到很好的协同效果,影响了各菌株的除臭能力。因此,在构建复合菌株体系的过程中,我们不仅要考虑单菌株的除臭能力,还要着重考虑复合后各菌株间除了具有拮抗作用外还可能存在的其他竞争因素。
4 结论
(1)从以鸡粪为原料的堆肥中分离出5 株具有除臭功能的菌株,对其进行分子鉴定,菌株MS03为芽孢杆菌属(Bacillussp.),菌株MS07 为贝莱斯芽孢杆菌(Bacillus velezensis),菌株MS11 为耐寒短杆菌(Brevi⁃bacterium frigoritolerans),菌株 MS42 为木糖葡萄球菌(Staphylococcus xylosus),菌株 MS82 为变异棒杆菌(Corynebacterium variabile)。
(2)5 株具有除臭功能的菌株对恶臭物质成分氨和硫化氢气体均有一定的去除能力,菌株MS03 和MS07对氨和硫化氢的释放具有显著的抑制效果。
(3)通过拮抗实验,构建的5 个复合菌系均表现出一定的除臭能力,C2 组合和C4 组合去除氨和硫化氢气体的能力高于其他组合,在无害化处理鸡粪方面具有较大的潜力和应用前景。
