土壤外源钒施加对玉米中钒积累、亚细胞分布和非蛋白巯基含量的影响
2020-06-01张志专韦明奉
侯 明,霍 岩,张志专,韦明奉
(桂林理工大学化学与生物工程学院,广西 桂林 541004)
目前,重金属对农业生态系统的污染已引起全球的广泛关注。当植物受到重金属毒害时,植物细胞通过自身防御功能使重金属选择性分布,避免重金属对植物重要的组织、细胞及细胞器的损害[1]。Mwamba等[2]发现,在甘蓝型油菜中,Cd 的大部分积累在可溶性部分,相比之下,在细胞壁和液泡中则有较多的Cu被隔离。Zhang 等[3]、司江英等[4]和沈奕昕等[5]研究表明,Cd、Pb 和Cu 主要分布在玉米的细胞壁区域,其次为细胞溶质部分,细胞器中分布很少,且植物根部的金属含量明显高于茎叶部分。Hou 等[6]研究发现,芥菜和小白菜的根部V的73.4%~78.6%、茎中的74.9%~79.8%、叶片中的86.6%~93.2%积累在细胞壁和可溶性部分,这表明在植物V 积累和解毒过程中,细胞壁和液泡共同起作用。细胞壁是重金属进入细胞的第一道屏障,它阻止了重金属离子进入细胞质,这种抑制能力直接反映了植物对重金属的耐受性。研究植物亚细胞中重金属的分布,对于揭示金属对植物的毒理和植物耐受性具有重要意义。非蛋白巯基(NPT)是防止植物受到重金属毒害的植物体内重要组成部分。非蛋白巯基化合物主要包括谷胱甘肽(GSH)、植物螯合素(PCs)和半胱氨酸(Cys)等,是植物去除重金属的主要成分,重金属与巯基类物质的络合是植物对重金属胁迫的响应[7]。PCs 是富含半胱氨酸的多肽物质,其主要生理功能是PCs 通过与细胞内-SH 基团反应形成毒性更低的金属络合物,并将其存储在细胞液泡中,避免游离的重金属离子迁移至细胞质中,从而降低毒性作用。Aborode 等[8]研究表明 GSH 和 PCs 在拟南芥的亚硒酸盐和砷酸盐解毒中起着重要作用。李冬琴等[9]研究表明,NPT 可与水稻中的Cd螯合从而降低Cd 的毒性。可见,不同植物在不同的重金属胁迫下产生不同的巯基蛋白质,这些巯基化合物对于植物自身的解毒机制起重要作用。
V 被认为是植物生长非必需的微量元素。低浓度V 会促进植物生长发育,但高浓度V 对植物产生毒性作用[10-11]。研究表明,V 对植物更具有流动性和毒性[12]。近年来,V 污染对土壤和生物的影响引起了人们的关注。Imtiaz 等[13]研究表明,V 显著增加了所有基因型鹰嘴豆的酶活性,降低了蛋白质含量、植物的生物量以及根和茎的长度,植物根部积累了大量的V。Saco 等[14]和 Yang 等[15]研究表明,从营养生长到生殖生长,菜豆和大豆均受到了V 的影响。V 主要积累在植物的根中,只有低于20%转运至地上部分。随着土壤中V浓度的增加,细胞壁中V浓度与根中总V浓度的比值也随之增加,植物可能产生自我防御系统以承受V 毒性。Tian 等[16]研究表明,大白菜中的V 从根到叶部的转运极低,但土壤中活动性最高的V通常为五价态,而叶片中的V(Ⅳ)占优势(占总V 的60%~80%),表明大白菜中V 具有生物还原性。中国的V产量占全球V产量的57%,在中国西南部有26.49%的土壤被V 污染[17],广西岩溶地区的独特环境条件使土壤中全V 和可溶态V 含量较高,其耕层土壤中V 含量平均值达106.28 mg·kg-1,个别地区石灰岩土壤背景高达565.7 mg·kg-1[18],这有可能使V在作物中积累,进而影响人体健康。近年来人们关注到V对蔬菜类植物生长的影响,而粮食作物的研究较少,尤其是作物本身对V 的解毒机理罕见报道。甜玉米是华南地区广泛种植的农作物,保证甜玉米的优质高产是这个新兴农业优势产业可持续发展的基础。因此,本文以甜玉米为研究对象,在以往的水培研究成果[19]基础上,通过在土壤中施加外源V,研究了盆栽试验培养模式下,V在玉米植物体内的生物积累、V 的亚细胞分布和非蛋白巯基化合物对V 的响应差异,旨在从细胞分子水平探讨V在植物中的生物学效应,阐明植物的耐性机制,为环境中V污染的风险评估和预防提供科学依据。
1 材料与方法
1.1 材料
以桂林理工大学雁山校区附近农田土壤作为盆栽试验用土壤,土壤部分理化性质的测定参考刘光崧等[20]文献,结果见表1。
土壤经风干,除去石块和垃圾,每盆(上直径×下直径×高:27 cm×17 cm×23 cm)称取过筛(3.2 mm)后的土壤7 kg,每千克土壤施用N[CO(NH2)2]0.2 g、P2O5(KH2PO4)0.2 g、K2O(K2SO4)0.1 g 作为底肥,这些分析纯试剂均以粉末形式与土壤混匀。
供试玉米(Zea maysL.)种子为正甜68 超甜玉米种子(广东金作农业科技有限公司)。

表1 土壤部分理化性质Table 1 Physical and chemical properties of the soil
1.2 试验处理
盆栽试验共设计5 个不同的V 处理(0、100、200、300、500 mg V·kg-1土壤),分别以NH4VO3(AR)固体粉末的形式加入,每个处理6 个重复,每盆土壤充分混匀后陈化平衡7 d,备用。
挑选籽粒饱满的甜玉米种子,用0.3% H2O2消毒30 min,洗净,用纯水浸泡6 h 后于30 ℃烘箱中催芽,将已萌发小芽的玉米种子播种于盆栽土壤中,所有盆都随机排列并偶尔改变位置。待幼苗长至3 片叶,每盆定为5 株,按大田栽培管理要求,按期浇水以保持土壤湿度。当甜玉米幼苗生长至5 片叶时(约38 d),收获每个处理的4 盆玉米植株,另外2 盆在玉米含苞结籽后再收获(约93 d)。第一次收获的植物分成根和茎叶(幼苗期)用水洗净(根部用0.1 mol·L-1EDTA溶液浸泡15 min,以除去表面吸附的金属离子,再用水洗净),再用纯水洗涤2 次。将样品分成两部分,一部分样品(2盆10株)用吸水纸吸干植物表面水分后,剪碎混合,分别准确称取每份1.000 g 的植物鲜样,置于-20 ℃冰箱中保存,用于V 的亚细胞分布和非蛋白巯基含量的分析测定。第二次收获的植株分为根、茎、叶和子实(成熟期),如上述方法洗净后,将样品(包括第一次收获的另2盆样品)放入烘箱100 ℃杀青10 min,置于60 ℃烘箱3 d。用分析天平记录植物干质量后,将样品制成粉末状,放入干燥器以备测定V含量。
试验所用试剂均为分析纯,水为重蒸馏水。
1.3 测定内容与方法
1.3.1 V的亚细胞分级
取出上述预处理好的新鲜(或冰冻)植物样,将根、茎叶分别剪碎,将样品与提取液[0.25 mol·L-1蔗糖+50 mmol·L-1Tris-HCl 缓冲液(pH7.5)+1 mmol·L-1二硫苏糖醇(C4H10O2S2)]按 1∶10(g∶mL)的比例混合,在冰浴中用玛瑙研钵将样品研磨成匀浆,按下列步骤进行细胞组分逐级离心分离:匀浆液在1500 r·min-1下离心20 min,沉淀为细胞壁及未破碎残渣(F1);上清液在 2500 r·min-1下离心 10 min,沉淀为细胞核(F2);上清液在 10 000 r·min-1下离心 30 min,沉淀为线粒体和叶绿体(F3);上清液为核蛋白和可溶性组分(F4)。全部操作在4 ℃下进行。
1.3.2 非蛋白巯基(NPT)、谷胱甘肽(GSH)和植物螯合态(PCs)含量的测定
在研钵中放入1 g鲜样组织,加液氮研磨,加入预冷的50 g·L-1磺基水杨酸(SSA,含6.3 mmol·L-1DTPA,pH<1)3 mL 和少量石英砂,冰浴研磨至匀浆。在4 ℃11 000 r·min-1下离心 15 min,收集上清液定容至 5 mL,4 ℃冷藏,按Keltjens 等[21]的5,5′-二硫代双(2-硝基苯甲酸)(DTNB)比色法测定NPT含量。在研钵内放入1 g鲜样组织,加入预冷的50 g·L-1三氯乙酸(TCA)3 mL和少量石英砂,冰浴研磨至匀浆,按上述方法离心并收集上层清液,测定GSH 含量。试验结果均为3次重复试验的平均值。植物螯合肽(PCs)含量的测定:

1.3.3 V含量的测定
准确称取一定量的植物样品粉末和已蒸干浓缩的不同亚细胞组分,分别用HNO3和H2O2(V∶V=2∶1)在电热板上消解直至溶液澄清,纯水定容后用石墨炉原子吸收光谱法测定样品中V 含量(GFAAS,nov AA 400P,Analytik Jena AG)。试验结果为3 次重复试验的平均值,采用生物组分分析标准参考物质菠菜(GBW10015,GSB-6)和柑橘叶(GBW10020,GSB-11)进行样品中V的质量控制。
1.4 数据分析
转运系数(Translocation factor,TF)和富集系数(Bioconcentration factor,BF)计算公式分别为:

使用DPS 数据处理系统和Microsoft Excel 2010进行统计分析,并用Duncan 多重性方法比较分析同一品种不同处理间的差异显著性。所得结果表示为平均值±标准偏差(平均值±SD,n=3)。
2 结果与分析
2.1 玉米植株的生物量
如表2 所示,玉米植株的叶片占植株生物量的11.7%~88.5%,茎占 21.0%~34.2%,子实占 14.6%~29.9%,根占10.8%~14.1%。不同生长期玉米植株各器官生物量随V 的胁迫浓度增大变化趋势不同。V处理浓度增大,幼苗期玉米植株各器官生物量逐渐增加,成熟期生物量则呈下降趋势。当V浓度在100~500 mg⋅kg-1,与对照相比较,幼苗期植物根和茎叶分别增加8.5%~138.0%和27.2%~126.6%,而成熟期的植物根、茎、叶和子实分别下降9.9%~31.8%、5.2%~38.4%、31.5%~60.9%和34.7%~51.4%。
2.2 玉米不同器官中V的积累
由表3 结果可见,在不同V浓度胁迫下,幼苗期甜玉米各部分V 积累量依次为:根>茎叶,成熟期则为:根>叶>茎>>子实。多数V 积累在根部,且根部V含量远高于地上部。如图1 所示,根部V 含量约占总量的74.8%~95.6%,茎叶部V 含量约占总量的4.4%~24.6%,子实中V 含量约占0.1%~0.6%,表明玉米植株将V 从地下部向地上部运输的能力较弱。随着V浓度增大,植株各部分V 含量均呈现上升趋势,但根部增幅明显大于茎叶。土壤经过500 mg·kg-1V 处理后,与对照相比较,幼苗的根和茎叶中V 含量显著增加1 635.7%和118.8%,成熟期的根、茎、叶和子实V含量增加3 342.6%、1 681.5%、753.3%和403.3%。同一生长期土壤经过不同浓度V 处理,植物根部V 含量具有显著性差异(P<0.05)。此外,土壤中V浓度较低(V≤100 mg·kg-1)并不明显影响幼苗期茎叶、成熟期叶和子实中V含量。
如表4 所示,随着土壤中V浓度增加,各生长期玉米植株V 的富集系数(BF)逐渐增大,但转运系数(TF)呈下降趋势。成熟期的BF(root/soil)明显高于幼苗期,表明根系在生长过程中积累了更多V。当土壤中的 V浓度为 0 mg·kg-1,BF(grain/soil)的最大值仅有0.000 46,随着土壤 V浓度增加,BF(grain/soil)值先下降后上升,但始终低于对照,可见子实对V富集能力很小。在玉米生长期,不同V浓度胁迫时根到茎的TF(shoot/root)和根到子实的TF(grain/root)差异较大。对于V 处理过的土壤,幼苗期和成熟期的根到茎叶的TF 值[TF(shoot/root)]以及成熟期的根到子实的 TF 值[TF(grain/root)],均明显小于对照的TF 值,随着V 处理浓度的增加,玉米茎叶和子实的TF 显著下降。土壤V浓度从100 mg·kg-1到500 mg·kg-1,与对照组相比,玉米幼苗期的 TF(shoot/root)值下降了 62.4% 和 79.2%,成熟期的 TF(shoot/root)下降53.1%和68.1%,并且TF(grain/root)值较小(均小于0.01),表明V 从玉米根到子实的转运极少。可见,随着V 胁迫浓度增大,玉米植株积累V 的能力增强,由于植物根部固持V 的能力增强,减少了V 从根部向地上部分的运输,转运能力逐渐降低。

表2 不同V处理对玉米植株生物量分配的影响(g,干质量)Table 2 Dry biomass of different parts of maize(Zea mays L.)seedlings under V stress(g,DW)

表3 不同生长时期玉米根、茎和叶中V含量(mg·kg-1 DW)Table 3 V content in stems,leaves and roots of maize(Zea mays L.)plant in different growth periods(mg·kg-1 DW)
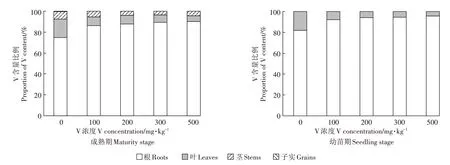
图1 玉米植株器官中V含量所占比例Figure 1 Proportion of V content in organs of mazie(Zea mays L.)crops
2.3 V在玉米幼苗中的亚细胞分布
V 在玉米幼苗的亚细胞分布结果如表5、图2 所示。玉米植株茎叶中V 主要分布在细胞壁(F1)和可溶性组分(F4),分别占总量的 31.94%~64.86% 和10.89%~28.82%,在细胞核(F2)和叶绿体、线粒体组分(F3)中分配较少,仅占 14.54%~19.07% 和 9.71%~20.17%。随着V胁迫浓度增大,玉米茎叶中V在F1的含量明显增加,而在F4中的含量显著降低,F2和F3的含量变化较小。
植物根部V 的亚细胞组分分配与地上部明显不同,升高的V浓度被可溶性组分(F4)吸收,其次是细胞壁(F1),F1和F4之和占总量的82.66%~87.02%。随着V 胁迫浓度增加,根中V 在F1和F4中的分配变化与茎叶相同 ,当 V浓度从 100 mg·kg-1增加到 500 mg·kg-1,F1的比例从28.06%增加到54.36%,而F4的比例从57.37%降到30.36%,F2和F3的比例变化不大,二者之和占总量的12.98%~17.34%。
2.4 V胁迫对玉米中NPT、GSH和PCs含量的影响
玉米幼苗中非蛋白巯基(NPT)含量对比如图3(A)所示,可以看出,随着V浓度增大,茎叶和根中NPT含量均为先上升后下降,且茎叶中NPT含量增加明显,根部变化平缓。茎叶和根中NPT 在V浓度为300 mg·kg-1时达最大值,分别为 2.47 μmol·g-1和 1.61 μmol·g-1,相比于对照增加了32.88%和20.24%,当V浓度大于300 mg·kg-1,NPT含量下降,仍然高于对照,茎叶比对照增加了5.76%,而根系与对照比较没有显著性差异(P<0.05)。
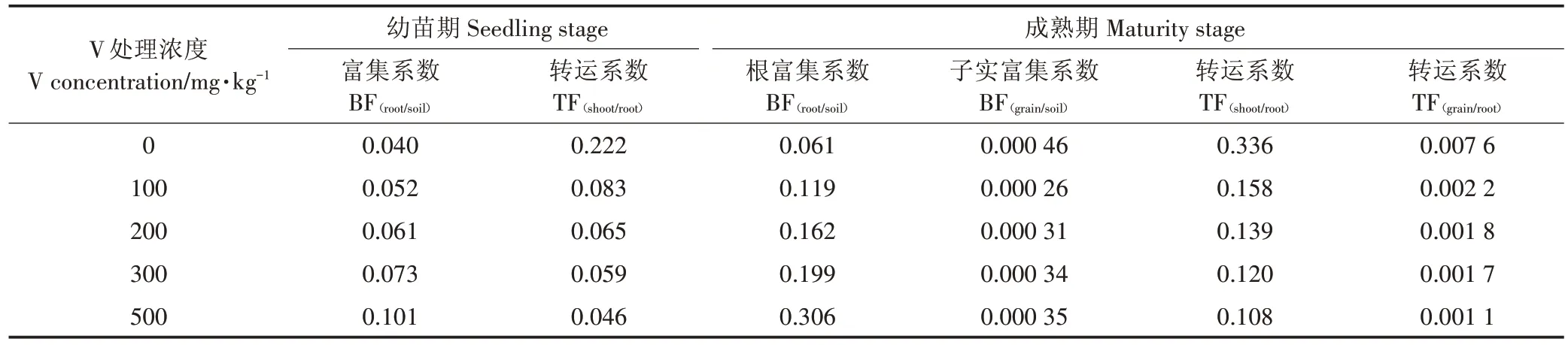
表4 玉米不同生长期V 的生物富集系数和转运系数Table 4 Bioconcentration factor(BF)and translocation factor(TF)of V in different growth periods of maize(Zea mays L.)plant
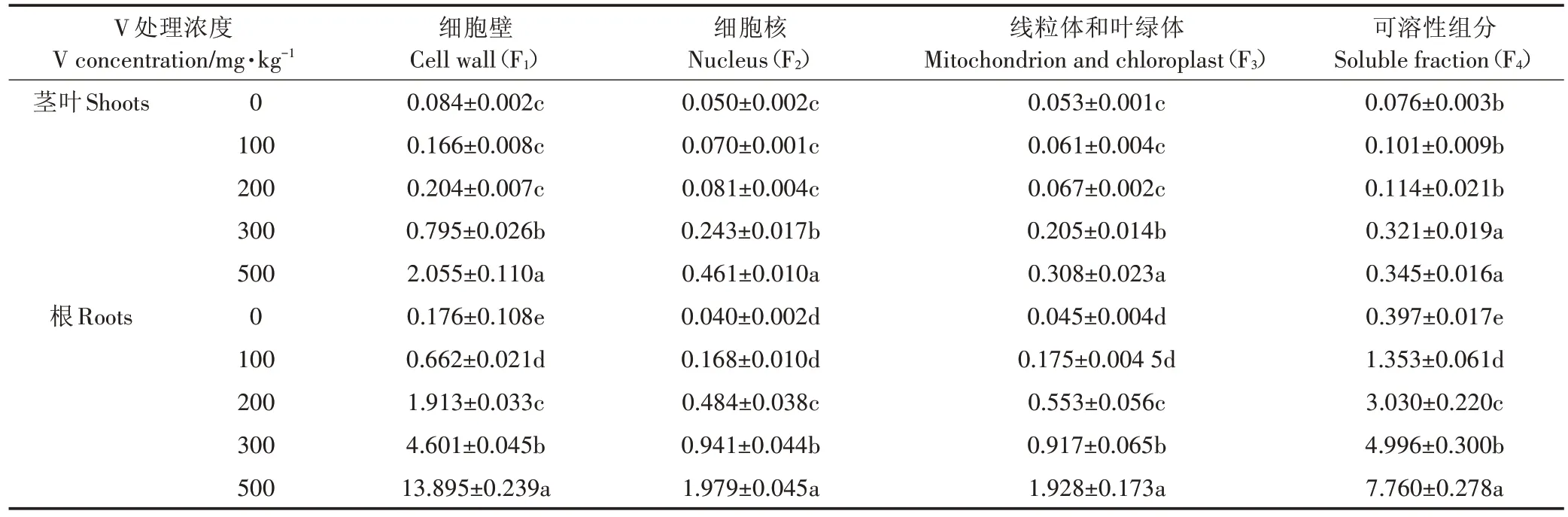
表5 玉米幼苗茎叶和根亚细胞组分中的V含量(mg·kg-1 鲜质量)Table 5 V content in the subcellular fractions in shoots and roots of maize(Zea mays L.)seedlings under V stress(mg·kg-1 FW)
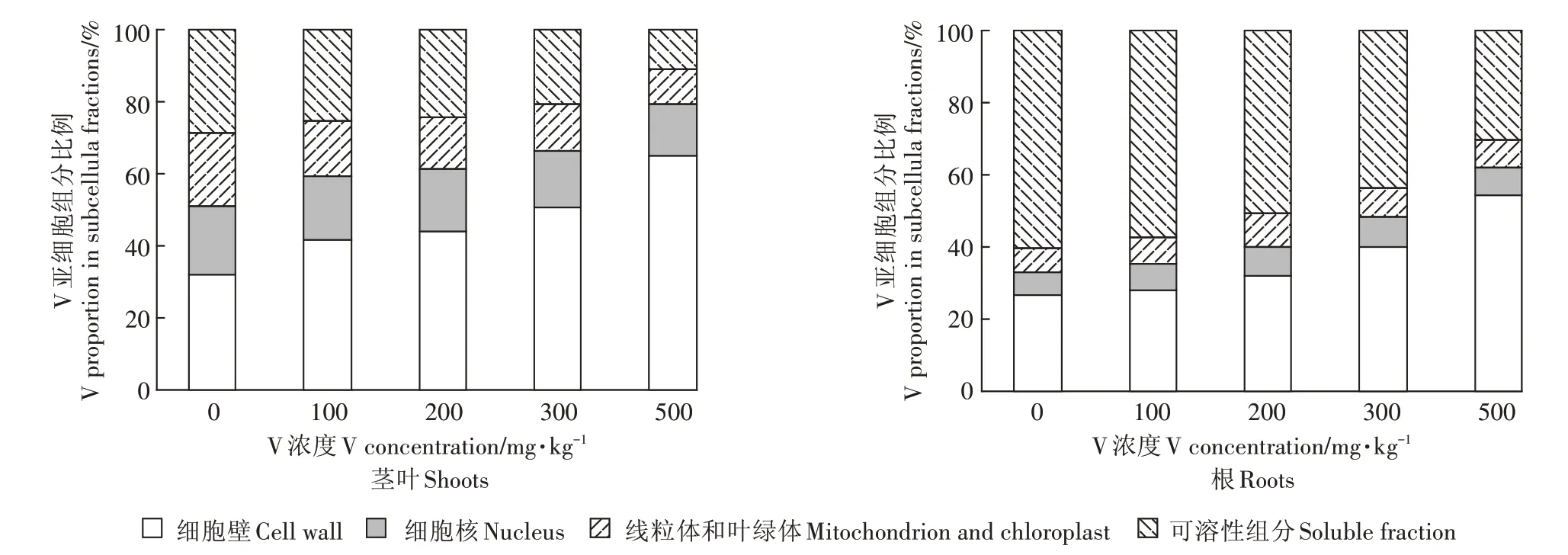
图2 玉米幼苗中V的亚细胞组分分配比例Figure 2 Percentages of subcellular fractions of V in maize(Zea mays L.)seedlings
从图3(B)中可以看出,随着V 胁迫浓度增大,玉米幼苗茎叶和根中谷胱甘肽(GSH)含量逐渐降低,在V浓度为 100 mg·kg-1和 500 mg·kg-1,与对照相比较,茎叶中GSH 含量下降了16.7%和82.6%,根中GSH 含量下降了13.1%和38.3%,茎和根的平均降幅分别为45.9%和23.6%。不同V浓度处理下,玉米幼苗各部分GSH 含量差异达显著性水平(P<0.05)。与NPT 不同,根部GSH含量高于地上部。
同NPT 相似,随着V 胁迫浓度增加,植物螯合肽(PCs)含量呈先增加后降低的变化趋势(图3C),V 胁迫使得PCs 主要积累在玉米的茎叶部。在V浓度为300 mg·kg-1,茎叶和根中PCs含量达最大值1.88 μmol·g-1和0.54 μmol·g-1,相比于对照增加207.9% 和600.2%,可见,根系PCs 含量的增幅远大于茎叶(P<0.05)。当 V浓度大于 300 mg·kg-1,PCs 含量下降,但仍远高于对照。茎叶中PCs 含量远高于根中PCs 含量,各V 处理下玉米茎叶和根中PCs 含量存在显著性差异(P<0.05)。
3 讨论
植物生物量一定程度上反映植物的生长活力,常作为敏感植物对逆境的响应参数并用于测量植物对金属胁迫的耐性。和Tian 等[16]研究的V 对大白菜生长的影响结果相似,在玉米幼苗期,植物生命力旺盛,适量外源V激发了自身的防御系统,并刺激了新陈代谢机能,促进了作物生长,所以,在一定范围内随着V胁迫浓度增大,玉米植株各器官生物量增加。这种影响也可能是土壤施加外源V时,由于加入的钒酸铵的量增加,土壤中有效氮含量升高,而苗期土壤钒的生物有效性较低,因此随着土壤V浓度增加,玉米植株各器官生物量增加。当玉米植株发育到了成熟期,子实迅速生成,成为光合产物的运输和转移中心,干质量不再增加(表3)。此时,植物积累V 含量超过自身的防御能力,会伤害植物细胞结构,破坏其生理代谢功能,所以,V 胁迫明显抑制植株生长发育,植物叶片出现卷缩和发黄,生物量显著下降,这与先前Imtiaz等[13]研究V 使鹰嘴豆生物量明显下降相同。表明在逆境下,重金属胁迫激活了植物代谢系统,加速了自身对重金属的吸收,反过来又抑制了植物的代谢活动,对植物产生毒害作用[24]。
玉米植物中V 的分布(表3、图1)表明,玉米不同器官对V 的积累能力不同。随着V 胁迫浓度增加,植物根系对V 的吸收显著增加,使得V 在植物体内的分布规律表现为,在新陈代谢旺盛的器官(如根部)蓄积量较大,而在营养储存器官(如茎部、叶片)蓄积量则较少,这与Yang 等[15]和 Qian 等[25]研究结果一致。玉米根中V 含量较高,可能与V 进入玉米作物根皮层细胞后,与细胞中的蛋白质、多糖类和核酸等结合形成稳定的大分子螯合物或不稳定性有机大分子而沉积有关,根已被证明是一个屏障,限制了金属从根运输到茎叶,从而减少了V 对玉米茎叶的伤害[14]。随着V胁迫浓度升高,富集系数BF 值增加,转运系数TF(shoot/root)和 TF(grain/root)值明显下降,BF 和 TF 值均小于0.5,可见玉米植株对V 的富集能力较低,且有较强的阻止V 从根系向地上部转运的能力,缓解了V 对植物的毒害。玉米将V 从根部转运到子实中的能力极低[TF(grain/root)<0.01],说明玉米根系对 V 的固持可以降低V 通过食物链对人体造成的危害。事实证明,根中V含量高于其他组织中的V 含量是玉米的重要耐受机制。与非耐性植物相比,耐金属植物的根中总是积累较高浓度的有毒金属,而茎叶中则较低[26],所以玉米是V的耐性植物。

图3 V对玉米幼苗茎叶和根中NPT、GSH和PCs含量的影响Figure 3 Effect of V on the concentrations of the NPT,GSH and PCs in shoots and roots of maize(Zea mays L.)seedlings
金属在植物组织中的选择性分布,对于植物是否受到有毒金属损伤具有重要的意义。玉米幼苗茎叶和根中V 大多数积累在细胞壁,其次是可溶性组分,两者占总V 的65%(茎叶)和85%(根)以上,表明细胞壁(F1)和可溶性组分(F4)是主要的V 积累位点,它们对玉米作物的耐受性起重要作用。这与关于Cd在生菜和萝卜中亚细胞分布报道一致[27-28]。在亚细胞水平上,细胞壁沉积和液泡区域化被认为是最重要的两种重金属解毒机制[26,29],V 在根和茎叶的细胞壁组分中比例较高(图2,F1比例高达50%以上),表明细胞壁是储存V 的重要部位,能束缚V 并限制跨膜转运,以维持植物细胞中正常生理活动。当细胞壁中结合位点达饱和后,V 将进入植物细胞和液泡中[30]。液泡中含有多种蛋白质、有机酸和有机碱。它们可以与V结合形成螯合物将V 限制在液泡中[31-32],从而降低过量V 对植物的影响。试验还发现,在高浓度V 胁迫下,植物细胞壁中V 比例显著增加,可溶性组分比例减少,两组分比例之和保持稳定(图2),这进一步说明,大部分V 可能与细胞壁结合或积聚在空泡中,使得细胞质的区隔化作用增强,可以有效抵御高浓度V进入细胞器组分。这既有利于满足植物体细胞对微量元素V 的需求,又减轻了过量V 对细胞器的伤害,从而保证维持植物细胞的正常生理代谢功能[6]。前述可知,V 在玉米幼苗根中积累的比例很高(图1,占V 总量的74.8%~95.6%),而根细胞中,以细胞壁(F1)和可溶性组分(F4)为主要组分的亚细胞分布保留了大部分V(图2,占根中V 总量的82.66%~87.02%),这就抵抗了V 从根向茎叶的转运,有助于减少V 对植物的伤害。所以,V 在玉米植物中的亚细胞分布规律体现了玉米幼苗对V的耐性反应。
巯基化合物在植物的金属耐受机制中起重要作用[26]。NPT 的合成是由细胞中的各种金属和准金属诱导的,主要通过螯合金属离子来实现防御金属毒性[33],玉米幼苗内不同部位NPT 含量反映植物对V 的耐受能力。Mahdavian 等[34]发现,Pb 暴露能诱导骆驼蓬的NPT显著增加。随着V胁迫浓度增加,玉米幼苗根和茎叶中NPT 含量增加,而茎叶中NPT 增加得更多,茎叶部NPT 含量显著高于根部,可见,V 显著促进玉米茎叶部非蛋白巯基化合物的合成,以修复和保护蛋白质的-SH 基团免受金属毒性而不被氧化,减轻重金属对植物的毒害。
GSH 作为植物中最重要的非蛋白巯基化合物和最丰富低分子量多肽,总是直接或间接地(作为酶和PCs 的底物)参与植物抗逆性,它是细胞中关键非酶抗氧化剂,能清除几种潜在的有毒ROS(例如·或·OH),并帮助细胞应对由氧化所引起的氧化应激[35]。在金属毒性情况下,有毒金属离子具有高度活性并且与生物分子-SH 基团具有高亲和力,细胞通过合成植物螯合素PCs,减少细胞质中游离金属离子浓度来保护基本生物分子(如蛋白质)的-SH 基团[26,36-37]。本研究中 ,在 V 暴露下玉米幼苗中 GSH 降低,而PCs 含量显著增加,植物消耗大量的GSH 来合成PCs 用于解毒,显然,GSH 在预防V 损伤中起重要作用。尽管由于GSH 合成的减少而更多形成了可与V 螯合的 PCs,但随着 V 胁迫浓度增加(>500 mg·kg-1),会使GSH 减少到足以对其他细胞过程产生有害影响,这将对植物存在潜在危害,最终表现为抑制生长。由于茎叶有比根更高的NPT 浓度以消耗GSH浓度,因此在玉米内部对V具有更高耐受性可归因于PCs对V的螯合能力增强。可见,在玉米植物的解毒机制中,在V胁迫下PCs似乎比GSH发挥更强的作用。
4 结论
(1)玉米植株根部积累V 含量显著高于茎叶部,大大降低了V由根部向茎叶和子实的转运,避免了过量V对植物的损伤。
(2)在外源V 的胁迫下,玉米体内V 在细胞壁沉积和液泡区室化作用,以及 NPT、GSH 和 PCs 对 V 的螯合,是重要的解毒机制。
(3)玉米植株能将吸收的V 隔离在植物根部,未表现出明显的中毒症状,玉米是V的耐性植物。
