基于PDANPs和T4PNK、λexo生物传感技术建立
2020-05-30涂海健赵成飞姜玉才俞柳敏黄亚雨
涂海健,赵成飞,姜玉才,林 堃,俞柳敏,黄亚雨
(1.莆田学院附属医院 检验科,福建 莆田 351100;2.莆田学院 药学与医学技术学院,福建 莆田 351100)
0 引言
聚多巴胺纳米粒子(polydopamine nanoparticles,PDANPs)是一种新型纳米材料[1-2],因具有独特的共轭体系,可与生物大分子尤其是单链DNA(ssDNA)分子通过π-π非共价作用力结合,并高效猝灭寡核苷酸上标记的荧光染料或荧光纳米粒子的荧光信号[3],这为构建基于PDANPs生物传感器奠定了基础[4]。
基因表达调控紊乱是细胞癌变的重要机制之一。MicroRNAs(miRNAs)是一类短链非编码小RNA,大量研究表明miRNA在基因表达调控机制中具有重要作用,它能与靶基因mRNA3'UTR相结合,从而抑制靶mRNAs转录、翻译或者剪切靶mRNA并促进其降解,在转录后水平调控靶基因参与细胞的增殖、分化、凋亡及细胞癌变等多种生理病理过程[5]。近年来发现miRNA-199在多种肿瘤的发生、发展、侵袭过程是一个重要调控因子[6],同时研究显示,在肝癌组织中miRNA-199普遍性低表达,并在肝癌的发生、发展过程中起重要作用[7]。因此,临床上可以通过检测miRNA-199的含量来对肝细胞癌进行早期诊断[8-9],然而,由于miRNA核苷酸片段短,丰度低和易降解等原因,给检测带来了一定的困难。本研究建立基于PDANPs/纳米材料和T4多聚核苷酸激酶(T4 polynucleotide kinase,T4 PNK)、λ核酸外切酶(Lambda exonuclease,λ exo)的新型纳米生物传感技术检测miRNA-199平台,旨在寻找一种快速、特异性强、灵敏度高的miRNA-199检测方法。
1 材料与方法
1.1 试剂与仪器
多巴胺盐酸盐、三磷酸腺苷二钠盐(adenosine 5′-triphosphate disodium salt hydrate,ATP)购于Alfa Aesar(阿法埃莎)中国有限公司;异丙醇购于国药集团化学试剂有限公司,试剂均为分析纯。T4 PNK、TaqmanTM MicroRNA Reverse Transcription kit、TaqmanTM MicroRNA Assays购于赛默飞世尔科技有限公司;50 nM stem-loop RT primer购于美国应用生物系统公司;λexo购于New England Biolabs公司;20 mM Tris-HCl缓冲液的配制(pH 7.4,含140 mM NaCl、5 mMKCl、1mM MgCl2和1mM CaCl2)。高分辨场发射扫描电镜(SEM)购于MultiGas美国MKS公司;FTIR-650红外光谱仪天津港东科技发展有限公司生产;F4600型荧光分光光度计为日本HITACHI公司生产;MTH-100恒温混匀仪产于杭州米欧仪器有限公司。
本实验中的DNA由上海生工生物工程技术股份有限公司合成:
P1(miRNA-199):5’-TATCATCAGACGTGTAACCAAT-FAM
P1(5’-FAM):FAM-TATCATCAGACGTGTAACCAAT
P2:ACAGTAGTCTGCACATTGGTTA
1.2 PDANPs的合成与表征分析
取100mg多巴胺盐酸盐加入40mL的异丙醇和100mL Tris-HCl溶液中,避光用搅拌器缓慢搅拌72 h,直至溶液从无色变成棕色到最后变成黑色胶体状,离心取黑色胶体状物。用水洗黑色胶体状物3次,后置冷冻干燥箱中干燥,即得到黑色固体物质PDANPs[10-11]。取制作的PDANPs分别用高分辨场发射扫描电镜和FTIR-650红外光谱分析仪进行形貌大小、特征、官能团测定。
1.3 dsDNA-FAM制备
分别取P1(5’-FAM)和P2溶解于Tris-HCl缓冲液(70 mM Tris-HCl,10 mM MgCl2,5 mM DTT,pH 8.0)。然后分别在95℃下变性10min,冷却至室温,在37℃杂交2h,得到dsDNA-FAM(100 nM)。
1.4 荧光猝灭试验
取15μL 100 nM dsDNA-FAM,2μL 0.5 mM ATP,1μL(10u/μL)T4 PNK,2μLTris-HCl缓冲液,37℃温育35min后加入含5μL 0.15 mg/mLPDANPs的250μL Tris-HCl缓冲液体系中,在激发波长480 nm下,加入5μLλexo,用荧光分光光度计每隔3s记录波长520nm处的荧光强度。
1.5 PDANPs对单链DNA的猝灭效率及最佳浓度
在激发波长480 nm下,各取相同量的P1(5’-FAM)(100 nM)和dsDNA-FAM分别加入浓度为0.00、0.05、0.10、0.15、0.20、0.25 mg/mL的PDANPs,用荧光分光光度计记录波长520 nm处的荧光强度,PDA对单链DNA的最高猝灭效率及最佳浓度。
1.6 构建基于PDANPs检测miRNA-199传感器
构建基于PDANPs检测miRNA-199传感器的反应体系为取5μL 0.15 mg/mL的PDANPs加入250μL Tris-HCl缓冲体系中,加入15μL 100 nM dsDNA-3’FAM即P1(miRNA-199),15μL待测标本,反应10min后再加入2μL 0.5 mM ATP,1μL 10u/μL T4 PNK及5μLλexo在37℃孵化35min后,在激发波长480 nm下,用荧光分光光度计记录波长520 nm处体系的荧光强度。
1.6.1 ATP浓度对荧光强度的影响
上述实验中ATP浓度分别取0.00、0.50、1.00、2.00、4.00、6.00、8.00、10.0 nM,其他条件不变,观察ATP浓度对实验的影响,在激发波长480 nm下,用荧光分光光度计记录波长520 nm处的荧光强度变化。
1.6.2 反应时间的选择
观察反应体系中荧光强度与反应时间的关系,在不同反应时间段用荧光分光光度计检测波长520 nm处反应体系中的荧光强度变化。
1.6.3 传感器的线性范围、检测限及精密度
取5μL 0.15 mg/mL PDANPs和18μL P1(miRNA-199)(300 nM)加入250μL Tris-HCl缓冲液中,各2μL 0.5 nM ATP和T4 PNK,20Uλ exo和15μL不同浓度miRNA-199在37℃孵化35min后,10min后加,在激发波长480 nm,测定波长520 nm处的荧光光谱数据,平行测定3次。依据EP15-A2对57 nmol/mL浓度miRNA-199每天进行3次检测,连续测5天,并计算CV值。
1.6.4 与荧光定量PCR方法比对
取不同浓度miRNA-199分别采用ABI公司的Taqman探针法及针对miRNA-199设计的特定茎环引物,用外参(cel-mir-39-3p,ID000200)定量法(具体反应体系见表1)和基于PDA NPs、T4 PNK、λexo新型纳米生物传感技术分别进行检测,两种检测结果进行比对分析。

表1 采用茎环引物荧光定量PCR方法检测miRNA-199反应体系
1.7 统计学方法
本研究采用SPSS22.0软件和Excel软件分别进行线性回归分析和散点图显示。
2 结果
2.1 PDANPs的表征图
由多巴胺盐酸盐聚合形成PDANPs后,红外光谱分析仪检测结果如图1所示,图1中a线和b线分别是PDANPs和多巴胺盐酸盐的红外表征图。可见多巴胺盐酸聚合成PDANPs后红外光的透过率(T)由弱变强,同时1 342 cm-1、1 176 cm-1特征峰消失,出现3 000~3 400 cm-1、1 620 cm-1等特征峰。经扫描电镜表征图分析如图2所示,合成的PDANPs大小较为均匀,直径在300.0±31.7 nm范围内。

图1 PDANPs和多巴胺盐酸盐的红外光谱表征图

图2 PDANPs电镜扫描图
2.2 PDANPs荧光猝灭实验及最佳浓度
在含有dsDNA-FAM、T4 PNK、ATP及0.15 mg/mL的PDANPs混合液体系中,加入λexo时,体系中的荧光强度发生明显的改变见图3(a)中的曲线Ⅰ和Ⅱ,不同浓度0.00、0.05、0.10、0.15、0.20、0.25 mg/mL的PDANPs对ssDNA(P1(5’-FAM))和dsDNA-FAM猝灭结果显示:当PDANPs的浓度为0.15 mg/mL时,对ssDNA猝灭效率最高达到93%,且双链DNA的荧光强度仍然保持较高水平,如图3(b)。

图3 PDANPs荧光猝灭实验结果
2.3 构建基于PDANPs检测miRNA-199传感器原理
依据PDANPs对单链DNA有很好吸附性,并高效猝灭DNA上标记的FAM荧光信号的机理见图4中的A,建立PDANPs和T4 PNK、λexo新型传感器实验原理:首先,设计与靶标miRNA-199序列完全互补的FAM荧光标记的单链DNA探针(ssDNA-FAM);ssDNA-FAM通过ππ堆积效应吸附在PDA NPs表面,导致其荧光信号被PDANPs猝灭;当体系中存在miRNA-199和T4 PNK、λexo时,与miRNA-199杂交形成ssDNA-FAM/miRNA-199双螺旋结构,从PDANPs表面解离,其荧光信号得到恢复;当有T4 PNK存在时,λexo选择性地将该双链结构中ssDNA-FAM水解为碎片,该过程中λexo不会降解双螺旋结构中的miRNA-199从而使其被释放出来,可再次与ssDNA-FAM进行杂交,此循环反复最终体系的荧光信号得到显著放大,实现了恒温条件下miRNA-199的灵敏检测,图4中的B。

图4 基于PDANPs检测miRNA-199的实验原理示意图
2.4 传感器的ATP浓度及反应时间优化
传感器反应体系中的荧光强度随着反应时间的延长逐渐升高如图5(a)所示,当反应时间达35min时体系荧光强度随着时间的延长趋于稳定,所以选择35min为最适反应时间。传感器反应体系中加入ATP的浓度增加,荧光强度由弱变强见图5(b),当浓度为5 nM时,荧光强度变化量最大,故选择5nM的ATP为最适反应浓度。
2.5 传感器的线性范围、检测限及精密度
传感器在不同浓度miRNA-199下的FAM荧光光谱图,如图6(a)所示,在一定范围内,波长520 nm处FAM的荧光强度随miRNA-199浓度增加而升高,当miRNA-199浓度在10 pmol/mL~100 nmol/mL之间时,miRNA-199浓度对数与荧光强度有良好的线性关系图6(b),线性方程为F=65.183 lg C+157.3,其中,F为荧光强度,C为miRNA-199浓度,相关系数R2=0.973,传感器的检测限6.42 pmol/mL(S/N=3),精密度CV值为19.56%。

图5 ATP浓度反应时间及浓度与荧光强度的关系
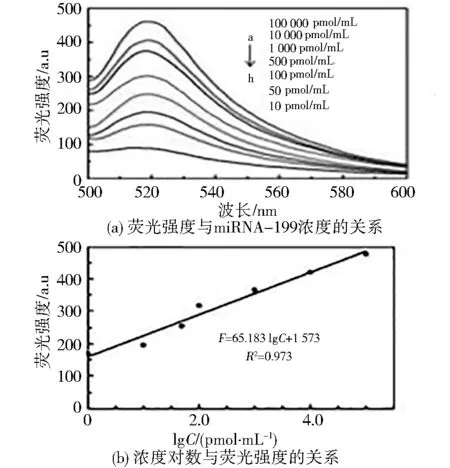
图6 不同浓度miRNA-199下的FAM荧光光谱图
2.6 与荧光定量PCR方法比对
新型纳米生物传感技术与荧光定量PCR对不同浓度miRNA-199检测,结果差异值见图7(a),其差值平均值(偏倚)为-2.18 pmol/mL。两种方法检测结果回归分析成线性关系(图7(b)),相关系数R2=0.9965。

图7 新型纳米生物传感技术与荧光定量PCR方法比对
3 讨论
纳米材料因其体积小、比表面积大,具有独特物理与化学性质及良好的生物相容性等特征[12]在检测分析中得到广泛的应用[13]。miRNA是一类长度为18~25核苷酸的单链非编码小分子RNA,它主要通过与靶标基因3′UTR相互作用参与调节细胞重要活动[14]。因成熟miRNA分子片段短,导致传统的引物设计难以进行实时荧光定量聚合酶链反应,且不同miRNA间序列相似性高、丰度低,为精确检测miRNA提出挑战。
本研究依据PDANPs对单链DNA具有强的吸附作用,并能高效猝灭DNA上标记的FAM荧光信号,同时利用T4 PNK催化单链或双链DNA的5'磷酸基团和ATP的γ位磷酸基团之间的交换反应,即5'磷酸化[15],λexo能特异性地水解双链DNA磷酸化的5′端,而对单链DNA和未磷酸化的双链DNA没有作用[16],建立了基于PDANPs和T4 PNK、λexo的新型传感技术平台用于miRNA-199检测。首先对人工制备的PDANPs进行表征分析,发现由多巴胺盐酸盐聚合形成PDANPs过程中,CH2弯曲振动,C—C的伸缩振动产生的特征峰消失,出现氢键O—H、
总之,本研究首次建立了基于PDANPs和T4 PNK、λexo的新型纳米生物传感技术检测miRNA-199平台,检测的结果准确可靠,且具有较好的线性范围和检测敏感度,表明该技术在miRNA检测领域具有广阔的应用前景。
致谢:感谢福州大学邱彬教授及团队帮助合成检测纳米材料并给予指导。
