牛病毒性腹泻病毒E2蛋白的克隆、表达及多克隆抗体制备
2020-05-29陈文龙张阳阳张生英邢小勇胡永浩
陈文龙, 张阳阳, 张生英, 邢小勇, 胡永浩
(甘肃农业大学 动物医学院, 兰州 730070)
牛病毒性腹泻是由牛病毒性腹泻/黏膜病毒(Bovineviraldiarrheavirus/mucosalvirus, BVDV/MDV)导致的一种以急性黏膜病、持续性感染及免疫抑制为主要特征的病毒性传染病, 临床症状以高热、出血性腹泻及血小板减少症为主[1].BVDV病毒严重影响母牛生殖、产奶及与牛源相关的生物制品, 如血清、抗体、冻精和疫苗等[2], 使畜牧地区经济损失严重[3].文献[4]发现首例BVDV病毒(Changchun 184株), 任敏[5]首次发现BVDV-2型毒株.2017年我国BVDV阳性率为46.7%, 持续性感染率为2.2%[6].目前以疫苗免疫为主防控该病[7], E2可诱导机体同时产生细胞免疫和体液免疫[8], 是制备BVDV DNA疫苗和亚单位疫苗的首选抗原.
当病毒感染或接种灭活苗时, 动物机体主要产生抗E2抗体[9], 在免疫应答过程中具有重要作用[10]; 针对E2蛋白制备的多克隆抗体可结合多个病毒抗原决定簇, 与更多的BVDV毒株发生反应, 用于检测生物制品[11].E2蛋白又称为gP53, 位于阅读框2077-3198 nt, 编码374个氨基酸, 分子量为53 000, 属于囊膜蛋白[12]; E2是BVDV 4个结构蛋白(C,E0,E1,E2)中免疫原性最好的结构蛋白, 具有中和表位, 可诱导机体产生中和抗体以保护机体免受病毒感染[13]; E2有5个糖基化位点和一个疏水性序列, 是BVDV的疏水结合位点及跨膜结构域, E2靠近N端部分含有多种构象依赖性抗原结构域, 其N端伸出囊膜表面, 是决定BVDV抗原性的主要部位[14].但E2基因突变概率极高, 其可变区占BVDV基因组可变区的1/3, 导致不同毒株间的免疫原差异较大, 使疫苗免疫失败[15].E2蛋白是维持病毒周期的重要因子, 主要参与病毒的免疫逃逸, 并参与病毒与宿主细胞的识别、吸附及结合过程[16]; 重组E2蛋白可阻止BVDV感染体外培养的细胞[17].高欲燃等[18]利用原核表达系统表达E2蛋白; 吴立君[19]利用昆虫系表达E2蛋白; 范晴等[20]利用杆状病毒系统表达E2蛋白; Grigera等[21]利用黑腹果蝇表达E2蛋白; Bolin等[22]利用昆虫系统表达E2重组蛋白并对牛进行免疫, 证明了E2重组蛋白可保护机体免受同源毒株的感染.
在怀孕母牛妊娠期120 d内, 胎儿感染BVDV形成免疫耐受状态, 可进一步发展为持续感染牛(persistent infection, PI), 这种PI牛不易死亡, 可终生持续性向畜群排毒, 是牛群最主要的传染源[23], 目前检测PI牛难度较大.酶联免疫吸附测定(ELISA)法是诊断BVDV最简便、快捷的方法, 本文通过原核表达方法得到活性良好的E2蛋白抗原, 制备高效价的鼠源多克隆抗体, 其反应性和特异性良好, 为ELISA检测方法提供抗原和抗体, 为检测BVDV PI动物及研究E2功能得出一种新思路.
1 材料与方法
1.1 材 料
1.1.1 实验动物 Balb/c小鼠(雌性, 42 d)购于中国科学院兰州兽医研究所.
1.1.2 载体和菌株 BVDV C24V标准毒株购于兰州民海生物公司; MDBK(madin-darby bovine kidney)细胞由甘肃农业大学动物医学院传染病学实验室保存; PEASY-Blunt Cloning Vector和pET-30a(+)表达载体均购于南京诺唯赞公司; 大肠杆菌E.coliDH5α和BL21(DE3)感受态细胞均购于北京全式金公司.
1.1.3 主要试剂 高糖DMEM基础培养液、胎牛血清和胰蛋白酶均购于北京元亨圣马公司; TRIzol@Reagent购于上海生工生物工程公司; AMV反转录酶、RNase Inhibitor、EcoRⅠ、XhoⅠ和T4DNA Ligase均购于山东宝生物工程公司; BCA蛋白浓度测定试剂盒和BeyoECL Star化学发光试剂盒均购于南京碧云天公司; 氟氏完全佐剂和不完全佐剂均购于美国Sigma试剂公司; Goat Anti-mouse IgG(HRP标记)和FITC标记山羊抗小鼠(H+L)均购于北京博奥森公司.
1.1.4 主要实验仪器 8000WJ型CO2细胞培养箱(美国Thermo公司), nexus GSX1型PCR仪(德国Eppendorf公司), HH·B11-BS-Ⅱ型电热恒温培养箱和THZ-82N型恒温震荡培养箱(上海跃进医疗器械有限公司), Biorad Powerpac Bacsic164-5050型电泳仪、电泳槽和Trans-Blot SD型半干式转印仪(美国Bio-rad公司), DFM-60C型倒置荧光显微镜(德国ZEISS公司).
1.2 方 法
1.2.1 病毒RNA提取和鉴定 取病毒感染状态良好的MDBK细胞, 待细胞病变稳定, 收集病毒, 浓缩, 用0.22 μm滤器过滤备用.按TRIzol试剂说明提取RNA, 并将其反转录为cDNA, -20 ℃保存备用.参考NCBI BVDV 5’UTR(GenBank: MF347401.1)序列设计保守序列引物; 参考文献[11]获得BVDV-Ⅰ鉴别引物B3B4; 使用两种引物通过多聚酶链式反应(PCR)技术鉴定病毒.
1.2.2E2全长基因扩增 参考NCBI BVDV-Ⅰ V074株(GenBank: KX170165.1)设计E2基因全长引物, 由南京金唯智公司合成.通过PCR技术扩增目的基因,E2反应条件: 98 ℃, 5 min; 98 ℃, 45 s; 48 ℃, 1 min; 72 ℃, 80 s; 72 ℃, 10 min, 循环数为35; 扩增产物经质量分数为1.5%凝胶验证后回收, 基因片段连接PEASY-Blunt Cloning Vector, 转化DH5α, 阳性克隆菌由南京金唯智公司测序.
1.2.3E2原核表达载体构建 将测序正确的E2全长基因序列进行生物信息学分析, 选取抗原位点集中的区域.设计截短引物, 利用PCR技术扩增截短片段, 反应条件为: 95 ℃, 6 min; 95 ℃, 50 s; 62.1 ℃, 50 s; 72 ℃, 80 s; 72 ℃, 10 min, 循环数为35; 扩增产物经质量分数为1.5%凝胶验证后回收;EcoRⅠ,XhoⅠ双酶切后连接pET-30a(+)载体, 产物转化DH5α并进行菌液PCR及双酶切验证; 阳性克隆菌测序后, 提取质粒, 转化BL21.
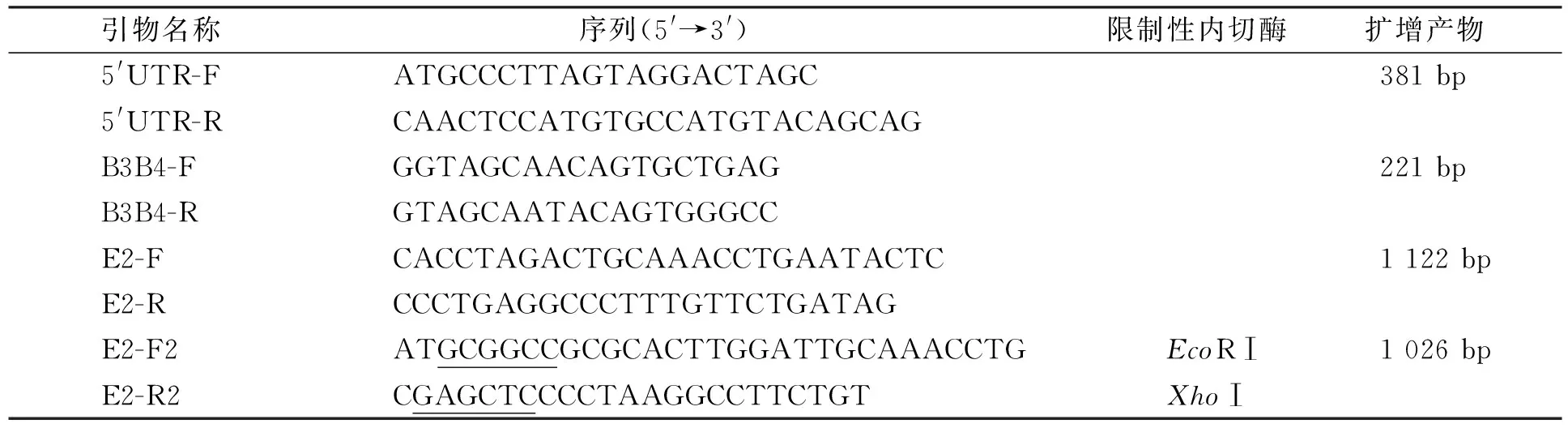
表1 引物信息
1.2.4 原核表达 挑取重组E2菌落和pET-30a(+)载体菌落分别接种于培养基中培养, 用分光光度计测定A600=0.6时, 加入1 mol/mL异丙基-β-D-硫代吡喃半乳糖苷(IPTG)诱导重组菌表达蛋白; 超声波破碎, 分离上清液和沉淀, 制备蛋白样品, 经质量分数为10%的SDS-PAGE电泳验证蛋白表达结果; 优化表达条件, 提升蛋白表达量; 先用2-YT培养基按相同条件大量培养菌体, 再纯化和复性蛋白, 并测定含量.
1.2.5 多克隆抗体制备 以重组E2蛋白为免疫原, 选取健康Balb/c小鼠3只, 首次免疫用100 μg/只的重组蛋白和等体积弗式完全佐剂, 背部多点注射免疫小鼠; 首次免疫14 d后, 每隔7 d, 按50 μg/只的重组蛋白和等体积弗式不完全佐剂免疫小鼠, 共免疫4次.重组蛋白为抗原, 间接ELISA测定小鼠血清多克隆抗体效价; 若抗体效价高于1∶20 000, 则处死小鼠, 大量收集抗体.
1.2.6 多克隆抗体鉴定 效价测定: 蛋白定量, 以每孔5 μg重组蛋白混合碳酸盐缓冲液包被酶标板, 经包被、封闭、洗涤后酶标板于-20 ℃保存备用.小鼠尾静脉采血并分离血清; 实验设置空白和阴性对照, 将多抗血清以1∶200稀释, 依次加入蛋白酶标板中, 37 ℃孵育2 h, 磷酸盐吐温缓冲溶液(PBST)洗涤; 加入1∶3 000的稀释辣根过氧化酶(HRP)标记的羊抗鼠二抗, 37 ℃孵育2 h, PBST洗涤; 加入3,3′,5,5′-四甲基联苯胺(TMB)酶-底物显色液于37 ℃作用15 min; H2SO4终止反应, 酶标仪于450 nm波长下测定结果.多克隆抗体效价测定设置3个平行组, 以未免疫小鼠血清为阴性血清, 判定标准:S/N=实组A值/阴性组A值,S/N>2.1为阳性.
免疫印迹(Western blot, WB)实验: 将纯化后的蛋白、病毒制样经质量分数为10% SDS-PAGE电泳分离, 通过半干式电转膜法将蛋白及病毒抗原转至硝酸纤维素薄膜上, 加入质量分数为5%脱脂奶粉于4 ℃封闭12 h后, 用PBST洗涤; 用1∶1 000稀释的多抗血清于37 ℃孵育2 h, PBST洗涤; 用1∶500稀释HRP标记的羊抗鼠二抗孵育2 h, PBST洗涤; 进行化学发光显色反应.
免疫荧光(IFA)实验: 设置无病变细胞组、细胞病变组、阴性对照组、阳性对照组和实验组; 用六孔板(内置无菌载玻片)培养MDBK细胞, 当细胞生长密度适中时接种病毒, 当细胞产生大量病变且尚未脱落时, 磷酸盐缓冲液(PBS)洗涤; 用多聚甲醛于37 ℃固定10 min, PBS洗涤, 用质量分数为5%的脱脂奶粉于37 ℃封闭1 h, PBST洗涤; 腹水抗体1∶800稀释, 37 ℃孵育2 h, PBST洗涤; 用1∶500 稀释HRP标记的羊抗鼠二抗于37 ℃避光孵育2 h, PBST避光充分洗涤; 爬片置于滴有抗荧光淬灭剂的载物片上, 用荧光显微镜观察和拍照.
2 结果与讨论
2.1 BVDV增殖
对照组细胞与感染病毒MDBK细胞的荧光显微照片如图1所示.由图1(B)可见, 感染病毒的MDBK细胞出现脱落和圆缩等病变, 符合预期结果, 可用于提取病毒RNA.

图1 对照组细胞(A)和感染病毒细胞(B)的荧光显微照片Fig.1 Fluorescence micrographs of control cells (A) and infected virus cells (B)
2.2 病毒RNA验证结果
用RT-PCR验证BVDV的结果如图2所示.由图2可见: 第一泳道BVDV鉴别引物PCR扩增大小为221 bp, 与预期结果相符; 第二泳道5′UTR保守序列引物PCR扩增大小为381 bp, 与预期结果相符, 即病毒鉴定为BVDV-Ⅰ型, 提取的RNA可用于克隆E2基因.
2.3 E2全长基因PCR扩增及鉴定
以cDNA为模板, 用PCR技术扩增得到大小为1 122 bp基因片段, 如图3所示.由图3可见, 所得结果与预期结果一致.连接克隆载体, 菌液经PCR验证正确后测序.E2全长基因测序结果如图4所示.由图4可见, 扩增片段为BVDV-Ⅰ型E2序列, 同源性99%, 表明已扩增出E2全长基因.
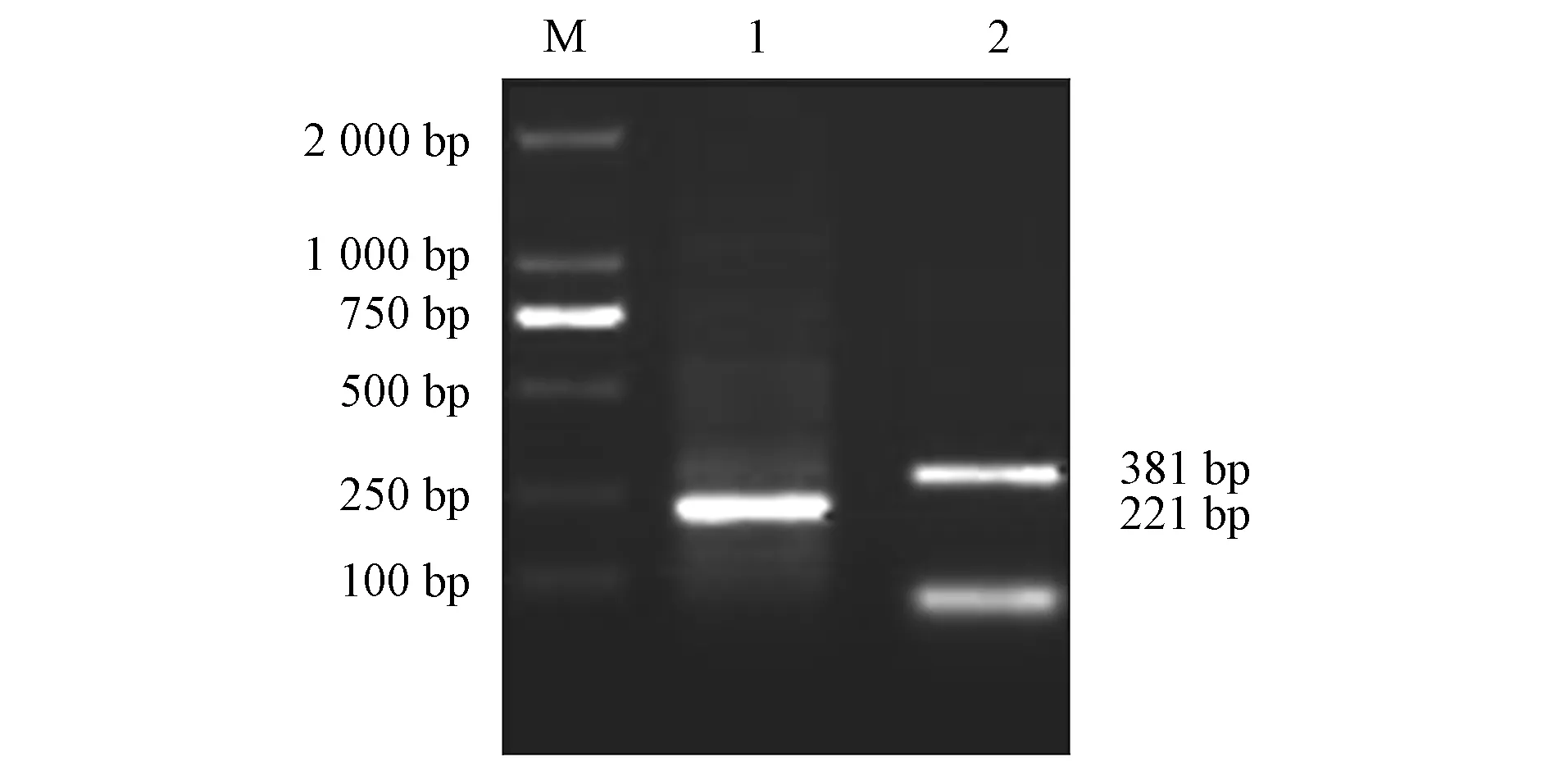
M: DNA标准DL 2 000; 1: 鉴别引物扩增产物;2: 保守序列引物扩增产物.图2 BVDV的RT-PCR鉴定结果Fig.2 RT-PCR identification results of BVDV
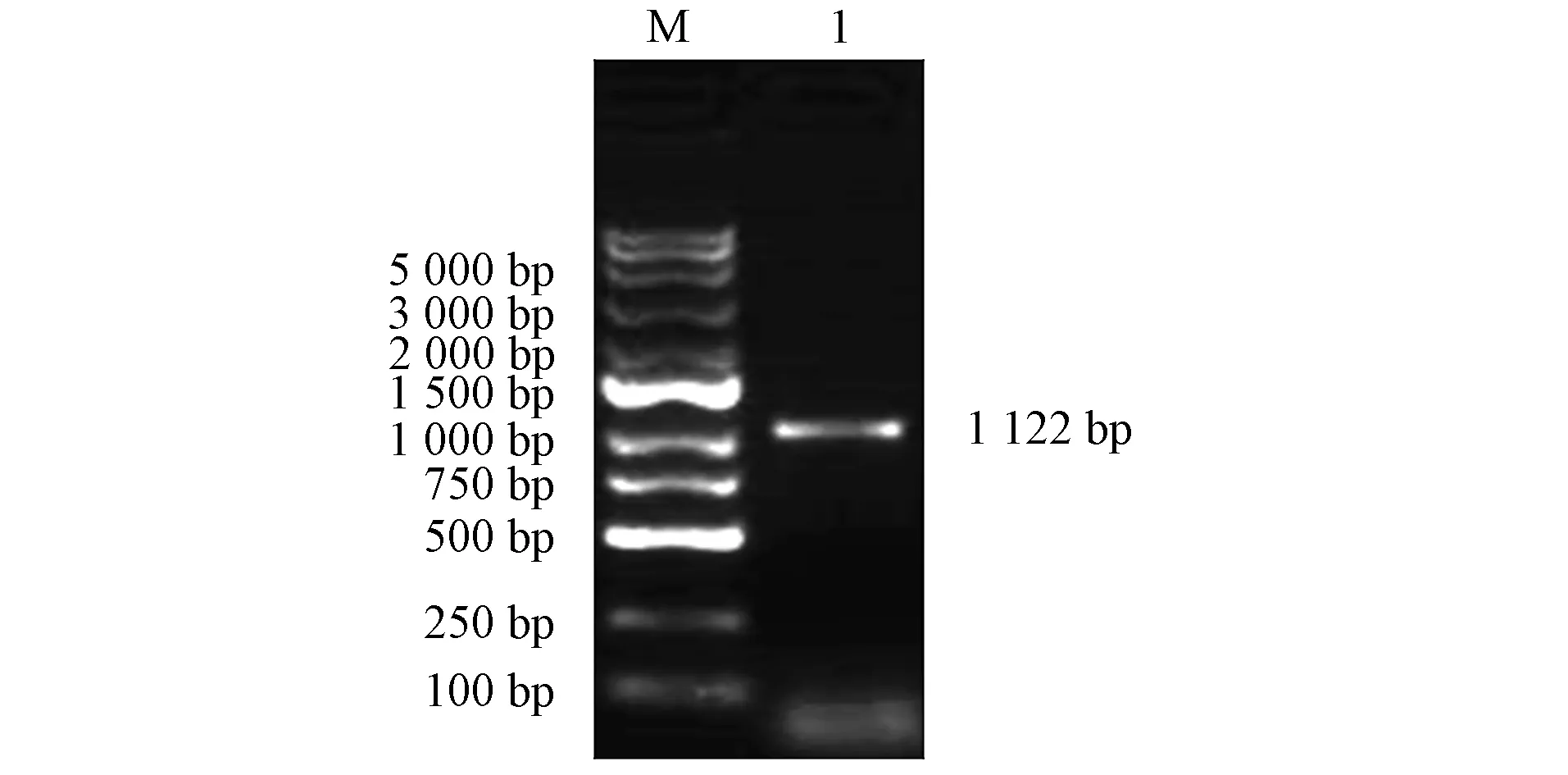
M: DNA标准DL 10 000; 1: 全长基因扩增产物.图3 PCR反应扩增E2全长基因结果Fig.3 Results of amplification of E2 full-length gene by PCR reaction
2.4 pET-30a-E2重组质粒的构建与鉴定
以E2全长基因为模板, 用截短引物通过PCR技术扩增得到大小为1 026 bp基因片段, 如图5所示.由图5可见, 所得结果与预期结果一致.将其与pET-30连接后, 双酶切鉴定结果如图6所示.由图6可见, 2条带的大小分别为5 423 bp和1 026 bp, 符合预期结果, 即成功构建了pET-30a-E2原核表达载体.

图4 E2全长基因测序结果Fig.4 Sequencing results of E2 full-length gene
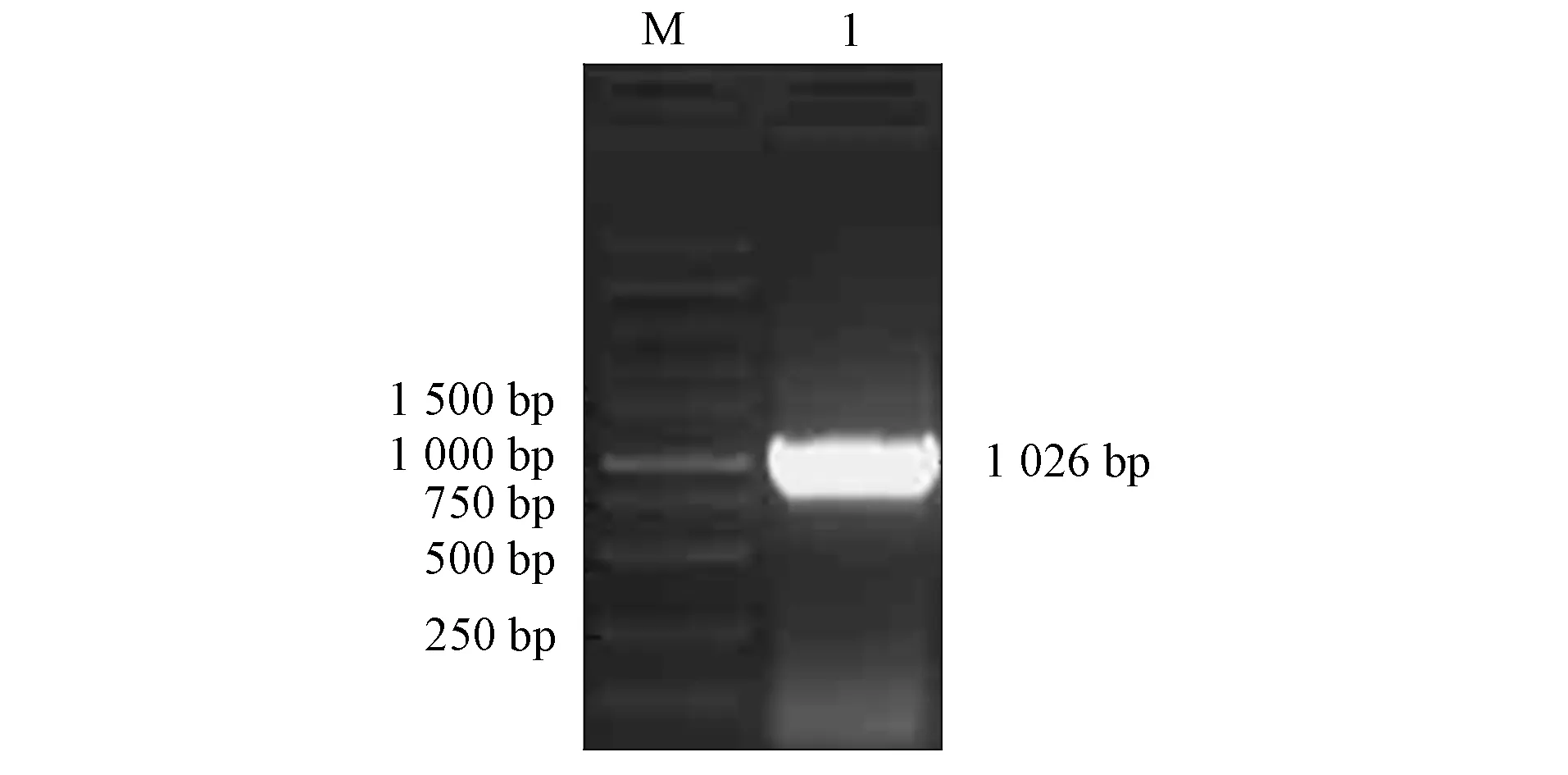
M: DNA标准DL 10 000; 1: E2截短基因扩增产物.图5 PCR反应扩增截短基因Fig.5 Amplification of truncated genes by PCR reaction
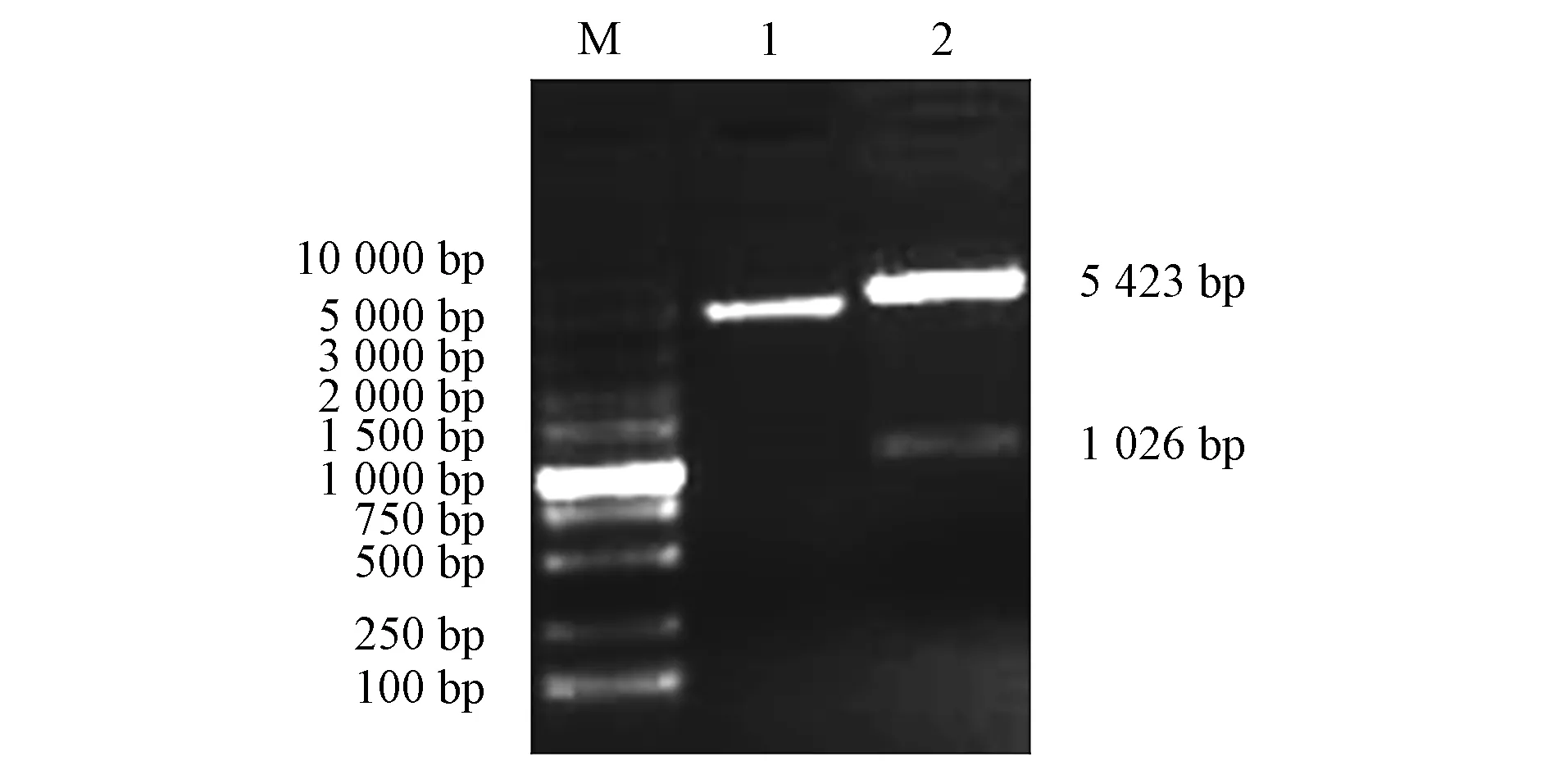
M: DNA标准DL 10 000; 1: 重组质粒; 2: 双酶切产物.图6 pET-30a-E2重组质粒双酶切鉴定结果Fig.6 Identification results of pET-30a-E2 recombinant plasmid by double enzyme digestion
2.5 原核表达产物
重组蛋白经质量分数为10%的SDS-PAGE电泳结果如图7所示.由图7可见: 第一孔的空质粒组在特定大小处没有条带; 第二孔全菌表达的蛋白大小为32 000; 第三孔超声波破碎后菌体沉淀蛋白大小为32 000; 第四孔纯化后蛋白大小为32 000, 符合预期结果, 但包涵体纯化法得到的蛋白纯度较差, 杂带较多.表明实验构建的重组大肠杆菌成功表达了大小为32 000、表达形式为不可溶性的E2蛋白.
2.6 多克隆抗体鉴定
2.6.1 间接ELISA结果 小鼠在5次免疫后, 以未免疫前小鼠血清为阴性对照, 测定多克隆抗体效价, 其阴性均值为0.208 4, 制备的多克隆抗体稀释29倍后, 其OD450=0.804 1, 大于2.1倍的阴性值, 计算的抗体效价大于2×104, 表明实验所用制备抗体的抗原活性较好, 免疫原性较强, 可刺激小鼠产生强免疫反应.
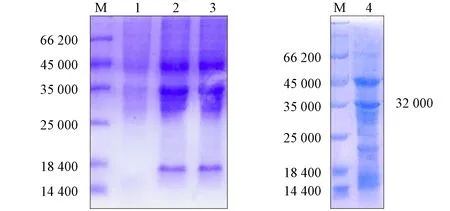
M: 蛋白分子质量标准; 1: 空质粒组; 2: pET-E2全菌诱导;3: pET-E2诱导沉淀; 4: pET-E2蛋白纯化.图7 重组蛋白的SDS-PAGE分析Fig.7 SDS-PAGE analysis of recombinant protein

M: 蛋白分子质量标准; 1: E2蛋白; 2: BVDV.图8 多克隆抗体的Western blot鉴定结果Fig.8 Western blot identification results of polyclonal antibody
2.6.2 Western blot结果 多克隆抗体的Western blot鉴定结果如图8所示.由图8可见, 多克隆抗体与第一孔的重组蛋白抗原在32 000结合, 与第二孔的病毒抗原在35 000特异性结合, 表明制备的鼠源多克隆抗体反应性和特异性良好.
2.6.3 IFA结果 多克隆抗体的IFA鉴定结果如图9所示.由图9可见: MDBK细胞在感染病毒后产生病变; 无病变对照(图9(B))与阴性血清组(图9(C))均未出现荧光现象; 阳性对照出现较大范围荧光(图9(D)); E2多克隆抗体组出现较多荧光(图9(E)).表明抗体可与细胞中的BVDV结合, 抗体反应性和特异性良好, 但低于阳性血清的纯度.

图9 多克隆抗体的IFA鉴定结果Fig.9 IFA identification results of polyclonal antibody
综上, 本文以Balb/c小鼠及原核表达载体pET-30a为材料制备多克隆抗体, 其背景信息清晰, 可降低对实验准确性的影响; 截短后的E2基因, 亲水性和抗原表位点更集中, 可更有效加强重组E2蛋白对动物机体的刺激作用, 有利于制备抗体.蛋白表达测定结果表明, 构建的重组E2大肠杆菌表达效率达50%, 蛋白表达量为0.4 mg/mL, 处于较高水平; ELISA测定结果表明, 制备的多克隆抗体效价大于200 000, 即实验得到的重组蛋白活性良好, 可刺激小鼠免疫细胞产生抗体, 从而为ELISA准备良好抗原, 进一步检测患病及PI动物; WB和IFA结果表明, 多克隆抗体的反应性和特异性良好, 可作为检测BVDV病原的抗体.
