中国黄、渤海海水中溶解镉的形态研究
2020-05-29任艺君王小静甄晓桐刘季花
任艺君,李 力,2,3*,王小静,甄晓桐,刘季花,2,3
(1.自然资源部 第一海洋研究所,山东 青岛266061;2.自然资源部 海洋沉积与环境地质重点实验室,山东 青岛266061;3.青岛海洋科学与技术试点国家实验室 海洋地质过程与环境功能实验室,山东 青岛266061)
痕量金属在海洋生物地球化学循环中发挥着重要作用,涉及到海洋生物、海洋地质和海洋化学等过程[1-2]。一些痕量金属(如Mn,Fe,Zn等)会参与海洋有机体的重要合成过程,也被称为微量营养元素[3]。Outten和O'Halloran认为海水中几乎所有藻类所含痕量金属均适用于特定系数,并且提出其比值为(C106N16P1)×1000Fe8Mn4Zn0.8Cu0.4Co0.2Cd0.2,此系数的±3倍之内即为实际藻类体内痕量金属的相对含量范围[4]。Cd是一种微量营养元素,已有研究显示在Zn限制(即Zn的含量极低且低于合成有机体所必须的含量)的海水中,一些浮游生物中的Zn酶(如碳酸酐酶)可吸收Cd来代替Zn,促进海洋硅藻的生长[5]。在大洋表层海水中溶解态Cd浓度因生物摄取或颗粒吸附而降低,随着海水深度增加,颗粒物沉降的同时发生分解,使得溶解态Cd含量升高,在约1 000 m 时达到最高浓度[6-7]。与其他痕量金属(如Fe和Cu)类似,当溶解态Cd在开放大洋海水中的含量低于一定值时就会限制初级生产[8]。同时Cd作为一种金属元素,当其浓度超过一定值时就会抑制海洋生物的生长、改变生物群落结构和多样性,甚至影响人类健康[9-10]。海水中的Cd主要有2个源头,自然环境中Cd一般来自岩石风化和火山活动等,人为源头的Cd主要来自于电镀、染料、镍镉电池、电子显像管等工业。随着我国经济的快速发展,Cd在废、污水中的排放量逐渐升高,带来的污染问题不可忽视。
近几十年越来越多的研究表明,痕量金属的总溶解态并不直接作用于生物,其自由离子态才是影响生物可利用性和毒性的关键所在[10-13]。因此,研究海水中溶解态痕量金属存在形态意义重大。现有研究表明,海水中的有机配体能与Cd离子产生强络合,大洋表层海水中70%~99%的溶解态Cd以有机络合物的形式存在[14-18]。其他国家近海海域的分布情况也各不相同,例如,阿穆尔海湾中有66% 的Cd以无机络合物存在[18];英格兰南部河口和海岸水域有20%~80%的Cd为有机络合态[16],如此大的变化范围表明河口盐度梯度上Cd络合形态的变化;中国南海北部地区海水中几乎所有溶解态Cd都是以自由离子形态和无机络合态存在[19]。此外,有机配体一般为藻类的抑毒机制分泌所得[1],所以在海水表层含量较高。配体浓度随深度增加而减少直接导致垂向分布上自由离子态Cd的浓度随深度增加而增加[20],例如有研究发现北太平洋中心海域水深600 m 海水中自由离子态Cd的浓度几乎是表层水的1 000倍[14]。此外,溶解态Cd的存在形态受水体p H 值、盐度以及水体中的配体性质影响。较低的p H 值可使有机络合的Cd释放成为自由离子态Cd[21],而在盐度升高的情况下,也会因为Cd易与氯离子形成无机氯络合物从而使有机络合态的Cd分解[22-23]。曾有研究者提供了1985—1986年在黄河口及南海的几个站位Cd络合配体的数据[24]。但系统地研究中国近海海域海水中金属形态,尤其是金属自由离子态的研究尚未见报道。因此我们针对海水中金属形态的研究为深入了解其机制作用提供了有益参考。
2016-06—07我们参加国家自然科学基金委员会黄、渤海夏季共享航次采集黄、渤海40个站位(图1)的表、底层海水样品,测试并分析总溶解态Cd在研究海区的分布特征,并使用电化学法测试分析溶解态Cd的存在形态,结合水文等参数,对夏季影响总溶解态Cd及其存在形态分布及变化的重要源、汇过程进行探讨。不同季节或年份的总溶解态Cd浓度、存在形态的分布、变化的重要源和汇过程不同。但由于未采集其他月份或年份的海水样品,因此我们无法进行季节性差异和年度变化对比的讨论,这是我们下一步研究的方向之一。

图1 2016-06—07黄、渤海采样站位( )及环流示意图[25]Fig.1 Sampling stations( )and circulation diagram[25]in the Bohai Sea and the Yellow Sea in June—July 2016
1 材料与方法
1.1 研究海域
渤海和黄海都是我国重要的半封闭边缘海域,渤海只通过狭窄的渤海海峡与黄海相连,黄海在中国大陆和朝鲜半岛之间,2个海域与开放大洋的水体交换能力较差。渤海包含渤海湾、莱州湾和辽东湾三个海湾,平均深度为18 m。黄海以位于山东省的成山角与位于朝鲜半岛的江山角之间的连线分为南黄海和北黄海,平均深度为44 m。海水通过渤海海峡北部流入渤海,流入的海水分为2支,一支流向东北部的辽东湾,并沿逆时针方向流动[26-27];另一支流向西部和西南部的渤海湾和莱州湾,在渤海湾中环流是双环结构[28],在夏季莱州湾南部以及黄河口南侧由于黄河入海淡水影响形成顺时针环流[27],最终沿渤海海峡南部流出渤海[29]。进入渤海的河流中以黄河、海河、滦河以及进入辽东湾的辽河为主,其中黄河是注入量最大的河流(约1.0×1010m3/a)[30]。北黄海范围较小,但是连接渤海和南黄海的重要区域,主要存在辽东半岛南岸自鸭绿江口向西南流动的辽南沿岸流[31],以及山东半岛以北沿岸区域自西向东并在成山角转向南流动的鲁北沿岸流[32]。南黄海的主要环流是黄海暖流和几个沿海潮流,包括黄海沿岸流和朝鲜半岛西部沿岸流等[31,33],黄海中部存在黄海冷水团。黄海暖流是对马暖流水和东海陆架混合水交汇衍生出来的唯一从外海向黄海输送高温、高盐海水的环流[33]。黄海冷水团形成于春季南黄海中部25 m 以下水域,夏季几乎覆盖整个南黄海底层水域,在秋季消失;黄海冷水团保持了冬季黄海混合水遗留下来的低温高盐的性质[34]。从中国大陆东部和朝鲜半岛西部进入黄海的河流多达30多条[35],其中中国大陆区域流入黄海西部的河流主要有长江和淮河等,朝鲜半岛流入黄海东部的河流主要有鸭绿江、清川江和大同江等。只有长江流量(9.28×1011m3/a)显著,每年入海废、污水可达2.0×1011m3,大约有15%~30%的长江水输入黄海[35-37]。
1.2 样品采集和预处理
2016-06—07我们乘国家自然科学基金委员会2016夏季共享航次采集黄、渤海40个站位的表层(水深2~5 m)、底层(距底约2 m)海水样品(采样站点的位置见图1所示),采集样品时严格遵循痕量金属洁净采样方法[38]。使用便携式蠕动泵(美国Cole-Parmer Inc.生产Masterflex型)配备采样管采集样品,采样管为预先清洗的水管(美国Cole-Parmer Inc.生产C-flex型),前端连有约20 cm 的特氟龙硬管,将其固定为与采样绳垂直的方向。后端连有囊式过滤器(0.2μm,美国Pall Inc.生产AcroPak200型),抽出海水后直接过滤,测试总量样品加高纯度硝酸(加拿大Thermo Fisher Scientific Inc.生产Optima型)酸化至p H 约为2,常温保存;测试形态样品冷冻保存(-20 ℃)至实验室分析。因水流较大,底层水采样深度使用采样绳的角度进行了校正,一般为水深15~35 m。对于南黄海中部和北部某些水深较深的站位,实际采集的为中层水,但根据温、盐比较,该中层水与底层水的温、盐极为类似。
采样管等均事先清洗干净。使用碱性洗涤剂(英国Decon Inc.生产Decon90 型)和体积分数10%的HNO3清洗采样管,然后在其中加入体积分数2%的HNO3,直至使用时将其排出。用体积分数2%的HNO3和自制超纯水(美国Millipore Inc.生产Milli-Q 型纯水机,电阻率18.2 MΩ cm)清洗囊式过滤器(0.2 μm,美国Pall Inc.生产AcroPak200型)。采样瓶依次使用甲醇、洗涤剂和超纯水清洗,然后瓶中装满体积分数50%的HCl,瓶身在体积分数17%的HCl中浸泡超过一周,用超纯水冲洗干净,最后采样瓶装满超纯水、并用高纯度硝酸酸化至p H 约为2直至使用。
1.3 总溶解态Cd的测试
依据Biller和Bruland的方法[39],使用Nobias-PA 树脂(美国Elemental Scientific Inc.生产)对海水中的痕量金属进行富集分离的前处理操作。考虑到近海海水中有机质与Cd的强络合[40],紫外消解4 h将有机质完全消解[41]。使用醋酸铵缓冲溶液调节40 m L样品的p H 约为5.8,并流过用醋酸铵缓冲溶液调节p H(约5.8±0.2)的螯合树脂柱,最后用约2 m L含有10×10-9的In标准溶液(美国High-Purity Standards Inc.生产),且浓度为1 mol/L 的HNO3溶液洗脱树脂上的痕量金属,并在ICP-MS(美国Thermo Fisher Scientific Inc.生产X Series2型)上分析。
以实际样品数量的10%进行空白海水分析,溶解态Cd的操作空白(n=11)为14 pmol/L,检测限为9 pmol/L。对认证的标准海水NASS-6和CASS-5(加拿大National Research Council生产)进行分析,我们研究(n=6)结果:NASS-6为(0.030 8±0.009 1),CASS-5为(0.022 2±0.002 7),认证值:NASS-6为(0.030 3±0.001 9),CASS-5为(0.021 0±0.001 7),符合较好。
1.4 Cd的存在形态分析
10 m L加入金属Cd标准溶液和缓冲溶液的海水样品润洗平衡特氟龙小瓶,过夜后废弃,重复2次,尽量减少杯壁吸附的影响。取10 m L海水样品12份放入上述平衡后的特氟龙小瓶,再分别加入不同浓度(0,0.10,0.15,0.20,0.25,0.30,0.50,0.70,1.00,2.00,5.00,7.00 nmol/L)的金属Cd标准溶液(根据待测海水样品溶解态Cd总量决定)和50μL缓冲液(10 m L超纯水中加入0.93 g H3BO3和0.16g NaOH)以保持p H 约为8.2。平衡过夜后依次测定。
Cd形态分析使用阳极溶出伏安法(ASV)[13],所采用仪器为Autolab III电化学分析仪(瑞士Metrohm Inc.生产663VA Stand型),工作电极为滴汞电极,参比电极为Ag/AgCl,盐桥使用3.0 mol/L KCL 填充。663 VA Stand操作由NOVA 软件系统控制。Cd形态测定时设定参数为沉积电位-0.75 V,沉积时间5 min,平衡时间15 s,扫描范围-0.85~-0.50 V,跨步电压5 m V,振幅调制0.05 V,调制时间0.06 s,间隔时间0.2 s。滴定结果的数据处理选用GEOTRACES学术委员会建议使用的Pro MCC软件[42],以便保持处理数据的一致性。
开始时添加的Cd与样品中存在的天然有机配体络合,因此电流(ip)响应较低,随着添加金属浓度的增加,电流响应呈现线性变化,表明所有的Cd络合配体均被有效滴定,直线的斜率代表灵敏度(S')。海水样品Cd滴定得到的数据经过Ruzicr/Van Den Berg 和Scatchard 线性化模型处理认为Cd 络合配体只有一类[43]。海水样品Cd的滴定和拟合曲线示例见图2。图中cCdmeas表示添加金属后测得的电活性金属浓度,即自由离子形态和无机配合物形态(cCdmeas=ip/S');cCdL表示基于配体与Cd存在1∶1络合的情况下,与有机配体结合的Cd浓度[44-46]。
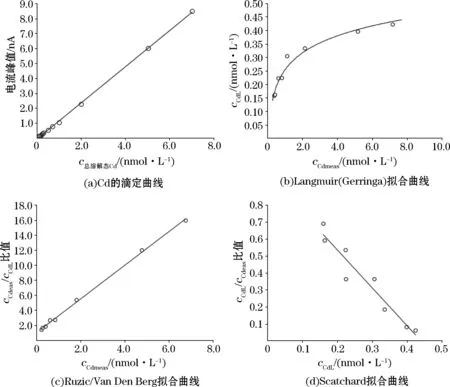
图2 样品Cd形态滴定和拟合曲线Fig.2 The titration and fitting curves of the Cd in seawater samples
2016-12—2017-11在自然资源部第一海洋研究所的痕量金属清洁实验室中进行样品前处理和富集过程。所有缓冲溶液和金属标准溶液均使用进口试剂(美国High-Purity Standards Inc.生产)和超纯水配备。所有与试剂和样品接触的实验室器具都按照GEOTRACES标准和互调委员会建议的程序[38]严格地进行了清洗。
2 结果与讨论
黄、渤海的表、底层海水盐度与Chla分布(图3)显示,盐度变化范围为26.4~33.5。渤海与开阔大洋相比表、底层海水盐度均偏低。由于渤海水深较浅,因此盐度垂向分布较均一,无明显分层现象。在黄河口附近存在一个低盐区,应是夏季黄河的淡水输入,且水体在莱州湾内顺时针流动造成。黄海海水盐度变化较大,部分海域海水分层现象较为明显。南黄海中部存在黄海冷水团,其盐度在夏季表现出强的层化分布[47],受黄海冷水团水体高盐性质的影响,此区域存在一个底部盐度高值区。位于南黄海西部的江苏地区沿岸海域的盐度分布特征呈现为东高西低,且低值区有向东北方向和东南方向扩展的趋势[48-49],这可能与苏北地区丰富的河流水系、江苏沿岸入海径流的输入以及苏北沿岸水的输送有关,同时由于水深较浅,水体几乎不出现分层现象[29,50]。江苏沿岸以南、长江口及邻近海域层化现象严重,表层存在一个低盐区,并向东北方向扩展。由于采样期间长江中下游等地连续遭受的暴雨洪涝灾害导致长江流量增加[51],该区海水盐度较往年更低[52-54]。黄河口附近海域表、底层海水均出现叶绿素(Chlα)质量浓度高值,这与渤海盐度低值区相对应。南黄海南部表层海水存在一个Chlα高值区。这些Chlα高值区的出现可能与富营养化的河流输入以及在海水中的运移等有关[55]。

图3 2016-06—07黄、渤海表、底层海水盐度和Chl a 空间分布(Chl a 数据引自文献[68],负值表示仪器未检出)Fig.3 Spatial distributions of salinity and Chl a (surface and bottom)in the Bohai Sea and the Yellow Sea in June—July 2016(The Chl a data was cited from the Reference[68],negative value indicates that the instrument is not detected)
2.1 总溶解态Cd的空间分布特征
2016-06—07渤海表、底层海水总溶解态Cd浓度(图4)分别为(644±226)pmol/L、(545±64)pmol/L(n=8);北黄海表、底层海水总溶解态Cd浓度分别为(470±93)pmol/L、(385±83)pmol/L(n=7);南黄海表、底层海水总溶解态Cd浓度分别为(274±129)pmol/L、(283±95)pmol/L(n=25)。海水中的总溶解态Cd浓度从高到低依次为渤海>北黄海>南黄海。渤海海水中总溶解态Cd的浓度是南黄海的2~3倍,原因可能是渤海水体交换能力较差,海水在渤海的停留时间通常是半年以上[56-57],且渤海沿岸有超过40条大小河流输入,包括海河、滦河、辽河等携带较多工业和生活废、污水的河流。研究显示长江、黄河和海河对黄、渤海溶解态Cd贡献的通量约为4.0×106kg/a[58],所以河流输入是黄、渤海海水中Cd的重要来源。除河流向海洋中输送痕量金属外,大气沉降也是海水中痕量金属的一个重要的源。在黄、渤海针对Cd通过大气沉降入海通量的研究不多,Lammel等曾根据研究计算得到其沉降通量(1.74~1.86)×105kg/a[59],而颗粒态Cd沉降入海后会通过解吸过程转化为溶解态Cd,溶解度为60%~80%[60-61]。以往黄河河水中报道的总溶解态Cd浓度为9~230 pmol/L[58,61],渤海海水Cd的浓度为720~1 370 pmol/L[54,62],后者较高的现象与其他河口的观测结果类似,其原因应是河水中的Cd离子与海水中的氯离子产生较强络合导致其溶解态浓度增加,这与其他学者的研究结果[58,63]一致。

图4 2016-06—07黄、渤海表、底层总溶解态Cd的空间分布Fig.4 Spatial distributions of dissolved Cd concentrations(surface and bottom)in the Bohai Sea and the Yellow Sea in June—July 2016
黄海海水溶解态Cd的分布特征整体呈现为北高南低、近岸高远岸低,显示河流输入的影响更为显著。其中山东半岛周边海域海水中总溶解态Cd浓度相对较高,其原因可能为1)含有较高Cd浓度的海水随着鲁北沿岸流由渤海绕过山东半岛,向南流动造成;2)此区域没有明显低盐水体输入,但在夏季山东半岛东部成山角附近存在的上升流[64]作用下,沉积物发生再悬浮(悬浮体浓度>5 mg/L)[65-66],Cd可通过解析或再矿化过程从颗粒态转化成溶解态[58,67-68],使得海水中溶解态Cd浓度升高。南黄海中部出现总溶解态Cd最低值,与黄海冷水团位置基本吻合,该片海域底层海水温度较低、盐度较高,冷水团内部的颗粒表面吸附和沉降可能引起溶解态Cd浓度降低。南黄海南部海域、Chlα高值区的Cd浓度较低(<150 pmol/L),该海域表层海水中Chlα的值达到最大(19μg/L)。Cd是一种微量营养元素,也有研究显示藻类生长对Cd的吸收利用,因此Cd浓度低应是受生物摄取的影响[5]。此外,长江河水中溶解态Cd浓度低于30 pmol/L[69],远低于长江口邻近海域海水溶解态Cd浓度,表明长江并不是溶解态Cd的源。
关于黄、渤海总溶解态Cd的研究(500~3 000 pmol/L)[70-73]较多,虽整体分布特征相似,但都比我们研究中测定的平均浓度高2~5倍,究其原因可能是1)近年来对排放入海的废水的控制使得海水中总溶解态Cd呈逐年下降的趋势;2)季节性差异,本研究中只针对夏季进行了采样,而田琳等在2007年对北黄海Cd的调查发现,Cd的浓度在春季为1 nmol/L 以上,秋季则达2 nmol/L 左右;3)采样和测试引入的污染导致。虽然Cd并不算特别易于被污染的痕量金属,但由于在海水中浓度较低(一般低于1 nmol/L),采样和测试中需特别注意避免不必要的外来污染。我们采样和测试中都严格采用了目前国际最新的洁净痕量采样和分析测试技术[38]。
2.2 Cd的形态
研究海域有机配体浓度范围为134~1 095 pmol/L(图5)。有机配体浓度在黄河口附近(>1 000 pmol/L)最高,该现象表明:1)黄河可能是金属Cd配体的一个来源;2)该区域Chlα质量浓度(图2)较高,藻类的生长可分泌大量有机配体[1]。山东半岛东部成山角附近海域海水中配体浓度较高,可能来自沉积物再悬浮的解析过程,以往有研究表明沉积物是上覆水中金属配体的来源[74-76]。此外,位于南黄海南部的靠近长江口海域附近Cd配体浓度较高,应是长江可能输入较多络合配体,这与长江江水及长江口附近海域有机质含量较高[66,77-78]是一致的,也有研究认为长江输入是Fe的有机配体的来源[79]。

图5 黄、渤海底层海水Cd2+浓度与金属配体浓度的空间分布Fig.5 Spatial distributions of free Cd2+and ligand concentrations in bottom water of the Bohai Sea and the Yellow Sea
海水中有机配体能与Cd产生强络合从而控制Cd在海水中的形态,其络合强度用络合常数表示,其中cCdL表示基于配体与Cd存在1∶1络合的情况下,与有机配体结合的Cd浓度,cCd2+表示Cd2+浓度,cL'表示未与Cd结合的配体浓度。大洋海水中的lgK′CdL,Cd2+通常在10左右[13,16-17],其配体来源一般为藻类分泌,络合强度较高[80-82]。海洋腐殖质作为难降解的有机物,只是Cd 的弱配体来源(lgK′CdL,Cd2+ =6.1)[83]。 近海海水中的lgK′CdL,Cd2+约为9~10[15-16,84]。已有研究表明近岸受陆源有机质输入的影响较大,浮游植物对有机配体的贡献不显著[85-86],因此近海海水中有机配体来源一般是废、污水。废、污水中的配体可以与Cu,Ni,Fe等金属产生中等或强络合[79,87-88],也应存在Cd配体。研究中测定的lgK′CdL,Cd2+=11.82±0.41,比以往大洋和近海研究中所报道的lgK′CdL,Cd2+稍高(表1),其原因可能是我国近海海水中的废、污水排放量较大且成分复杂,导致有机配体络合强度较高。
测定结果显示,在研究海域Cd2+的浓度范围为0.8~8.0 pmol/L,20%~92%以上的溶解态Cd与有机配体形成了强络合,这与文献报道的其他国家沿海海域和部分大洋中情况[14,17-18]一致。Price和Morel认为Cd可以在Zn限制的条件下,通过在某些大分子中取代Zn的位置,刺激海洋浮游植物的生长[5]。但当Cd2+浓度高于100 pmol/L时,Cd会显示出其生物毒性[9]。而海水中的藻类通过分泌有机配体络合Cd2+,显著降低了Cd的生物毒性。研究区所有站点的Cd2+浓度均低于100 pmol/L,因此对浮游植物是无毒性的。
黄河口附近Cd2+的浓度(约8.0 pmol/L)最高,虽然该海域有机配体浓度(约1 080 pmol/L)也较高,但其络合常数(10.79)较低,同时总溶解态Cd浓度(约638 pmol/L)较高,所以导致其有较高的Cd2+浓度存在。由于南黄海中部有机配体浓度(<300 pmol/L)较低、络合常数(11.8~12.4)较高、黄海冷水团存在导致的总溶解态Cd浓度(100~250 pmol/L)较低,使得南黄海中部Cd2+浓度(0.7~1.6 pmol/L)较低;长江口附近海域Cd2+浓度(1.2~1.7 pmol/L)较低,应是该海域较低的总溶解态Cd及较高有机配体浓度共同作用导致的。江苏沿海海域Cd2+浓度较高,是由于该海域水深浅,悬浮体浓度(>40 mg/L)较高[66],使得淮河入海口附近总溶解态Cd浓度高,同时该海域配体浓度低,二者共同作用导致了高值的出现。

表1 黄、渤海底层海水Cd形态分析结果与其他近海以及大洋研究结果对比Table 1 The results of Cd speciation analysis in bottom water of the Bohai Sea and the Yellow Sea,compared with those Cd speciation reported in previous studies in this region and other oceans or coastal waters
3 结 语
2016-06—07我们采集黄、渤海的海水样品,测定溶解态Cd,分析其在表、底层海水中的分布规律及其存在形态。总溶解态Cd浓度从高到低为渤海>北黄海>南黄海。我们认为山东半岛附近海域海水中的总溶解态Cd浓度较高应与沿岸上升流引起的沉积物再悬浮过程有关。黄河口附近及长江口附近海水中总溶解态Cd浓度均比其河流中Cd浓度高,是由于河流入海时氯离子浓度增加,且Cd与氯离子络合造成的。南黄海中部海域总溶解态Cd浓度低是由于南黄海冷水团内部的颗粒物吸附和沉降过程引起的。自由离子态Cd的浓度远低于浮游生物的致毒浓度,因此对生物不具有毒性。20%~92%的溶解态Cd是与有机配体相结合的,有效降低了Cd的生物利用性。Cd配体的来源可能是藻类分泌、陆源输入以及沉积物再悬浮的解析过程。我国黄、渤海海水中能够与Cd络合的有机配体的条件稳定常数lgK'CdL,Cd2+=11.82±0.41,比部分大洋和其他国家近海稍高,可能是中国近海有机质含量较高且成分复杂造成的。
致谢:中国海洋大学张翠琴对现场采样和测试工作的帮助,中国海洋大学王丽莎老师提供的Chla数据。
