无硒氯化物体系电解金属锰消减氯气的实验研究
2020-05-29王铎,李彦,郑凡,朱华
王 铎,李 彦,郑 凡,朱 华
(武汉大学 资源与环境科学学院,湖北 武汉 430079)
在现代工业中, 锰及其化合物广泛应用在国民经济的许多领域[1]。目前,绝大部分锰是采用硫酸盐电解质体系生产的[2]。但是,硫酸盐电解质电解工艺存在电流效率低、能耗高等问题[3]。于是另外一种电解体系,即氯化物电解质电解金属锰(以下简称为:电解锰)引起了许多研究者的注意[4]。使用氯化物电解质有如下优点:更高的电导率和更低的溶液粘度,更高的电解质溶解度[5],因而期望有更高的电流效率和更低的能耗[6]。但是氯化物电解质也存在着氯气溢出[7]等问题。氯气的溢出会危害员工的身心健康,对电解槽、辅助设备等产生腐蚀,且会产生部分的碱液吸收成本[8]。
我国氯元素杂质伴生的锰矿较多,在生产过程中不可避免的会有氯元素溶解进电解液中,影响生产[9]。探索氯气消减是高效利用这类锰矿的关键。
本文从探究电解锰的工艺条件入手,考察不同电解质组成、不同工艺参数对氯气溢出量产生的影响,从而获得消减氯气溢出的工艺路线,进而推动氯化物电解质电解锰的发展,以及含氯锰矿的高效利用。
1 实验部分
1.1 实验装置与材料
电化学测试采用玻璃电解池,利用盐桥接入参比电极,构成三电极体系。测试时,将其置于恒温水浴锅中,维持温度在(40±1)℃。工作电极为Ru-Ir-Ta三元涂层Ti电极,面积为1 cm2,对电极为铂片,参比电极为饱和甘汞电极。
电解实验电解槽为自制的有机玻璃电解槽。阴极室的尺寸为10 cm×10 cm×10 cm,阳极室有两种尺寸:10 cm×10 cm×10 cm、10 cm×3 cm×10 cm。为了分别研究阴极及阳极过程的变化,降低彼此间干扰,采用阴离子交换膜将两个极室分开。阳极室密封,便于用负压方式收集产生的氯气。阴极采用316镜面不锈钢电极,尺寸为3 cm×11 cm,封装后露出工作面积为3 cm×3 cm。阳极采用Ru-Ir-Ta三元涂层Ti电极,尺寸为6 cm×15 cm,封装后露出的工作面积分别为6 cm×7 cm、6 cm×3 cm、3 cm×3.75 cm、3 cm×3 cm、3 cm×2.5 cm,以适应不同面积体积比。
1.2 实验方法
采用CHI660D电化学工作站对不同电解质条件下电解锰阳极过程进行线性伏安扫描测试,测试电位为0.75~1.678 V,扫描速度为10 mV/s。
使用新威高精度电解测试仪进行恒流电解实验。实验条件参考本课题组前期关于电解锰阴极过程的研究[6]:电解时间控制为2.5 h,电解液温度在(40±1)℃,阴极电流密度为50 mA/cm2,阴极pH为7.25,以及阴极添加剂(NH4)2SO3为0.15 g/L。阳极电流密度依实验条件而变化。电解过程中,通过一台微型抽气泵将产气导入两个串联的洗气瓶中,瓶内装有500 mL的NaOH溶液。电解2.5 h后,滴定测得洗气瓶中次氯酸根的量,计算氯气溢出量,同时称量电解前后极板的重量,计算锰和二氧化锰的沉积效率。
1.3 数据处理
电流效率计算公式如下:
(1)
式(1)中:η为电流效率,%;m0为极板质量,g;mi为电沉积后极板质量,g;M为相对分子质量,Mn为53.94,MnO2为86.94;F为法拉第常数,96 485 C/mol;I为电流强度,A;t为电解时间,s。
2 结果与讨论
以氯化氨、氯化锰为电解质生产金属锰,其阴极过程与目前广泛使用的硫酸盐体系一致,为锰离子的还原沉积。阳极过程除了锰离子的氧化、氧析出反应,还有氯离子的氧化以及氧化产物与溶液中铵根离子的氧化还原反应,因此,阳极过程更为复杂。为了深入了解锰沉积过程阳极反应的特点,探索减少氯气消减的策略,本文首先进行电化学测试。
采用新鲜的涂层阳极为工作电极,设计了4种电解液,用于探讨析氧、析氯、锰氧化反应以及彼此间的相互作用,结果见图1。图1中曲线1为在0.364 mol/L K2SO4+1 mol/L (NH4)2SO4溶液中得到的极化曲线,此时阳极过程仅为氧的析出反应,在新鲜的涂层阳极表面,起始氧化电位约1.1 V,析氧电位约1.3 V;曲线2为在0.364 mol/L MnSO4+1 mol/L (NH4)2SO4中得到的极化曲线,当有Mn2+存在时,起始的电位约为0.9 V,初始氧化电流显著高于曲线1,即不含锰离子的电解质,表明锰的氧化更容易发生,并在1.05 V附近出现氧化峰,至1.2 V时再次增大,随后的氧析出过程与曲线1基本重合,表明在含锰溶液中,当极化电流较大时,其阳极过程以析氧为主;曲线3的扫描溶液为0.728 mol/L KCl+2 mol/L NH4Cl,此时,氧化过程主要是析氯以及析氧反应,对比曲线3与1,可以看出在该溶液中,析氯反应更易于发生,其析氯电位约为1.15 V,电流随电位正移快速增大,并在1.3 V附近出现电流增长拐点,该折点与析氧电位基本一致,我们推测折点后的氧化电流以析氧为主;曲线4的扫描溶液为0.364 mol/L MnCl2+2 mol/L NH4Cl,同时含有Mn2+和Cl-,氧化电流的起始电位约0.8 V,且电流大于无锰的氯化铵溶液,意味着二氧化锰的生成与析氯同时发生,随后在1.25 V出现电流峰值,推测二氧化锰对氯的析出具有抑制作用,或者说氯气在二氧化锰上的析出具有更高的过电位,1.3 V后,电流再次增大。据此,可以将氯化锰、氯化铵溶液中的阳极过程分成两个区域:以过电位1.35 V为分界,分别为低过电位区域(或低电流密度区域),约小于30 mA/cm2,以Mn2+和Cl-的氧化为主要反应;以及高过电位区域(或高电流区域),以氧的析出反应为主要过程。

1 0.364 mol/L K2SO4+1 mol/L (NH4)2SO4; 2 0.364 mol/L MnSO4+1 mol/L (NH4)2SO4; 3 0.728 mol/L KCl+2 mol/L NH4Cl; 4 0.364 mol/L MnCl2+2 mol/L NH4Cl
图1 不同电解质条件下的阳极极化曲线
同时我们发现,只要在含锰离子的溶液中经过短暂的氧化,电极表面即会形成一层二氧化锰,因此,随后的极化曲线测试是在已经生长一层二氧化锰涂层电极上实施的。图2为在不同氯化铵浓度的溶液得到的极化曲线。
图2中的曲线与图1中的曲线4类似,也会在1.20~1.3 V出现一个氧化峰,且随溶液中氯离子浓度增大,电流增大,一方面说明该电位区的氧化电流主要来自氯的氧化反应而不是锰的氧化反应,另一方面证明电极表面生成的二氧化锰,对氯气的析出具有抑制作用。

1 C(NH4Cl)=1 mol/L; 2 C(NH4Cl)=2 mol/L;
随后,我们进一步比较锰离子浓度对氯析出的影响,控制铵根离子浓度为2 mol/L,Mn2+浓度分别为10,20,30 g/L,添加KCl使氯离子浓度保持为3.092 mol/L,测试结果如图3所示。比较峰值区各溶液的电流密度,发现随着锰离子浓度的增加,电极的电流密度反而减小,不过减小幅度不大。说明只要电极表面存在二氧化锰,对氯气的析出就具有抑制作用,溶液中锰离子浓度越高,形成的二氧化锰越致密,抑制作用越显著。

1 C(Mn2+)=10 g/L; 2 C(Mn2+)=20 g/L; 3 C(Mn2+)=30 g/L
为了验证上述分析,我们随后采用两电极恒电流电解实验比较不同电流密度下所产生的氯气及二氧化锰的量。实验控制电解液锰离子浓度为20 g/L,氯化铵浓度为2 mol/L,设定阳极电流密度分别为10.71,25,40,50,60 mA/cm2进行2.5 h电解,阳极电流密度对氯气溢出量以及MnO2沉积效率的影响如图4所示。

图4 阳极电流密度对氯气溢出量以及MnO2沉积效率的影响
从图4可以看出:随着电流密度从10.71增大到60 mA/cm2,氯气溢出量呈下降趋势,其中在低电流区域的10.71 mA/cm2时,氯气溢出量为1.95 mg(该溢出量为阳极产生的氯气与溶液中铵根离子反应后剩余的氯气量,不是氯气的产生量,因此,仅可用于相同条件的比较,但通常情况下,要求生产车间的氯气浓度不宜超过1.0 mg/m3[10]);在高电流区域,随着电流密度的增大,氯气的溢出量显著减少,到60 mA/cm2时的氯气溢出量已经低于检出限。这一结果印证了上述分析,而图4的二氧化锰的沉积量与电流密度的关系,也与上述分析一致,即随着电流密度的增大,二氧化锰的沉积量减少。
NH4Cl浓度对氯气溢出量的影响见图5,氯化铵浓度分别采用2,2.5,3 mol/L,对比在电流密度为60 mA/cm2时不同溶液的析氯量。
由图5可知,随着氯化铵浓度的增加,氯气溢出量先从0 mg到0.14 mg,然后增多至0.45 mg,这一结果也与上述电化学分析一致。
为了简化实验操作,上述实验所采用的电极面积与溶液体积比(以下简称为:面积体积比,用Ia/v表示)为9 cm2/L,是远低于工业生产水平的,为了确保实验结果对未来工业生产有借鉴价值,我们将Ia/v提高到30 cm2/L,即在原有电解池中增大电极面积至30 cm2,对比电流密度为60 mA/cm2时,两种Ia/v下氯气的溢出量,结果见表1。实验发现,当提高面积体积比,氯气的溢出显著增大,按照100%的电流效率计算反应时间内产生氯气量约为0.006 mol,远小于溶液中存在的铵根离子量0.6 mol,显然,氯气溢出更多的原因是反应速度不够所致。
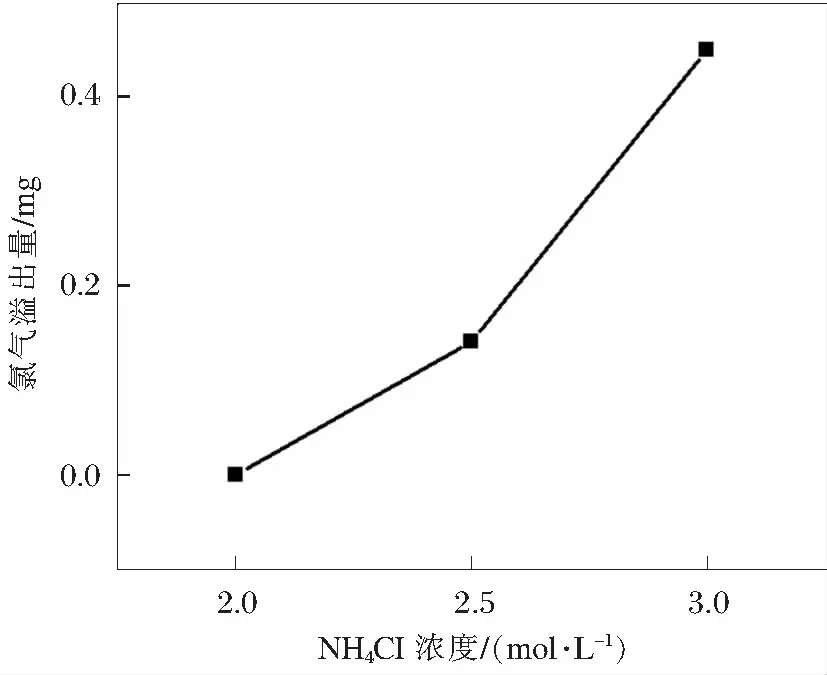
图5 NH4Cl浓度对氯气溢出量的影响
通过上述实验可知:氯气的溢出量与氯离子浓度有关,为了进一步降低氯气溢出量,需要降低氯离子浓度。为此我们尝试加入硫酸铵,降低氯离子的量,通过调整氯化铵以及硫酸铵的用量,使溶液中铵根离子始终保持2 mol/L不变。阳极电流密度采用60 mA/cm2,Ia/v为30 cm2/L,考察不同硫酸铵加入量对氯气溢出量以及阴极Mn沉积效率的影响,结果如图6所示。

表1 极板面积与电解液体积比与氯气溢出量的关系

图6 不同硫酸铵浓度与氯气溢出量和Mn沉积效率的关系
从图6可以看出:随着硫酸铵占比增加,氯气溢出量下降,当硫酸铵浓度大于0.5mol/L时,氯气溢出量低于检出限。但阴极Mn沉积效率也呈下降趋势,依次下降1.41%、0.5%、2.35%、8.57%。当采用1 mol/L NH4Cl+0.5 mol/L (NH4)2SO4作为混合电解液时,氯气溢出量减少最多而Mn沉积效率减少最少。
3 结 论
本研究的目的在于尽可能地减少氯气的溢出,同时保证阴极Mn的沉积效率。实验结果表明:氯气溢出量受阳极电流密度、锰离子浓度、氯化铵浓度以及极板面积与电解液体积比值的影响。在低过电位极化条件下,阳极电流以析氯为主,当过电位超过1.35 V后,阳极过程以析氧为主,但仍然有氯的溢出,在接近工业生产条件时,纯氯化物体系电解时难以完全抑制氯气的溢出,只有采用1 mol/L NH4Cl+0.5 mol/L (NH4)2SO4作为混合电解质时,氯气溢出量显著减少,低于检出限,无硒电解质中,阴极Mn沉积效率为72.81%,比纯氯化物体系下降1.18%,仍旧远好于纯硫酸盐体系。
