马铃薯致病疫霉及其拮抗菌的筛选与鉴定
2020-05-29刘紫英肖花美吴永飞刘小林胡祥飞
刘紫英,袁 斌,肖花美,吴永飞,刘小林,*,胡祥飞
(1.宜春学院 化学与生物工程学院,江西 宜春 336000; 2.宜春学院 生命科学与资源环境学院,江西 宜春 336000)
马铃薯晚疫病是一种由致病疫霉引起的,能够导致马铃薯块茎腐烂和茎叶死亡的一种毁灭性真菌病害[1]。该病在各地普遍发生,尤其是多雨时危害更甚,发生严重时叶片萎蔫,直至整株死亡[2]。全球每年因马铃薯晚疫病造成的直接经济损失达数百亿美元,我国约10亿美元,占马铃薯总产值的15%[3]。另外,马铃薯晚疫病对马铃薯品质也会构成严重影响。马铃薯晚疫病的传统防治方法主要有农业防治和化学防治[4]。近年来,由于传统的农业防治不能从根本上控制病害的发生,防治效果不稳定;而化学农药长期使用会使病原菌产生抗药性,过量使用农药还会破坏土壤,加重农药对环境的污染,造成过多的有毒有害物质残留在农作物体内。近年来,生物防治方法越来越受到人们的重视,通过利用微生物间的拮抗作用,选择对农作物不造成危害的微生物来抑制病菌生长[5]。李双东等[6]研究发现,EB-28无菌体培养液对马铃薯晚疫病菌游动孢子释放具有良好的抑制作用,抑制率达91.26%;在盆栽试验中,其对马铃薯晚疫病的防效显著高于离体叶片试验。任兴波等[7]分离得到了马铃薯晚疫病菌的高效拮抗菌株YR-35变绿色粘球菌Myxococcusvirescens,该菌株对马铃薯晚疫病菌菌丝生长有较高的抑制率。
本试验旨在筛选马铃薯晚疫病病菌的拮抗菌,研究拮抗菌对致病疫霉游动孢子释放、休止孢萌发、孢子囊直接萌发的抑制效果,为田间防治马铃薯晚疫病提供参考。
1 材料与方法
1.1 材料
马铃薯晚疫病病株采集于江西省宜春市新坊乡试验基地。
燕麦培养基:燕麦50 g·L-1,胡萝卜50 g·L-1,琼脂粉20 g·L-1,pH=5.8。
LB培养基:胰蛋白胨10 g·L-1,酵母浸粉5 g·L-1,NaCl 10 g·L-1,琼脂18 g·L-1,调pH至7.2±0.1。氨苄青霉素或链霉素200 mg·L-1。
1.2 方法
1.2.1 马铃薯致病疫霉的分离与筛选
采集患马铃薯晚疫病植株的茎叶病害标样,采用组织分离法分离病菌,接种于燕麦培养基。接种之前加入200 mg·L-1的氨苄青霉素,防止细菌感染。分离霉菌时,先将病叶用水冲洗干净,再用灭菌水冲洗,然后将病斑剪成1.0 cm2大小的小块,用75%乙醇浸泡30 s,取出,用无菌水洗净。放置在不同燕麦培养基平板上,18 ℃培养5~6 d后,用打孔器把白色毛绒状的致病疫霉接种到新鲜的燕麦培养基(链霉素200 mg·L-1),然后通过打孔、接种菌饼的方法对致病疫霉进行分离纯化,通过镜检观察致病疫霉孢子和生长形态,编号为PLB-2。
1.2.2 致病疫霉PLB-2的形态鉴定
取出18 ℃培养7 d左右的致病疫霉PLB-2。首先观察其菌落特征,然后用显微形态鉴定的方法,观察其显微结构。运用插片法制作盖玻片,先将盖玻片倾斜45°插入培养基中,然后将其放回18 ℃培养箱内培养1 d,让菌丝蔓延至盖玻片上。继而进行镜检,用乳酸石碳酸棉兰染色液染色,在光学显微镜下观察致病疫霉的菌丝、孢子囊和游动孢子形态结构。
还有那个和纸条放在一起的纸包,每次想到它我也是心惊肉跳。就在我参加工作的第三年,哥哥买房差一部分钱,我便抛火球一样把那个纸包扔给了哥哥,哥哥在我面前撕开纸包,一张一张的点,整整1万元。钱真的很新,捏住钱的这一端,那一端连弯都不弯!
1.2.3 致病疫霉的分子生物学鉴定
基因组DNA的提取:200 mg致病疫霉,用液氮研磨成粉末,加入1.5 mL离心管中。依据真菌基因组DNA快速抽提试剂盒[生工生物工程(上海)有限公司]的操作说明提取DNA。采用核酸蛋白测定仪测定样品的核酸浓度和纯度。样品D260/D280在1.8~2.0,这表明样品中DNA含量很高。之后,对DNA进行琼脂糖凝胶电泳。
致病疫霉PLB-2的ITS-rDNA扩增。以致病疫霉基因组DNA为模板,选用ITS1和ITS4为引物,进行PCR扩增。正向引物ITS1:3′-TCCGTAGGTGAACCTGCGG-5′,反向引物ITS4:3′-TCCTCCGCTTATTGATATGC-5′。PCR反应体系20 μL:0.6 μL ITS1、0.6 μL ITS4、10 μL 2×TaqPCR MasterMin、1 μL DNA模板、7.8 μL ddH2O。扩增程序:94 ℃预变性4 min;94 ℃变性30 s,55 ℃退火60 s,72 ℃延伸90 s,30个循环;72 ℃延伸10 min。PCR扩增结束后,对扩增后的产物进行琼脂糖凝胶电泳,用凝胶成像仪进行观察,并比较分析电泳图谱。将目的条带送生工生物工程(上海)有限公司进行测序,利用经NCBI数据库的BLAST工具进行基因序列比对。用MEGA 10.0软件制作进化树。
1.2.4 致病疫霉拮抗细菌的筛选
用试验基地种植马铃薯的土壤制备土壤液,将10 g土壤溶于90 mL无菌水中,100 ℃水浴加热10 min。再用无菌水依次稀释至10-6梯度,涂布法接种到LB固体培养基上,每个浓度重复4次,37 ℃条件下倒置培养2~3 d。然后进行分离纯化,采用平板对峙法对有拮抗作用的细菌进行复筛并编号。
制备拮抗细菌原液。选取WZ-406、WZ-502、WZ-503共3种拮抗细菌的纯品,将其用接种环分别接种至LB培养基,200 r·min-1摇床37 ℃振荡培养24 h。取D600为1.5左右(细菌浓度为3.65×107CFU·mL-1)的菌液放置在4 ℃冰箱备用。
抑菌效果。将上述细菌浓度为3.65×107CFU·mL-1的拮抗菌菌液稀释为5个浓度:稀释倍数分别为10×10-3、5×10-3、2.5×10-3、1.25×10-3、1×10-3,然后将不同浓度的菌液涂布于灭菌的燕麦固体培养基上,每处理重复3次。以不加入细菌原液为空白对照。将1块生长10 d左右长势相近的致病疫霉菌饼(直径0.8 cm)放置在平板的中间,在18 ℃恒温培养箱中培养10 d左右后测量菌落直径,并计算平均值。相对抑制率(%)=(对照菌落直径-处理菌落直径)/(对照菌落直径-菌饼直径)×100。
拮抗细菌对致病疫霉孢子囊释放游动孢子的影响。将拮抗菌原液稀释为5个浓度,稀释倍数分别为10×10-3、5×10-3、2.5×10-3、1.25×10-3、1×10-3,将生长10 d左右的致病疫霉孢子囊放于无菌水中,制成孢子囊悬浮液,将其稀释至300 mL(此时孢子囊浓度约为3.25×106个·mL-1),分装成3瓶,每瓶100 mL[8]。将不同浓度的细菌原液与孢子囊悬浮液等体积(3 mL)混合于灭菌的洁净干燥培养皿内,每个浓度重复3次,以LB液体培养基为空白对照,黑暗条件下4 ℃保存3 h[9],促使孢子囊释放游动孢子,统计50个孢子囊并计算游动孢子释放率。游动孢子释放率(%)=空孢子囊数/总孢子囊数×100。
拮抗细菌对致病疫霉孢子囊直接萌发的影响。制备300 mL孢子囊悬浮液,方法同上。运用血球计数板法[10]将孢子囊浓度调至约1.5×106个·mL-1,将致病疫霉的孢子囊悬浮液与不同浓度菌液按体积比1∶1(3 mL∶3 mL)混合,与等体积无菌水混合作为对照。每处理重复3次,25 ℃暗培养5 h刺激孢子囊直接萌发。统计50个孢子囊,计算不同菌液浓度下孢子囊萌发的平均百分率。孢子囊萌发率(%)=孢子囊萌发数/孢子总数×100。
拮抗细菌对致病疫霉休止孢萌发的影响。使用上述配置的100 mL孢子囊悬浮液,4 ℃黑暗条件下放置3 h,促使孢子囊释放出游动孢子,配制成游动孢子悬浮液,镜检游动孢子释放数约为1.0×106个·mL-1。将游动孢子悬浮液与不同浓度菌液按体积比1∶1(3 mL∶3 mL)混合,以与等体积无菌水混合作为对照,每处理重复3次。10 ℃黑暗条件下放置3 h以刺激休止孢萌发。计算不同菌液浓度下休止孢萌发的平均百分率。休止孢萌发率(%)=休止孢萌发数/游动孢子释放数×100。
拮抗菌WZ-502的形态和分子鉴定。拮抗菌的革兰氏染色鉴定:将WZ-502经多次平板划线分离纯化菌株,观察每种菌株的形态结构,革兰氏染色后用显微镜进行观察。同时,参考《伯杰氏细菌鉴定手册》对其鉴定到属。WZ-502的分子鉴定同1.2.3节,其16S rDNA扩增检测的引物为27 F:5′-AGAGTTTGATCCTGGCTCAG-3′,1541 R:5′-CTACGGCTACCTTGTTACGA-3′[11]。
1.3 数据分析
用SPSS 21统计软件进行差异显著性分析。
2 结果与分析
2.1 致病疫霉及其拮抗菌的鉴定
2.1.1 形态鉴定
分离的致病疫霉PLB-2在燕麦培养基上呈现纯白色(图1-A),菌丝分布均匀,呈白色丝状,菌落呈现圆形。运用插片法制作玻片进行镜检,用乳酸石碳酸棉兰染色液染色,在光学显微镜下观察,菌丝较细、无隔、有分支,大多数菌丝呈现多支形态,顶端有膨胀并着生孢子囊,孢子囊呈椭圆形(图1-B、C)。
共筛选得到3株较好的拮抗菌,标记为WZ-406、WZ-502、WZ-503(图1-D、E、F)。WZ-502菌落呈黄色,表面含水量较高、光滑,黏性较高,菌落边缘平整,短杆状结构。革兰氏染色结果表明,WZ-502菌株革兰氏染色呈蓝紫色,说明此拮抗菌为革兰氏阳性菌(图1-I);WZ-406、WZ-503呈暗白色,表面含水量较低,表面粗糙,菌落边缘呈树突状结构。
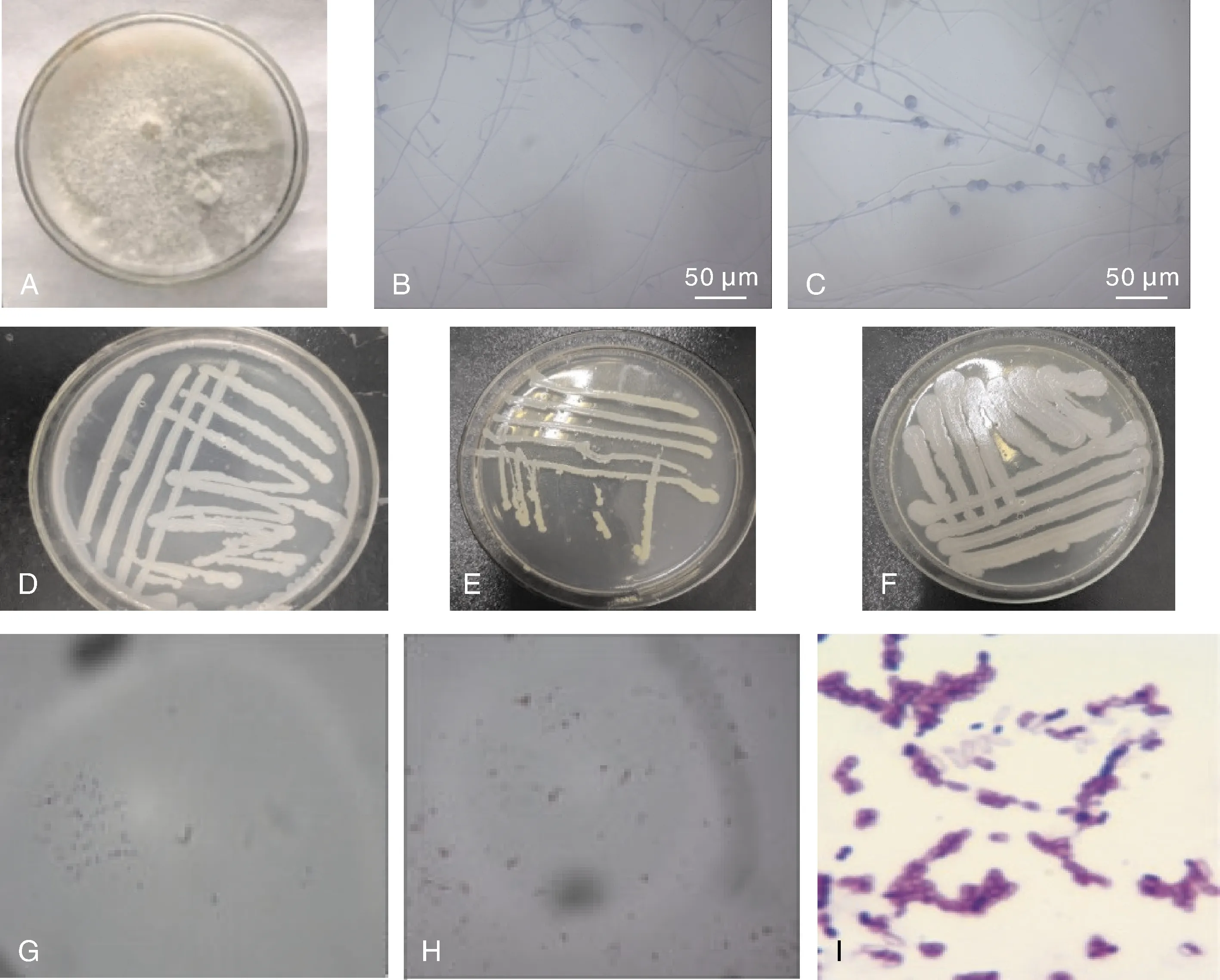
A,致病疫霉PLB-2菌落形态。B,致病疫霉菌丝形态;C,致病疫霉孢子囊形态;D,拮抗菌WZ-406;E,拮抗菌WZ-502;F,拮抗菌 WZ-503;G,拮抗菌WZ-406菌株革兰氏染色(1 000×);H,拮抗菌WZ-503革兰氏染色(1 000×);I,拮抗菌WZ-502革兰氏染色(1 000×)。A, Colony charateristics of Phytophthora infestans stain PLB-2; B, Hypha charateristics of P. infestans; C, Sporangia morphological charateristics of P. infestans; D, Antagonistic bacterium WZ-406; E, Antagonistic bacterium WZ-502; F, Antagonistic bacterium WZ-503; G, Gram staining micrograph of the strain WZ-406 (1 000×); H, Gram staining micrograph of the stain WZ-503 (1 000×); I, Gram staining micrograph of the strain WZ-502 (1 000×).图1 致病疫霉与拮抗细菌的形态结构Fig.1 Morphological charateristics of Phytophthora infestans and its antagonistic bacteria
2.1.2 致病疫霉PLB-2的分子鉴定
核酸检测结果显示,致病疫霉PLB-2基因组DNA样品的D260/D280在1.8~2.0,表明样品中DNA含量较高。对DNA进行琼脂糖凝胶电泳,结果见图2。PCR扩增PLB-2的ITS-rDNA,结果显示其条带大小为546 bp。测序和BLAST比对结果显示,其与Phytophthorainfestans同源性达到100%(图3)。结合形态学分析,将马铃薯致病疫霉PLB-2鉴定为Phytophthorainfestans。
2.2 拮抗菌对致病疫霉生长的抑制效果
在相同培养条件下,不同浓度的拮抗细菌菌液对致病疫霉生长的抑制效果不同(表1)。本研究中,WZ-406对致病疫霉的抑制效果最差;WZ-502对致病疫霉的抑制效果最好,WZ-502菌液稀释度为10.00×10-3时,致病疫霉菌落直径最小,为(1.1±0.10)cm,几乎未见生长,抑制效果显著,相对抑制率高达87.36%;WZ-502菌液稀释度为1.25×10-3时,致病疫霉菌落直径为(5.1±0.60) cm,仍显著小于对照。
2.3 拮抗菌对致病疫霉游动孢子释放的抑制作用
3种拮抗细菌对致病疫霉孢子囊释放游动孢子的抑制效果见表2,拮抗菌原液稀释度为10.00×10-3、5.00×10-3、2.50×10-3、1.25×10-3、1.00×10-3时,3种拮抗细菌对致病疫霉游动孢子释放均有显著抑制效果;相同菌液浓度下,WZ-502的抑制作用最强,浓度越大,其抑制效果越好。细菌原液稀释度为10.00×10-3时,WZ-502对致病疫霉的抑制作用最强,游动孢子释放率只有15.38%,显著低于对照组(46.15%);WZ-503的抑制效果次之,WZ-406抑制效果最差。细菌原液稀释度为1.00×10-3时,WZ-502处理的游动孢子释放率在38.15%左右,仍显著低于对照。

1和2为致病疫霉PLB-2基因组DNA;3为Taq 酶PCR扩增ITS-rDNA序列;4为Pfu酶PCR扩增ITS-rDNA序列。M,DNA标准分子质量。1 and 2, Genome DNA of PLB-2; 3, PCR production by Taq; 4, PCR production by Pfu; M, DNA marker.图2 马铃薯致病疫霉PLB-2电泳图Fig.2 Electrophoresis of Phytophthora infestans stain PLB-2
2.4 拮抗菌对致病疫霉孢子囊直接萌发的抑制作用
由表3可知,拮抗菌原液稀释度为10.00×10-3、5.00×10-3、2.50×10-3、1.25×10-3、1.00×10-3时,3种拮抗细菌对致病疫霉孢子囊直接萌发的抑制作用均较显著,随着菌液浓度的增加,孢子囊萌发率逐渐降低。稀释度相同时,WZ-502对致病疫霉孢子囊直接萌发的抑制作用最强。当WZ-502稀释度为10.00×10-3时,孢子囊萌发率为13.11%,显著低于对照,相对抑制率达75.73%。当WZ-502稀释至1.00×10-3时,孢子囊萌发率依然显著低于对照。
2.5 拮抗菌对致病疫霉休止孢萌发的抑制作用
由表4可见,拮抗菌原液稀释度为10.00×10-3、5.00×10-3、2.50×10-3、1.25×10-3、1.00×10-3时,3种拮抗细菌处理的致病疫霉休止孢萌发率均显著低于对照,拮抗菌菌液浓度越大,致病疫霉休止孢萌发率越低。WZ-502对致病疫霉休止孢萌发的抑制作用最强,WZ-503次之。
2.6 拮抗菌WZ-502 16S rDNA鉴定
表1 不同浓度拮抗菌菌液处理的马铃薯致病疫霉菌落直径
Table 1 Colony diameter ofP.infestanstreated by different concentration of antagonistic bacteria cm

稀释度Dilution/10-3WZ-502WZ-406WZ-503对照Control10.001.1±0.10 d 7.2±0.26 b2.1±0.40 c8.7±0.40 a5.001.2±0.30 d 8.3±0.70 b2.5±0.50 c8.7±0.40 a2.504.0±0.17 d8.6±0.65 b6.1±0.30 c8.7±0.40 a1.255.1±0.60 c8.6±0.60 b8.6±0.55 b8.7±0.40 a
同行数据后无相同字母表示差异显著(P<0.05)。
Data marked without the same letter in each row indicated significant differences atP<0.05.
表2 不同浓度拮抗菌处理的致病疫霉游动孢子释放率
Table 2 Rate of zoospores release from sporangia ofP.infestansunder different concentration of antagonistic bacteria %

稀释度Dilution/10-3WZ-502WZ-406WZ-503对照Control10.0015.38±0.35 d 23.08±0.79 b20.92±0.28 c46.15±0.05 a5.0023.38±0.43 c29.54±0.22 b23.08±0.25 c45.98±0.15 a2.5026.15±0.63 d33.23±0.32 b29.24±0.04 c46.85±0.69 a1.2530.77±0.18 d38.15±0.36 b35.08±0.63 c46.43±0.77 a1.0038.15±0.54 d44.31±0.58 b42.46±0.23 c46.05±0.05 a

图3 马铃薯致病疫霉PLB-2和其他菌株的ITS-rDNA序列进化树Fig.3 Phylogenetic tree of ITS-rDNA of stain PLB-2 and other strains
表3 不同浓度拮抗菌处理的致病疫霉孢子囊的直接萌发率
Table 3 Sporangia germination ofP.infestansunder different concentration of antagonistic bacteria %

稀释度Dilution/10-3WZ-502WZ-406WZ-503对照Control10.0013.11±0.26 d27.64±0.41 b15.27±0.75 c54.01±0.88 a5.0016.36±1.05 d27.27±0.72 b18.18±0.67 c55.38±0.54 a2.5026.18±0.86 d34.18±0.79 b32.00±0.73 c54.55±0.97 a1.2534.91±0.75 c45.09±0.77 b45.45±0.96 b53.55±0.65 a1.0045.45±0.54 c49.09±0.65 b49.45±0.96 b54.79±0.78 a
表4 不同浓度拮抗菌处理的致病疫霉休止孢萌发率
Table 4 Cystospore germination ofP.infestansunder different concentration of antagonistic bacteria %

稀释度Dilution/10-3WZ-502WZ-406WZ-503对照Control10.0010±0.35 d22±0.51 b17±0.83 c51±0.76 a5.0014±0.35 d25±0.46 b23±0.78 c49±0.36 a2.5026±0.75 d36±0.69 b31±0.47 c50±0.47 a1.2532±0.06 d42±0.02 b38±0.06 c50±0.85 a1.0039±0.05 d45±0.04 b44±0.09 c52±0.23 a
上述抑制效果表明,拮抗菌WZ-502对致病疫霉生长、游动孢子释放、孢子囊直接萌发、休止孢萌发的抑制作用最强。为进一步开发利用拮抗菌WZ-502,在分子水平对其进行了分类鉴定。PCR扩增结果表明,拮抗菌WZ-502的16S rDNA全长1 424 bp。BLAST比对显示,WZ-502与副凝聚短状杆菌Brachybacteriumparaconglomeratumstrain LMG 19861(NR022502)同源性达100%。采用NJ法构建了13个菌株(选BLAST同源性最高12个菌株)的系统发育树,结果显示,WZ-502菌株与副凝聚短状杆菌NR025502处于同一分支,且同源性为99%(图4)。Renske等提出序列相似性在95%~99%,可鉴定为相同属[12],故鉴定WZ-502为短状杆菌Brachybacteriumsp.。

图4 基于16S rDNA序列的拮抗菌WZ-502与其他菌株进化树Fig.4 Phylogenetic tree of antagonistic bacterium WZ-502 and other bacteria based on 16S rDNA
3 结论与讨论
近年来,植物病害生物防治以其无污染、无残留、无生态毒性和安全性好等优点在农业生产中得到广泛的认同。其中,利用拮抗微生物抑制马铃薯致病疫霉进而防治马铃薯晚疫病也受到越来越多的关注[13]。李玉峰等[14]研究发现,地衣芽孢杆菌代谢物在稀释度10-2时对马铃薯致病疫霉菌菌丝生长、游动孢子释放、休止孢萌发相对抑制率为49.79%、85.76%、77.29%,对游动孢子释放、休止孢萌发有明显的抑制效果,而对菌丝生长抑制性相对较弱。本研究筛选出的拮抗菌WZ-502菌液浓度为3.65×107CFU·mL-1、稀释度为10.00×10-3时,对马铃薯致病疫霉菌丝生长的抑制率为87.36%,对孢子囊直接萌发相对抑制率为75.73%。张笑宇等[15]发现,地衣芽孢杆菌稀释度为10-1时,对马铃薯致病疫霉菌丝生长的抑制率达86.11%,对游动孢子释放抑制率达78.1%。张亚辉等[16]运用对峙培养法、打孔法和离体组织切片法,研究了菌株Sy11、M15和A5295对马铃薯致病疫霉的抑菌效果,发现细黄链霉菌Sy11菌株对马铃薯晚疫病的防治效果最好,对疫霉菌丝生长抑制率为88.4%。Lamsal等[17]研究表明,7株根际细菌对马铃薯致病疫霉的抑制率均在60%以上。刘治会等[18]研究发现,芽孢杆菌属细菌265ZY1、265ZY3和265XY6对茄镰孢菌具有较强的拮抗能力,其抑菌率均接近75%。Zegeye等[19]发现,木霉菌比荧光假单胞菌对马铃薯晚疫病的防效好,抑制率达到100%。综上比较,本研究筛选的拮抗细菌短状杆菌WZ-502对马铃薯致病疫霉的抑制效果与已报道的放线菌Sy11、地衣芽孢杆菌防效相当,有希望应用于马铃薯晚疫病的防治。
本研究从试验基地种植马铃薯的土壤中筛选出3株对马铃薯致病疫霉具有显著抑制效果的拮抗细菌(WZ-406、WZ-502、WZ-503),其中,WZ-502对致病疫霉的抑制效果最好,其对致病疫霉游动孢子释放、休止孢萌发和孢子囊萌发均有较好的抑制作用。16S rDNA序列比对显示,WZ-502为短状杆菌Brachybacteriumsp.。WZ-502浓度为3.65×107CFU·mL-1、稀释度为10×10-3时,对致病疫霉的抑制效果最显著,其对致病疫霉菌菌丝生长、休止孢萌发和孢子囊萌发有相对较好的抑制作用,相对抑制率为87.36%、80.39%、75.73%。今后需要进一步对短状杆菌WZ-502菌株的防病机理和实际利用潜能进行深入研究,以加快该菌株的开发利用,并进一步通过盆栽试验和大田试验验证其对马铃薯晚疫病的防治效果。
