慢性鼻-鼻窦炎伴鼻息肉基因表达谱的生物信息学分析
2020-05-28王林娥
陈 钢,于 洋,王林娥
(1.首都医科大学附属北京友谊医院耳鼻咽喉头颈外科, 北京100050;2.宁夏医科大学总医院耳鼻咽喉头颈外科, 银川 750004)
慢性鼻-鼻窦炎合并鼻息肉(chronic rhinosinusitis with nasal polyps,CRSwNP)是慢性鼻-鼻窦炎(chronic rhinosinusitis,CRS)的分类之一,其特征是鼻腔粘膜持续的息肉样炎症[1]。尽管CRSwNP仅占所有CRS病例的25%~30%,但CRSwNP被认为是一种严重影响患者的生活质量和生产力,并伴有巨大的经济负担的疾病[2]。鼻内窥镜技术的普及应用使越来越多的鼻息肉患者得到了治疗,但是仍然有一些患者治疗效果不佳,甚至出现复发,因此还需要通过对其发病机制深入研究才能获得答案。随着基因芯片技术的发展,对基因表达谱芯片数据进行深入挖掘,可以为探寻各种疾病分子机制提供一种全新研究技术手段。因此本研究通过对美国国立生物信息中心(National Center for Biotechnology Information,NCBI)的基因表达数据库(Gene Expression Omnibus,GEO)[3,4]中慢性鼻窦炎伴鼻息肉基因芯片表达谱数据的挖掘,来研究鼻息肉的关键通路、差异表达基因(differentially expressed genes,DEGs)及这些基因产物之间的相互作用,希望能够拓展鼻息肉机制的研究思路,并为鼻息肉发生发展的分子机制研究提供参考。
1 材料与方法
1.1 数据来源
从NCBI基因表达数据库下载慢性鼻窦炎伴鼻息肉基因芯片表达谱数据(GSE36830),该芯片数据由芝加哥西北大学范伯格医学院的过敏和免疫科学者Atsushi Kato上传。采用 GPL570平台(Affymetrix Human Genome U133 Plus 2.0 Array),芯片数据包含 24个样本,其中包括6例慢性鼻窦炎不伴有鼻息肉(chronic rhinosinusitis without nasal polyps,CRSsNP)患者的钩突组织、6例慢性鼻窦炎伴鼻息肉(CRSwNP)患者的钩突组织、6例CRSsNP患者的钩突组织、6例对照组患者的钩突组织以及6例CRSwNP患者的鼻息肉组织。鼻窦和鼻息肉组织来源于CRS患者的常规功能性内窥镜鼻窦手术。对照组是在内窥镜下切除颅底脑瘤和鼻内窥镜下获得的正常的鼻窦组织。
1.2 分析方法
1.2.1 基因芯片的处理与差异表达基因的筛选
使用GEO2R筛选正常钩突和鼻息肉组织之间的差异表达基因。GEO2R是一个交互式的web工具,它允许用户比较一个系列中的两个或多个数据集,以便识别不同的数据集试验条件。筛选条件:标准为|log2FC|≥2 &Pvalue≤0.01,通过Graph pad Prism 8软件运行做差异基因可视化的火山图。
1.2.2 DEGs的注释和富集分析
采用Gene Ontology Resource数据库,在戴维(Database for Annotation,Visualization and Integrated Discovery,DAVID,David v6.8)数据库[5,6]中对筛选的差异基因进行基因本体富集(gene ontology,GO)分析、京都基因和基因组百科全书(Kyoto Encyclopedia of Gene and Genomes,KEGG)[7]信号通路分析,P<0.01时具有统计学意义。
1.2.3 差异基因蛋白互作网络的构建
交互基因的搜索工具String数据库是用于评估蛋白质相互作用信息的在线工具。String(版本11)[8]涵盖了来自5 090种生物体的2 400万种蛋白质信息。为了评估DEGs之间的交互关系,本研究应用Cytoscape软件构建蛋白质相互作用网络(protein-protein interaction network,PPI network),使用cytoHubba插件筛选出前10位的关键基因,同时使用分子复合检测(molecular complex detection,MCODE)插件蛋白质相互作用对网络的模块进行分析,使用这个工具的参数设置如下:Degree Cutoff:2;Node Score Cutoff:0.2;k-core:2;Max.Depth:100。
2 结果和分析
2.1 差异基因的表达分析结果
通过鼻息肉组与正常钩突对照组样本对比,总共54 675个基因被纳入研究。基于上述的标准,筛选出699个DEGs,其中475个基因为上调 DEGs,224个基因为下调DEGs(图1)。
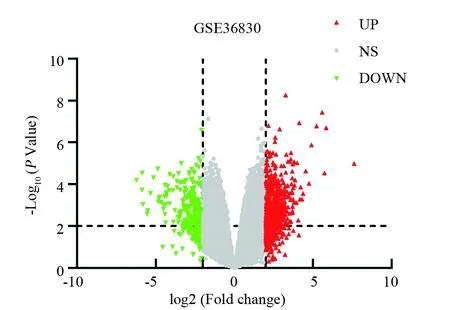
图1 差异基因的火山图 Fig.1 The volcanic plot of the differential genes 红色三角代表上调的 DEGs;绿色三角代表下调的DEGs;灰色圆点代表差异不显著的基因The red triangles represent the DEGs that have been upgraded;The green triangles represent the DEGs that have been downgraded;The grey dots represent the genes with no significant(NS) differences
2.2 GO分析和KEGG分析结果
上传所有的DEGs至在线分析工具David数据库,以识别GO分析和KEGG分析。GO分析结果显示,在生物过程(biological process, BP)中,上调的DEGs显著富集的生物过程包括:炎症反应(inflammatory response)、免疫反应(immune response)、细胞趋化性(chemotaxis)、炎症反应的正向调节(positive regulation of inflammatory response)、细胞的粘附(cell adhesion)等;下调的DEGs显著富集的生物过程包括:唾液分泌(saliva secretion)、生物矿物组织发展(biomineral tissue development)、细胞氨基酸生物合成过程(cellular amino acid biosynthetic process)、视网膜内稳态(retina homeostasis)及离子跨膜转运(ion transmembrane transport)等(表1)。在分子功能(molecular function,MF)方面,上调的DEGs显著富集的分子功能包括:外源性脂质抗原结合(exogenous lipid antigen binding)、β-2-微球蛋白结合(beta-2-microglobulin binding)、脂肽结合(lipopeptide binding)、碳水化合物结合(carbohydrate binding)、趋化因子活性(chemokine activity)等;下调的DEGs显著富集的分子功能包括:钙离子结合(calcium ion binding)、化学排斥物活性(chemorepellent activity)、转运活性(transporter activity)、药物结合(drug binding)、同一蛋白结合(identical protein binding)(表1)。此外,在细胞成分(cell component,CC)方面,上调的DEGs显著富集的细胞成分包括:细胞质膜(plasma membrane)、细胞质膜外侧(external side of plasma membrane)、细胞质膜的成分(integral component of plasma membrane)、细胞外空间(extracellular space)和细胞外区(extracellular region);下调的DEGs显著富集的细胞成分包括:细胞外空间(extracellular space)、细胞外区(extracellular region)、细胞外泌体(extracellular exosome)、突触后膜(postsynaptic membrane)、细胞质膜的成分(integral component of plasma membrane)等(表1)。
KEGG 分析结果显示,上调的 DEGs 在造血细胞系(hematopoietic cell lineage)、细胞因子-细胞因子受体相互作用(cytokine-cytokine receptor interaction)、破骨细胞分化(osteoclast differentiation)、趋化因子信号通路(chemokine signaling pathway)、癌症中的转录失调(transcriptional misregulation in cancer)、哮喘(asthma)、金黄色葡萄球菌感染(Staphylococcusaureusinfection)等信号通路中富集,而下调的 DEGs 在唾液腺分泌(salivary secretion)及胆汁分泌(bile secretion)信号通路中富集(表2)。
2.3 PPI 网络分析结果
基于String数据库中的信息,使用Cytoscape(版本3.7.2)进行PPI网络的分析,然后使用插件cytoHubba对关键基因进行筛选,排名前10的关键节点(Hubs)包括ITGAM、IL10、CD86、TLR8、ITGAX、CCL2、CCR7、SRC、EGF及ITGB2,其中ITGAM节点的度(degree)最高为82(图2)。此外,使用插件MCODE对总共174个节点和1 527个边界进行了分析,PPI网络中提取出5个模块(图3),选择排名第1的子网络,总共有37个节点和316个边界。
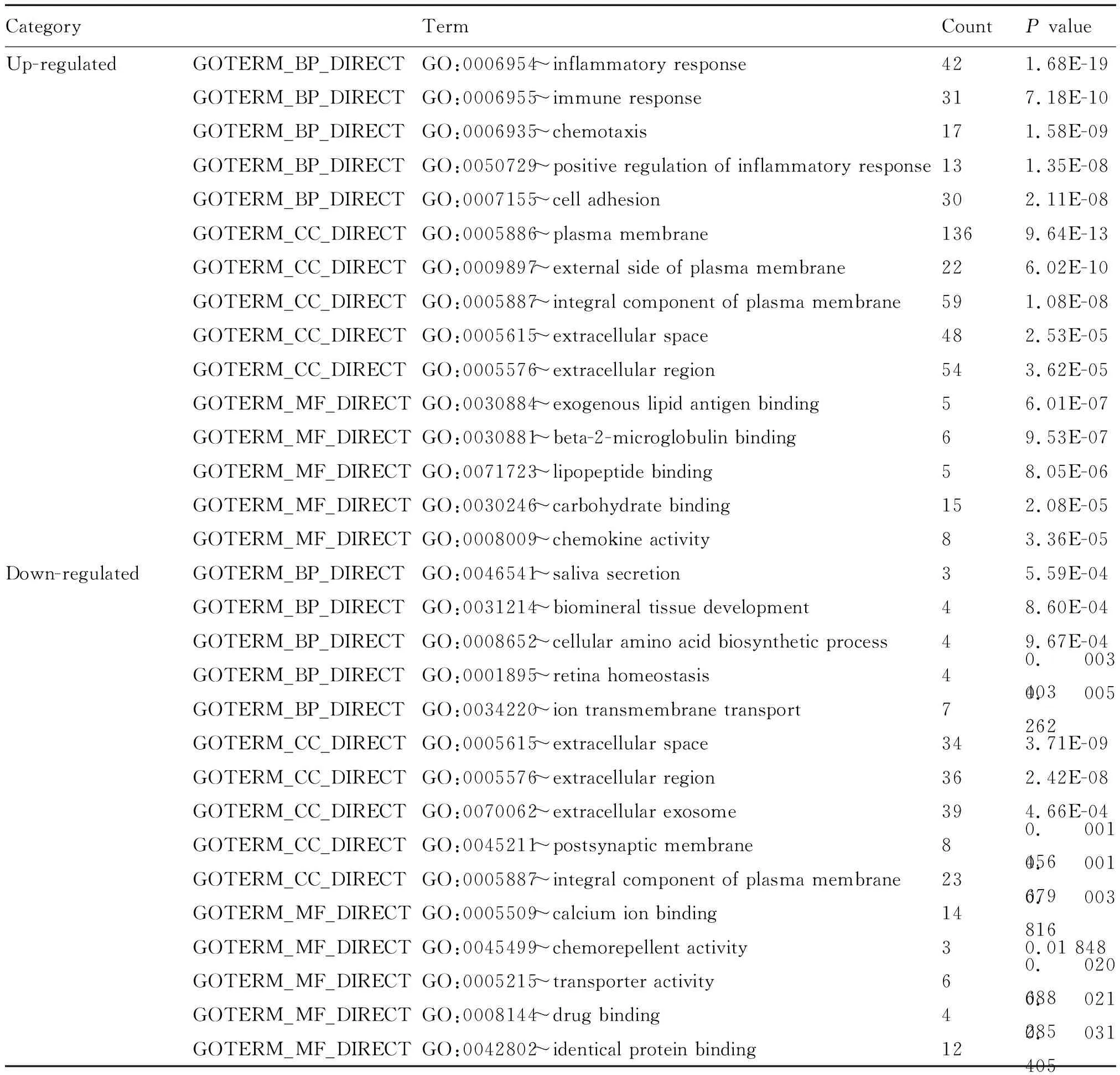
表1 鼻息肉差异表达基因的GO分析Tab.1 GO analysis of differentially expressed genes in nasal polyps
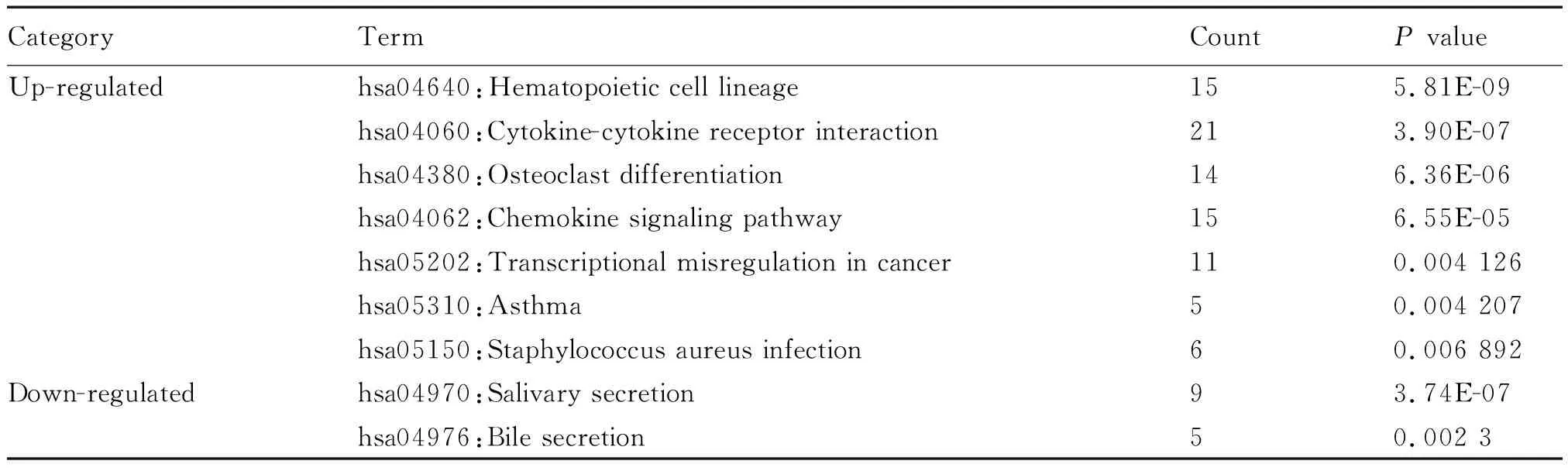
表2 鼻息肉差异表达基因的KEGG分析Tab.2 KEGG analysis of differentially expressed genes in nasal polyps
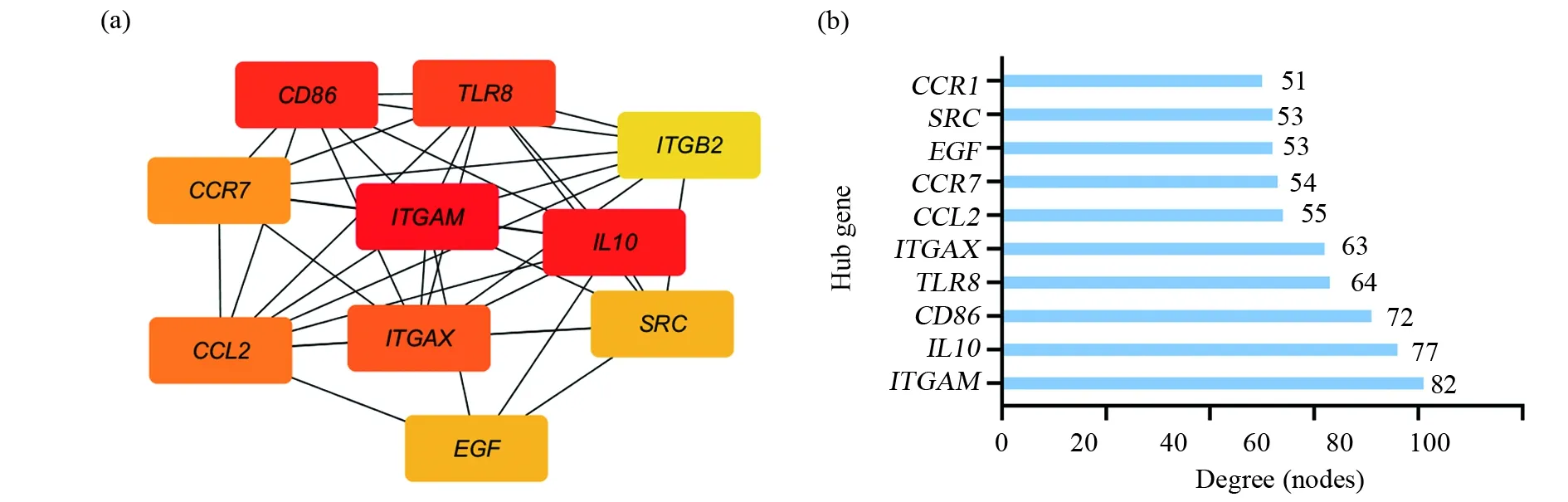
图2 PPI网络分析Fig.2 Analysis of the PPI network(a)从PPI网络中识别的排名前10的关键节点(Hubs);(b)关键节点按照度(Degree)大小排列。y轴表示的是关键节点基因,x轴表示节点的度(a)Top 10 key nodes (Hubs) identified from PPI networks;(b)Hubs genes are arranged in order of Degree. The Y-axis represents the key node gene, and the X-axis represents the Degree of the node
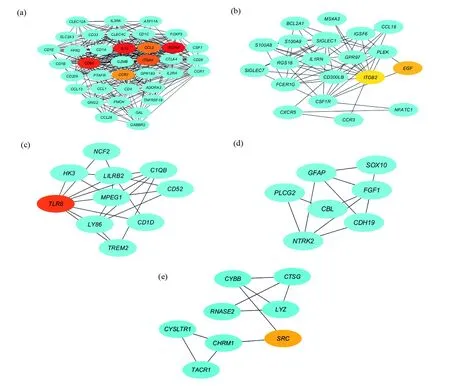
图3 PPI网络中提取出5个模块Fig.3 Five modules were extracted from PPI network(a)模块1;(b)模块2;(c)模块3;(d)模块4;(e)模块5(a)Module 1;(b)Module 2;(c)Module 3;(d)Module 4;(e)Module 5
3 讨论
鼻息肉是耳鼻喉科最常见鼻腔黏膜的慢性炎症性疾病,在成年人中的发病率为1%~2%,组织病理学研究显示,鼻息肉为呼吸上皮覆盖的高度水肿的疏松纤维组织,间质中有大量炎症细胞浸润,多以嗜酸性粒细胞浸润为主,但是其发病机制不清[9],已发现有多个基因、多个信号通路与鼻息肉发生有关。随着基因芯片技术的发展,对基因表达谱芯片数据进行深入挖掘,可以为探寻各种疾病分子机制提供一种全新的研究技术手段。Benito等[10]研究了LTC4S、CYSLTR1、PTGDR和NOS2A基因在鼻息肉中多形态分析,发现这些基因与鼻息肉临床关系密切,在鼻息肉发展中起着重要作用。Fraczekm等[11]应用基因芯片技术发现NOS2A、SERPINA1、UCP2、OXTR和IL-8基因在鼻息肉中表达升高,而LTF、KRT6B、LYZ、SD11B2和MMP-3表达降低。本研究利用生物信息学的方法,从GEO数据集中表达谱数据检索到CRSwNP患者的鼻息肉组织中上调的DEGs显著富集的生物过程,主要包括炎症反应、免疫反应、细胞趋化性、炎症反应的正向调节、细胞的粘附等,该结果和Yao等[12]研究结果类似,但是关键基因有所不同,考虑和对样本的分析方法不同有关。在KEGG通路研究中,上调的DEGs主要在造血细胞系、细胞因子-细胞因子受体相互作用、破骨细胞分化、趋化因子信号通路等信号通路中富集,说明在通路过程中,各种细胞及细胞因子的参与和鼻息肉的形成有一定的关系。
从PPI网络筛选出了前10个关键基因:ITGAM、IL10、CD86、TLR8、ITGAX、CCL2、CCR7、SRC、EGF及ITGB2。其中IL10是主要由单核细胞产生的一种重要的抗炎细胞因子。该细胞因子在免疫调节和炎症中具有多效作用,在对微生物抗原的免疫反应中起负调控作用,另外IL10还具有防止感染过程中过度发炎的功能。几乎所有免疫细胞(包括T细胞、B细胞、巨噬细胞和树突状细胞)都可以发出促炎信号产生IL10[13]。在嗜酸性CRSwNP中,M2巨噬细胞产生的IL10受损可能导致持续的炎症[14]。当暴露于金黄色葡萄球菌肠毒素B后,IL10产生受损可能会加剧嗜酸性CRS的病理生理,包括嗜酸性粒细胞增多和下呼吸道阻塞[15]。研究表明,IL10、IL10相关炎症细胞因子及IL10相关B细胞活化的表达升高提示IL10是一种强抗炎细胞因子,在CRSwNPs的发病机制中起关键作用[16]。
整合素亚基Alpha M(integrin subunit Alpha M,ITGAM)是一种蛋白质编码基因。该基因编码整联蛋白αM链。整联蛋白是由α链和β链组成的异二聚体整体膜蛋白。αMβ2整联蛋白在嗜中性粒细胞和单核细胞黏附于刺激的内皮细胞以及补体包被颗粒的吞噬作用中很重要。与ITGAM相关的疾病包括系统性红斑狼疮[17]、IgA肾病[18]和粒细胞减少症。参与的相关途径包括MAPK-Erk途径和吞噬体(phagosome)的形成[13],但是针对鼻息肉中的ITGAM的研究还没有涉及。
CD86基因编码的蛋白为免疫球蛋白超家族成员的I型膜蛋白。该蛋白由抗原呈递细胞表达,它是T细胞表面上两种蛋白质的配体,即CD28抗原和与细胞毒性T淋巴细胞相关的蛋白4(cytotoxic T-lymphocyte associated protein-4,CTLA-4)。通过结合CD28或CTLA-4,受体参与了T淋巴细胞增殖和白介素2产生的共刺激信号,可能在T细胞活化的早期事件和对幼稚T细胞的共同刺激中起关键作用。该蛋白与CD28抗原的结合是对T28细胞的共刺激信号。该蛋白与CTLA-4的结合会负面调节T细胞活化并减少免疫反应[13],但是针对鼻息肉中的CD86的研究也还没有涉及。
本研究的结果只是对来源于GEO数据库下载的表达谱数据进行分析后获得,芯片数据只包含24个样本,其中鼻息肉组织和对照组织样本量相对较少,其结果有可能出现一定偏差,因此还需要更多的临床组织样本来进行证实。从DEGs数据构建的PPI网络中列出的前10个关键基因中,按照节点的度的高低排列后,发现筛选出的基因及通路大多数都未有基础研究文献供分析和验证,因此还需要有更多研究来进一步验证和阐明基因集富分析的结果。
综上所述,本研究获得的鼻息肉差异表达基因的生物信息学分析结果,虽然还需要基础研究的数据支持,但是分析结果为鼻息肉发病机制的研究提供了新思路,为后续进一步进行基础研究给予了较好的提示和参考作用。
