盐度对虎斑乌贼幼体存活、生长及免疫的影响
2020-05-26沈晔刘碧海王兴强崔春辉秦传新
沈晔 刘碧海 王兴强 崔春辉 秦传新
摘 要:虎斑乌贼(Sepia pharaonis)是热带和亚热带海区的头足类软体动物,具有重要的经济价值。通过开展盐度对虎斑乌贼幼体存活、生长及免疫的影响试验,结果表明,虎斑乌贼幼体能够适应的盐度范围很大,但当盐度(盐度17)过低时,幼体几乎不能生存,活力不高、反应迟钝直至死亡;盐度对虎斑乌贼幼体的体重增长具有显著的影响(P<0.05),幼体在高盐(盐度26~32)时的生长率较高,低盐(盐度20~23)环境下生长比较缓慢;不同盐度对虎斑乌贼幼体的免疫调节也具有显著的影响。当盐度为20~23时,幼体超氧化物歧化酶的活性最高,盐度29时相对较低;推测虎斑乌贼幼体的最适盐度为26~28。
关键词:虎斑乌贼;盐度;存活率;生长率;免疫
中图分类号 S917.4 文献标识码 A 文章编号 1007-7731(2020)07-0076-04
Abstract: Sepia pharaonis is a cephalopod of tropical and subtropical seas, which has important economic value. In this study, the effects of salinity on the survival, growth and immunity of squid larvae were studied. The results showed that the range of salinity that the larvae could adapt to was very large, but when the salinity was too low (salinity 17), the larvae could hardly survive, with low activity, slow response and even death. Salinity had a significant effect on the growth of body weight(P<0.05). The growth rate of larva was higher in high salt (salinity 26-32), and slower in low salt (salinity 20-23). Different salinity also had a significant effect on the immune regulation of larva. The activity of superoxide dismutase(SOD) was the highest when salinity was 20-23, and it was relatively low when salinity was 29. It is suggested that the optimum salinity of the larva is 26-28.
Key words: Sepia pharaonis; Salinity; Survival Rate; Growth Rate; Immune
虎斑乌贼(Sepia pharaonis)属于头足纲、乌贼科的软体动物,因胴背具许多虎斑而得名,分布于印度洋和太平洋等海域[1]。在我国,台湾和南海沿海地区也是虎斑乌贼正常的栖身场所。虎斑乌贼具有生长迅速、耐拥挤、耐运输、抗病性强、营养价值较高等特点,是具有极大养殖前景的经济头足类[2-4]。通常生活在水层底部,喜静置,以节省能量消耗,前端能发出触腕来猎取食物,且具有残食现象,其幼体可能遭到攻击,导致生长受到抑制[5-6]。大部分乌贼都是广盐品种,而虎斑乌贼适应的盐度范围更大一些,适应温度范围较小,也无性早熟的特点。然而,受过度捕捞和环境污染等多重因素的影响,虎斑乌贼的自然资源量已逐渐减少。在国外如泰国等地,虎斑乌贼的人工养殖已有了一定的基础,而我国乌贼养殖技术仍相对落后。當前,对于乌贼的研究主要涉及生长、行为、胚胎发育、摄食、营养成分等领域[7-11]。虎斑乌贼受精卵的孵化率以及幼体存活率在不同的海水盐度中变化较大。虎斑乌贼能够适应的盐度范围变化很大,但对乌贼幼体生存具有一定的影响,当盐度过分低时,幼乌几乎不能够生存[12];当盐度为15左右时,虎斑乌贼的受精卵几乎不会存活;当盐度大于22、低于33时,盐度对乌贼受精卵的影响趋势变小,几乎无变化[13]。本研究通过为期30d的不同盐度试验,探讨了盐度对虎斑乌贼幼体存活率、生长率及免疫调节的影响,以期得到虎斑乌贼幼体的适宜生长盐度,为虎斑乌贼的幼体繁育提供理论依据。
1 材料与方法
1.1 试验材料
1.1.1 试验生物 试验在连云港市农业农村局大板桥养殖基地进行。试验生物是来自广东空运过来的虎斑乌贼,取其受精卵,先在室内育苗池内孵化一段时间,孵化完毕之后,在其中选取体格健康,活力旺盛的乌贼幼体作为试验试体。
1.1.2 试验装置 (1)在虎斑乌贼幼体孵化出来之后,用培养池来赡养乌贼幼苗。培养池采用的是6个直径1.6m,高1m的圆形塑料池子。(2)试验用水是天然海水,经纱滤后,加入淡水以调节适当的盐度,达到实验要求。需要注意的是盐度的调节不能过快,缓慢调节用水盐度的下降,每隔2d换2/3水。(3)室内育苗池一般会配备相应的蓄水池(水源来自后屋的海水中),蓄水池的规格一般为底面积12m2、深3m。这种蓄水池基地准备了5个,用以换水沉淀,沉淀的海水通常用漂白粉消毒,每1m3海水加入20~30g的漂白粉,随后让水池静置沉淀以及曝气1~2d。静置沉淀过的海水还需去除其中的氯,向其中加入适量的硫代硫酸钠(Na2S2O3),剂量与漂白粉成1∶1的比例。(4)试验使用功率1.1kW,风压17.6kPa,风量180m2/h的增氧机。每个池子的两边均匀分布着6个排气孔连着6根气石,但由于水体压强以及氧气供应量的要求,关闭了部分排气孔,以保证其他出气孔有足够的压强输出氧气。
1.1.3 饵料来源 乌贼幼体刚孵化出世的3d内,可以由其自身免疫来维持营养需求。但随着时间的延长,乌贼幼体摄食量日渐增加,必须从外界摄取食物。挠足类、轮虫和丰年虫均是乌贼幼体的主要饵料[14]。其中,挠足类可以从基地外的塘口里捕获,塘口与外界海水是相通的,海水中富含糠虾以及挠足类,这是本次乌贼幼体前期颇为重要的饵料来源。每天傍晚时分,用聚光灯照射水面,糠虾、挠足类因其趋光习性会聚集在聚光灯下,然后用80~100目的网捞取后投入培养池中,期间不需要投入其他饵料。
1.2 试验方法
1.2.1 试验设计 试验在6个相同规格的培养池中进行,分别设17、20、23、26、29和32等6个盐度梯度,每个处理设3个重复,即在每个培养池中放置3个相同规格的塑料筐(40×30×20cm),并用绳子系着几块泡沫使其悬浮于池中。每个筐放入40只虎斑乌贼幼体(胴长:1.41±0.05cm,体重:0.62±0.04g)。试验周期为30d,试验期间水体温度在20~25℃,pH维持在7.50~8.00,连续充分曝气。30d后每筐取存活乌贼幼体各10尾,去除墨囊,全程低温操作。加入3mL生理盐水,匀浆,4℃、3000r/min条件下冷冻离心机离心20min,取上清液用于酶活测定。
1.2.2 试验步骤 (1)将乌贼幼体分置养殖30d,处于6个盐度环境,记录乌贼幼体初始投入量(只),经过一段时间的养殖后记录乌贼幼体存活量(只),算出存活率(%);(2)在养殖不同盐度下虎斑乌贼幼体30d的同时,记录初始乌贼体重(g),实验结束后,测量乌贼幼体末的体重(g),最终根据乌贼幼体的特定生长率公式计算出乌贼的生长率SGR(%):
(3)研究乌贼的免疫调节机制,探究6种不同盐度梯度下的环境对虎斑乌贼幼体的免疫影响。本次试验通过超氧岐化酶活性(Superoxide Dismutase,SOD)来反映盐度对其免疫调节的影响,采用购自南京建成生物工程研究所的试剂盒进行总SOD活力(U/mgprot)测定,其定义每mg组织蛋白在1mL反应液中SOD抑制率达50%时反应的SOD量为1个活力单位(U)[15-16]。
最后,利用IBM SPSS Statistics统计学软件分析、Turkey多重比较等进行所得数据的一系列处理,作出不同盐度与虎斑乌贼幼体存活率、特定生长率和SOD活性的散点图,用Excel表格做出相对应的柱状图并标上误差,运用SPSS软件分析各组所得数据,以a-d作为标签表示平均值组间的差异(P<0.05)。
2 结果与分析
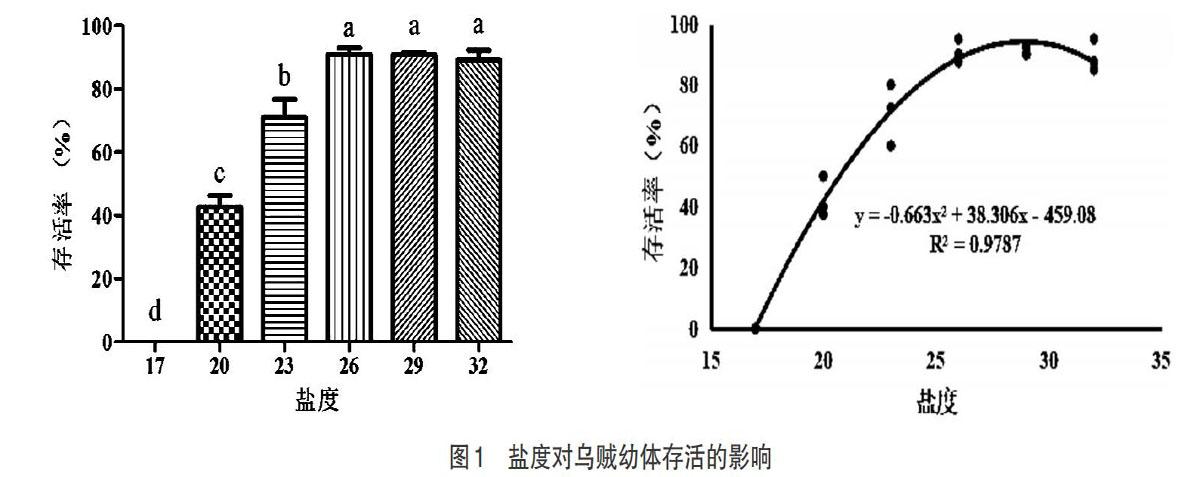
2.1 盐度对存活率的影响 由图1可知,乌贼幼体在低盐度17以下时不能生存,随着盐度的提升,乌贼能够存活的数量越来越多。乌贼幼体的存活率随盐度的变化明显波动,当盐度范围处于26~32时,幼体的存活率最高,说明此时乌贼处于最适的盐度范围。经回归分析发现,最适盐度为28.89。
2.2 盐度对生长率的影响 由图2可知,随着盐度的升高,乌贼幼体末体重呈现先增长后下降的趋势;当盐度在23度以下时,乌贼体重显著降低,在盐度26~29时乌贼的体重达到顶峰;回归分析发现,最适盐度为28.17。不同盐度对乌贼幼体的体重影响显著(P<0.05)。
由图3可知,乌贼幼体的生长率SGR(%)随盐度的上升呈现出先高后低的趋势,乌贼的生长率在26和29盐度时到达峰值,高达5.0左右。因此,可以推断出盐度范围26~29满足幼乌的最佳生长要求。经回归分析发现,最适盐度为27.97。
2.3 盐度对SOD活性的影响 由图4可知,随着盐度的变化,乌贼幼体的免疫调节也随之下降。盐度对虎斑乌贼幼体内SOD值影响显著(P<0.05)。可以看出,在盐度范围20~32内,盐度20~23时,测得的SOD值最高,此时幼乌的免疫强度达到最高;盐度29时,虎斑乌贼幼体内SOD酶的活性较低。
3 讨论与结论
盐度胁迫对乌贼的生长免疫具有重要的影响。盐度过低时,乌贼幼体在进食时较易出现旋转、喷墨等轻微抽搐现状,逐渐死亡;当盐度处于正常时,出现的喷墨等现状也趋于正常,可以通过自我免疫进行调节[17-18]。不同的乌贼对盐度的适应范围也有所不同,如虎斑乌贼适应的盐度为17~30,曼氏无针乌贼(Sepiella maindroni)适应的盐度范围为12~32,拟目乌贼(Sepia lycidas)的适应盐度为21~33等[19]。本次试验结果得出,盐度对虎斑乌贼幼体生存具有一定制约,幼体能够适应的盐度范围变化很大,当盐度过低(盐度17)时,幼乌几乎不能够生存,活力不显,反应迟钝直至死亡;盐度在26~32时,30d后虎斑乌贼幼体的存活率为90.83%左右。文菁等[12]研究发现,在盐度为23、28、33条件下,虎斑乌贼幼体48h内存活率较高,均愈80%。
试验结果表明,盐度会影响虎斑乌贼的特定生長率,当盐度处于20以下时,30d后乌贼的生长率显著下降,幼体很难存活与生长。乐可鑫等研究发现,21d后盐度21组的虎斑乌贼幼体特定生长率处于最低值[18]。本次研究发现,经不同盐度实验30d后,在盐度20~30范围内,虎斑乌贼幼体末体重及特定生长率(SGR)均呈现先升后降的趋势;当盐度在26~29时,乌贼的体重达到顶峰,特定生长率为5.15~5.20%,产量最高。由SGR随盐度变化曲线图可以看出,盐度28左右,其生长率达到最大值。
本次试验中,盐度胁迫对虎斑乌贼免疫调节的影响是通过超氧化物歧化酶活性来反映的。超氧化物歧化酶是一种抗氧化金属酶,能够防御氧毒性[20]。本研究发现,不同的盐度层次下虎斑乌贼幼体的SOD酶活性的变化明显。盐度对SOD酶活性的影响与其对特定生长率的影响不同,其变化趋势呈现先下降后上升,盐度在26~32时,SOD酶活性较低;在20~23时,SOD酶活性为62.53%~62.74%,幼体免疫抵抗最高。
本次试验结果表明,不同盐度试验后30d,在盐度20~30范围内,虎斑乌贼幼体的存活率、末体重及特定生长率(SGR)皆在盐度26~29时达到顶峰。并且由存活率、SGR随盐度变化的曲线得出,盐度为28左右时,存活率和生长率到达最高点;盐度29时,乌贼幼体内SOD酶活性较低。由此推测,虎斑乌贼幼体的最适盐度在26~28。
参考文献
[1]Jereb P,Roper C F E. Cephalopods of the world: An annotated and illustrated catalogue of cephalopod species known to date,volume 1. Chambered nautiluses and Sepioids(Nautilidae,Sepiidae,Sepiolidae,Sepiadariidae,Idiosephiidae and Spirulidae)[M]. Food and agriculture organization of the United Nations,2005.
[2]高晓兰,蒋霞敏,乐可鑫,等.野生虎斑乌贼不同组织营养成分分析及评价[J].动物营养学报,2014,26(12):3858-3867.
[3]戴宏杰,孙玉林,冯梓欣,等.雌性虎斑乌贼缠卵腺营养成分分析与评价[J].食品科学,2016,37(14):97-103.
[4]Minton J W,Walsh L S,Lee P G,et al. First multi-generation culture of the tropical cuttlefish Sepia pharaonis Ehrenberg,1831[J]. Aquaculture International,2001,9(5):379-392.
[5]Jiang M,Ruan P,Peng R,et al. Effects of size dominance on the survival,growth and physiological activities of juvenile pharaoh cuttlefish(Sepia pharaonis)[J]. Journal of Experimental Marine Biology and Ecology,2020,525:1-9.
[6]乐可鑫,汪元,彭瑞冰,等.饥饿和再投喂对虎斑乌贼幼体存活、生长和消化酶活力的影响[J].应用生态学报,2016,27(06):2002-2008.
[7]陈道海,王雁,梁汉青,等.虎斑乌贼(Sepia pharaonis)胚胎发育及孵化历期观察[J].海洋与湖沼,2012,43(02):394-400.
[8]蒋霞敏,罗江,彭瑞冰,等.水泥池养殖条件下虎斑乌贼的生长特性[J].宁波大学学报(理工版),2014,27(02):1-6.
[9]王双健,丁玉惠,周爽男,等.虎斑乌贼喷墨卵与正常卵的比较[J].水产学报,2017,41(03):366-373.
[10]Aewsiri T,Benjakul S,Visessanguan W. Functional properties of gelatin from cuttlefish(Sepia pharaonis) skin as affected by bleaching using hydrogen peroxide[J]. Food Chemistry,2008,115(1):243-249.
[11]戴宏杰.虎斑乌贼肌肉糖蛋白分离纯化、结构分析及其抗氧化活性初步研究[D].杭州:浙江工商大学,2015.
[12]文菁,曹观蓉,李施颖,等.环境因子对虎斑乌贼幼体存活率及行为的影响[J].水产科学,2011,30(06):321-324.
[13]黄建盛,陈刚,张健东,等.盐度对虎斑乌贼(Sepia pharaonis)受精卵孵化及幼体活力的影响[J].广东海洋大学学报,2012,32(01):35-38.
[14]谢晓晖,黄国光,梁伟峰,等.虎斑乌贼幼体的摄食、排泄及不可逆点的研究[J].大连海洋大学学报,2011,26(04):352-355.
[15]王凡,赵元凤,吕景才,等.铜对牙鲆CAT、SOD和GSH-PX活性的影响[J].华中农业大学学报,2007(06):836-838.
[16]樊甄姣,夏灵敏,吴常文,等.亚硝酸氮对曼氏无针乌贼幼体的急性毒性及免疫系统的影响[J].河北渔业,2009(07):8-11.
[17]Jiang M,Zhao C,Yan R X,et al. Continuous Inking Affects the Biological and Biochemical Responses of Cuttlefish Sepia pharaonis[J]. Frontiers in physiology,2019,10:1429.
[18]樂可鑫,蒋霞敏,彭瑞冰,等.4种生态因子对虎斑乌贼幼体生长与存活的影响[J].生物学杂志,2014,31(04):33-37.
[19]彭瑞冰,蒋霞敏,于曙光,等.几种生态因子对拟目乌贼胚胎发育的影响[J].生态学报,2013,33(20):6560-6568.
[20]杨卫健,张双全.超氧化物歧化酶的研究及应用前景[J].淮阴师范学院学报(自然科学版),2002,1(04):82-86.
(责编:张宏民)
