?土壤干旱胁迫及复水对黑果腺肋花楸生理指标的影响?
2020-05-25胡艳艾力江·麦麦提安尼瓦尔·艾木都古丽买然木·吐尼亚孜阿不都外力·吐尔洪
?胡艳 艾力江·麦麦提 安尼瓦尔·艾木都 古丽买然木·吐尼亚孜 阿不都外力·吐尔洪?


摘 要:以2年生黑果腺肋花楸为材料,采用盆栽形式进行土壤逐渐干旱胁迫及旱后复水处理,通过测定渗透调节物质含量及抗氧化酶活性等指标,探讨黑果腺肋花楸对土壤干旱及复水的响应特点。结果表明:随着干旱胁迫时间的延长,黑果腺肋花楸叶片超氧化物歧化酶活性、可溶性糖和游离脯氨酸含量均显著增加(P<0.05),过氧化氢酶活性显著降低(P<0.05),可溶性蛋白质含量和过氧化物酶活性的变化不明显;复水后,各项生理指标都有所恢复,并保持相对较高的叶片相对含水量;表明在干旱胁迫下,黑果腺肋花楸通过调节自身渗透调节物质含量和抗氧化酶活性等一系列生理指标适应土壤干旱胁迫,表现出较强的抗旱力。
关键词:黑果腺肋花楸;渗透调节物质;抗氧化酶;土壤逐渐干旱;复水
中图分类号:Q945.78 文献标识码:A文章编号:1006-060X(2020)04-0012-04
Effects of Soil Gradual Drought and Watering Recovery on Physiological Indexes of
Aronia melanocarpa
HU Yan,Ailijiang Maimaiti,Anniwaer Aimudu,Gulimairanmu Tuniyazi,Abuduwaili Tuerhong
(College of Forestry and Horticulture, Xinjiang Agricultural University, Urumqi 830052, PRC)
Abstract: Two-year-old Aronia melanocarpa plants were subjected to 30 d water deficit induced by withholding water, and its response to gradual drought stress and changes in the levels of osmotic regulation substance as well as in activities of antioxidant enzymes were investigated. The results showed that with the prolongation of drought stress, the activities of superoxide dismutase (SOD), soluble sugar and
free proline content in the leaves of Aronia melanocarpa increased significantly (P <0.05); the catalase activity (CAT) decreased significantly
( P <0.05); there was no significant change in soluble protein content and peroxidase activity(POD) during the treatment. After rewatering, all physiological indexes were recovered, and the relative water content of the leaves was relatively high. The maintenance of leaf physiological
function and high leaf water status suggests that Aronia melanocarpa resistance to drought stress could be associated with increases in the contents of proline and soluble sugars and higher oxidative scavenging ability, especially activities of superoxide dismutase.
Key words: Aronia melanocarpa; osmotic adjustment; antioxidant enzymes; soil gradual drought; watering recovery
在我國干旱及半干旱地区,土壤干旱限制林业的生产和推广,因此,亟需培育抗旱性强的树种[1]。通过植物对环境胁迫生理反应的研究,了解植物对逆境的适应机制,有助于在生产上采取相应的措施,降低逆境对植物造成的伤害[2]。许多研究证实,在逆境条件下植物的抗氧化酶活性变化和渗透调节物质的积累在植物抗逆中发挥着极大作用,是反映植物抗旱性强弱的重要生理指标[3-5]。
黑果腺肋花楸(Aronia melanocarpa),属蔷薇科腺肋花楸属落叶灌木,原产地在美国东北部[6]。在我国三北地区,符合下列生物气候条件和土壤条件的地区都可以栽培[7]。黑果腺肋花楸是集食用、药用、园林和生态等价值于一身的珍贵树种[8]。目前,国内外学者的研究大多集中在黑果腺肋花楸的繁殖育苗栽培、药用价值等方面[9-10],而有关黑果腺肋花楸抗旱性的研究则未见报道。笔者以盆栽形式进行土壤逐渐干旱胁迫和干旱后复水处理,分析黑果腺肋花楸在土壤逐渐干旱胁迫及复水过程中渗透调节物质含量和抗氧化酶活性的变化,为在干旱及半干旱地区推广种植黑果腺肋花楸提供科学依据。
1 材料与方法
1.1 试验材料与试验设计
试验在新疆农业大学林学与园艺学院大棚网室里进行。2018年5月,选取生长健壮、长势基本一致的二年生黑果腺肋花楸苗木为供试材料,进行苗木盆栽培育(每盆1株,花盆的内径38 cm,深45 cm),栽培基质为园土∶沙子=2∶1 的混合基质。处理前进行常规管理,保证其生长良好。2018年8月4日开始进行处理,干旱胁迫处理前1 d浇透水使土壤水分饱和(以花盆底部有水流出为准),以后不再浇水使其自然干旱下形成土壤逐渐干旱胁迫梯度。采用模拟自然干旱胁迫的方法,在防雨棚中进行,停止灌溉后在不同时期测得的土壤含水量作为不同处理组,分别干旱胁迫15和30 d,再进行复水处理,以正常浇水管理组作为对照。在干旱胁迫15和30 d以及复水后5 d采集中上部叶片,冲洗干净,用液氮冷冻,置于保鲜盒内,带回实验室-80℃低温冰箱保存用于测定相关生理指标。
1.2 项目测定与方法
土壤含水量的测定参照王燕凌等[11]的土壤烘干称重法;叶片相对含水量的测定参照王燕凌等[11]的饱和称重法;细胞膜相对透性采用电导仪测定[12];游离脯氨酸含量采用酸性茚三酮法测定[13];可溶性蛋白质含量采用考马斯亮蓝染色法测定[13];可溶性糖采用硫酸蒽酮比色法测定[13];超氧化物歧化酶(SOD)活性采用氮蓝四唑光还原法测定[12];过氧化物酶(POD)活性采用愈创木酚氧化法测定[14];过氧化氢酶(CAT)活性采用紫外吸收法测定[12]。
1.3 数据处理
应用Execl 2010软件进行数据处理和作图。利用SPSS 18.0软件采用Dancan新复极差法进行数据统计与分析。
2 结果与分析
2.1 试验期间土壤含水量和叶片相对含水量的变化
由图1A可知,随着停灌时间的延长,土壤含水量不断降低。停灌后,表层和深层的土壤含水量变化趋势一致,但深层的土壤含水量比表层的土壤含水量高。停灌30 d时,表层和深层的土壤含水量分别下降了20.06和17.41个百分点。
干旱胁迫及复水对黑果腺肋花楸叶片相对含水量的影响如图1B所示。随着干旱胁迫的逐渐加剧,黑果腺肋花楸叶片相对含水量明显下降。干旱处理30 d时,黑果腺肋花楸叶片相对含水量下降到最小值,与CK相比,呈现显著差异(P<0.05)。复水后,黑果腺肋花楸叶片相对含水量迅速升高,比干旱处理30 d高5.15 %。
2.2 干旱胁迫及复水对黑果腺肋花楸叶片质膜透性的影响
由图2可见,随着干旱胁迫的逐渐加剧,细胞膜相对透性逐渐增加。干旱处理15和30 d時,细胞膜相对透性分别比CK高11.91和25.28个百分点,干旱处理30 d时的细胞膜相对透性比干旱处理15 d高13.37个百分点。复水后,细胞膜相对透性有明显的恢复,与CK相比无显著性差异(P>0.05)。
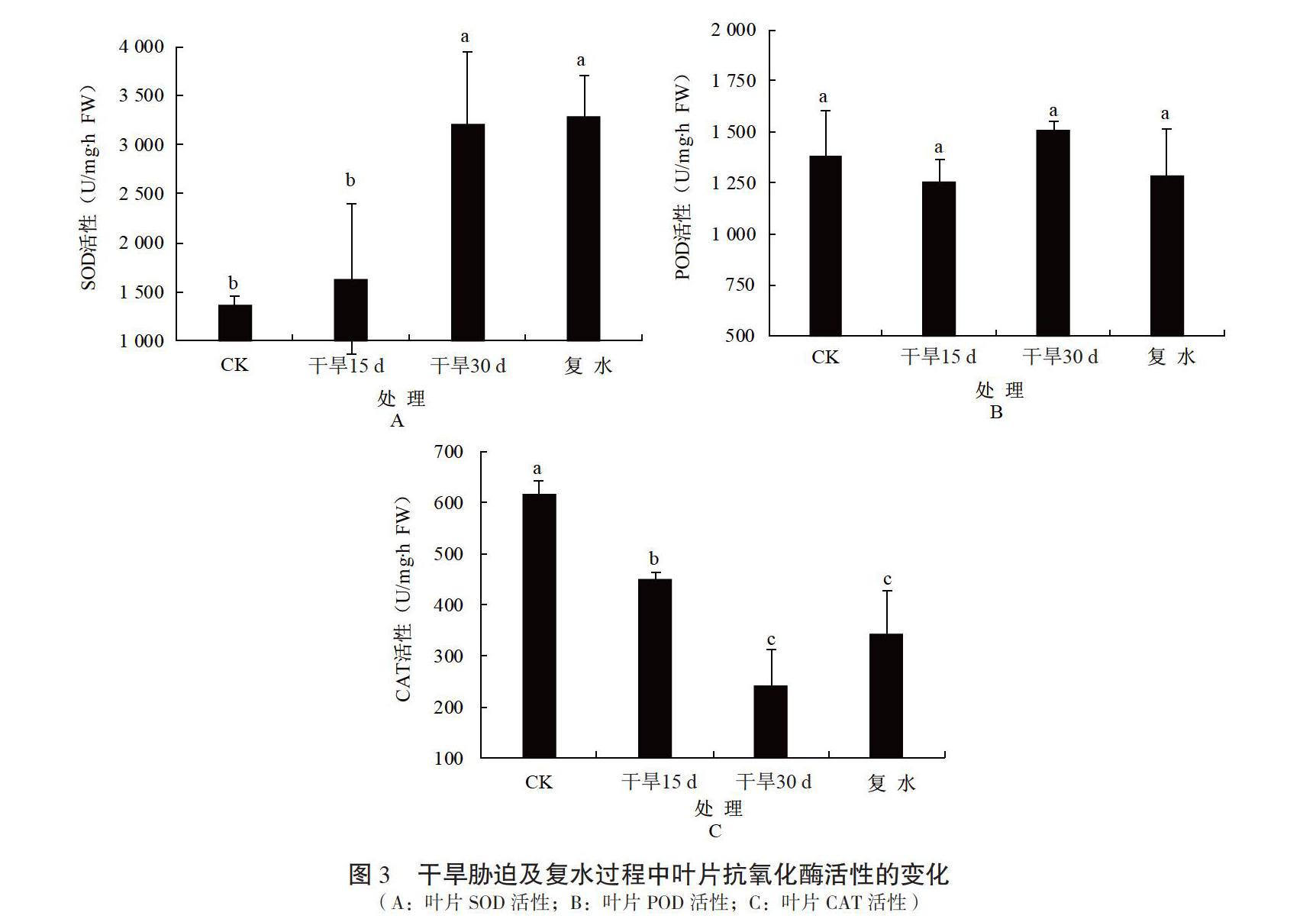
2.3 干旱胁迫及复水对黑果腺肋花楸叶片抗氧化酶活性的影响
黑果腺肋花楸叶片抗氧化酶活性对干旱胁迫的响应,其受干旱影响的变化见图3。干旱胁迫15 d(图3A),叶片中的SOD活性高于CK,处理30 d时及复水后,SOD活性显著增加(P<0.05),说明干旱胁迫激活了SOD活性;复水后SOD值仍保持较高水平,其值与干旱胁迫处理30 d时差异不显著(P>0.05)。由图3B可知,POD活性随着胁迫时间的延长呈现先降后升的趋势;干旱处理30 d,POD活性达到最大值,为1 510.82 U/mg·h FW,干旱胁迫和复水过程中POD活性变化不明显(P>0.05)。由图3C可看出,在干旱胁迫处理15和30 d,CAT活性分别比CK显著性降低;复水后,CAT活性增加不显著(P>0.05)。
2.4 干旱胁迫及复水对黑果腺肋花楸叶片渗透调节物质含量的影响
从干旱胁迫及复水后黑果腺肋花楸叶渗透调节物质含量测定结果(图4)可看出,干旱胁迫处理15和30 d,可溶性蛋白质含量分别为39.44和34.30 mg/g FW,分别比CK下降了22.04%和32.21%;复水后,可溶性蛋白质含量略有上升(图4A)。由图4B可知,随着干旱胁迫时间的延长,脯氨酸含量逐渐增加,干旱处理15和30 d,脯氨酸含量分别为116.94和146.24 μg/g FW,分别比CK增加了36.37%和70.54%
(P<0.05);复水后,脯氨酸含量迅速降低。由图4C可知,经干旱胁迫处理15和30 d,可溶性糖含量为2 970.71和3 588.23 μg/g FW,分别比CK著性增加了20.49%和45.54%(P<0.05);复水后,可溶性糖含量迅速降低。
3 讨论与结论
叶片相对含水量是植物组织水重占饱和组织水的比率,它对环境中水分的变化较为敏感,能在一定程度上反映植物水分亏缺程度[15]。在试验中,黑果腺肋花楸叶片相对含水量随着干旱胁迫时间的延长而逐渐下降,干旱胁迫处理30 d,黑果腺肋花楸叶片相对含水量仍然保持70.29%,复水后,黑果腺肋花楸叶片相对含水量迅速升高,说明黑果腺肋花楸具有较强的保水力,与在木本植物[16]和甘蔗[17]等作物上的研究结果相同。随着胁迫时间的延长,黑果腺肋花楸叶片细胞膜相对透性呈上升趋势,说明干旱胁迫对黑果腺肋花楸的细胞膜造成一定的伤害。复水后,黑果腺肋花楸叶片细胞膜相对透性有所下降,说明旱后复水能减轻干旱胁迫对黑果腺肋花楸细胞膜造成的伤害。
植物体内的抗氧化物酶起着清除逆境下产生的活性氧,防止膜脂过氧化的重要作用[18]。在试验中,随着干旱胁迫的逐渐加剧,SOD活性逐渐增加,CAT活性显著降低,POD活性变化不明显。随着干旱时间的不同,各处理的变化幅度也不相同,其中对照和干旱15 d 的SOD活性并无显著差异,但是干旱30 d后黑果腺肋花楸的SOD活性迅速上升,表明干旱胁迫加剧激活了SOD活性水平,使其清除自由基的能力加强,进而有效保护植物膜系统。POD活性变化不明显,这可能是POD作为细胞内的一种保护酶,对黑果腺肋花楸起保护作用所需时间较长。随着干旱胁迫时间的延长,CAT活性呈现一直下降的趋势,说明黑果腺肋花楸对轻度干旱有一定忍耐能力。综上所述,黑果腺肋花楸叶片中的SOD和CAT在干旱胁迫防御膜脂过氧化过程中发挥了重要作用。
可溶性蛋白质、脯氨酸和可溶性糖是具有渗透调节能力的有机物质,是植物逆境胁迫的产物,是体现植物抗逆性的重要指标[19]。在试验中,随着干旱胁迫时间的延长,黑果腺肋花楸叶片中可溶性糖含量和脯氨酸含量均逐渐增加,且复水后,可溶性糖含量和游离脯氨酸含量均迅速降低。这说明黑果腺肋花楸受到干旱胁迫时,通过增加可溶性糖含量和游离脯氨酸含量来有效降低细胞的渗透势,保证植物内物质新陈代谢的正常运行。
总的来说,黑果腺肋花楸受到土壤干旱胁迫时,通过增加体内的可溶性糖和脯氨酸含量,提高SOD活性,同时降低自身的CAT活性,并保持相对较高的叶片相对含水量、可溶性蛋白质含量和POD活性以适应干旱环境。复水后,各项生理指标都有所恢复,说明黑果腺肋花楸具有较强的抗干旱和恢复能力。
参考文献:
[1] 张慕黎. 刺槐和侧柏苗木对干旱胁迫及旱后复水的生理反应研
究[D]. 杨凌:西北农林科技大学,2009.
[2] 曹 晶. 不同水分逆境对红叶石楠幼苗光合作用及相关生理特性的影响研究[D]. 南京:南京农业大学,2006.
[3] Trung D T ,李 健,张风娟,等. 干旱胁迫下不同甘蔗品种叶片抗氧化酶活性和渗透调节物质含量的变化[J]. 热带作物学报,2018,39(5):858-866.
[4] 马小卫. 长柄扁桃(Amygdalus pedunculata Pall.)抗旱机制研究[D]. 杨凌:西北农林科技大学,2006.
[5] 裴 斌,张光灿,张淑勇,等. 土壤干旱胁迫对沙棘叶片光合作用和抗氧化酶活性的影响[J]. 生态学报,2013,33(5):1386-1396.
[6] Kulling S E ,Rawel H M . Chokeberry (Aronia melanocarpa) – A review on the characteristic components and potential health effects [J]. Planta Medica,2008,74(13):1625-1634.
[7] 艾志强,李相全,高金辉. 几种植物生长调节剂对黑果腺肋花楸扦插生根的影响[J]. 林业科技,2019,44(6):12-14.
[8] 韩文忠,马兴华. 黑果腺肋花楸的生物学特性和应用价值[J]. 辽宁林业科技,2005(4):40-42.
[9] 王 柳,许一鸣,牟 贺,等. 黑果腺肋花楸功效及药用食用研究进展[J]. 现代食品,2018(7):53-56 .
[10] 陈 君,史春凤,王 旭,等. 黑果腺肋花楸繁殖研究现状及解决对策分析[J]. 吉林农业科技学院学报,2017,26(4):17-19.
[11] 王燕凌. 植物生理学实验指导[M]. 北京:中国农业出版社,2014.
[12] 高俊凤. 植物生理学实验指导[M]. 北京:高等教育出版社,2006.
[13] 郝建军. 植物生理学实验技术[M]. 北京:化学工业出版社,2007.
[14] 蔡永萍. 植物生理学实验指导[M]. 北京:中国农业大学出版社,2014.
[15] 马艳丽,朱 虹,王 鹏. 水分胁迫对3个枣品种电导率和叶片相对含水量的影响[J]. 林业科技,2016,41(6):15-17,59.
[16] 耿云红. 干旱胁迫对绿化木本植物抗逆性研究[J]. 山东农业大学学报(自然科学版),2019(1):12-18.
[17] 李 健,农艳丰. 干旱脅迫对2个甘蔗品种生长和生理生化特性的影响[J]. 安徽农学通报,2018,24(21):25-28,63.
[18] 周欢欢,傅卢成,马 玲,等.干旱胁迫及复水对‘波叶金桂生理特性的影响[J].浙江农林大学学报,2019,36(4):687-696.
[19] 祁伟亮,冯 鸿,刘松青,等. 不同桑品种在干旱胁迫下脯氨酸及可溶性蛋白质含量的变化规律研究[J]. 中国野生植物资源,2017,36(5):34-36,39.
(责任编辑:肖彦资)
