大豆不同水氮胁迫响应规律的高光谱分析
2020-05-25于海业陈美辰朴兆佳李发秦尉隋媛媛
刘 爽,于海业,陈美辰,朴兆佳,于 通,李发秦尉,隋媛媛
吉林大学生物与农业工程学院,吉林 长春 130022
引 言
水分和氮对作物生长发育具有一定的影响,适宜的水氮含量可以有效改善作物生长,起到提高作物品质的作用[1]。水氮胁迫会严重影响大豆体内营养物质(蛋白质与氨基酸等)的含量,因此,实现大豆水氮胁迫的早期检测,是保证大豆品质与产量的关键[2]。随着高光谱技术的发展,有学者使用高光谱数据研究胁迫作用,Salah[3]等用光谱指数研究水分胁迫下玉米的水分状况,发现指数模型(R970-R900)/(R970+R900)能预测玉米水分含量。高光谱技术以其快速、实时、无损等优点广泛应用于农业领域作物指标的监测,但是关于利用高光谱技术监测和评价不同水氮含量对大豆叶片光谱植被指数和作物参数的影响研究仍鲜有报道[4-5]。
通过分析水氮胁迫下大豆高光谱、光谱植被指数、叶绿素含量和净光合速率(下文中称上述指标为农学参数)的变化特征,明确大豆农学参数对水氮胁迫的响应规律,并提取敏感波段,建立大豆单叶叶绿素含量和净光合速率的反演模型,旨在为大田环境及大面积种植时精确管控水氮含量提供参考,同时为生产上利用光谱数据进行大范围、无破坏和快速监测大豆长势提供技术依据。
1 实验部分
1.1 材料及设计
供试品种为虎山60,采用盆栽实验,于2018年6月16日播种,每盆播种1粒种子。实验于吉林大学日光温室内进行,所有植株进行一致管理,于2018年7月23日—8月23日(开花结荚期)进行水氮胁迫实验。氮素使用含氮量为20%的尿素,水分和氮素水平如表1(a)和表1(b)所示,其中表1(a)中数值以最大田间持水量为基准,表1(b)中数值为氮素施用量。本实验采用随机区组设计,即W1N0,WIN1,W1N2,W1N3,WN4,W2N0,W2N1,W2N2,W2N3,W2N4,W3N0,W3N1,W3N2,W3N3,W3N4,W4N0,W4N1,W4N2,W4N3,W4N4,共20种处理,3次重复,共60个样本。借鉴文献[6]中采用的方法,通过称量土壤和盆栽的总重量来控制土壤胁迫的水分含量[6]。

表1(a) 4种水分水平表Table 1(a) Table of 4 moisture levels
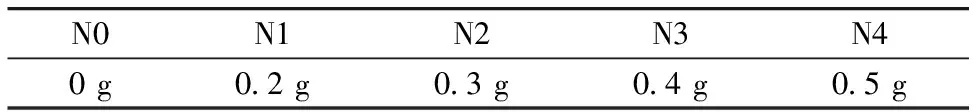
表1(b) 5种氮素水平表Table 1(b) Table of 5 nitrogen levels
1.2 对照组的确定
于2018年5月15日—7月18日进行大豆水氮胁迫的预实验,预实验的地点、环境和水氮水平与上述实验设计相同。通过预实验测得W3N3处理水平下的大豆结籽量最多,因此本实验的对照组水氮处理水平设为W3N3,称为未受胁迫处理,其他所有处理水平称为受胁迫处理。在表1(a)中,按W4,W2,W1的顺序称为水分胁迫程度的增加,在表1(b)中,按N4,N2,N1和N0的顺序称为氮素胁迫程度的增加。
1.3 数据采集及处理
于2018年8月20日—27日选择天色明朗时进行数据采集,采集时间为9:00—14:00,采集大豆功能叶片相同叶位的高光谱、叶绿素含量和净光合速率3种数据。高光谱采用Analytical Spectral Devices分析光谱仪器公司产HH 2地物光谱仪测定,测量范围325~1 075 nm,采样间隔1.4 nm,分辨率3 nm@700 nm,每片叶获取10条数据。叶绿素含量采用日本产SPAD-502测定,每片叶获取3条数据。净光合速率采用美国产LI-6400型光合作用仪测定,每片叶获取3条数据。以上3种数据均取其平均值。利用ViewSpec Pro,Spss 24.0和Origin 19.0软件进行数据处理与分析。
2 结果与分析
2.1 不同水氮胁迫下大豆高光谱差异分析
植物叶片的高光谱特征与其内部细微的结构特征有关,受到胁迫后其生理信息的微弱变化可反映在高光谱图像上[7]。如图1所示,受胁迫与未受胁迫大豆植株表现出不同的光谱特征,但光谱曲线总体变化趋势一致,在可见光绿光区(520~600 nm)的550 nm处形成一个反射峰即“绿峰”,原因是此波段范围内的植物光合效应较低,吸收的光较少,反射率较高。在可见光红光区(630~690 nm)的680 nm处形成一个反射谷即“红谷”,原因是此波段为植物具有最强叶绿素吸收和光合活性的光谱带,对光的吸收较多,反射率较低。在近红外光区(700~900 nm),由于植物叶肉细胞的反射作用,高光谱曲线快速升高,在760 nm处曲线基本升高至最高点,形成一个反射平台。
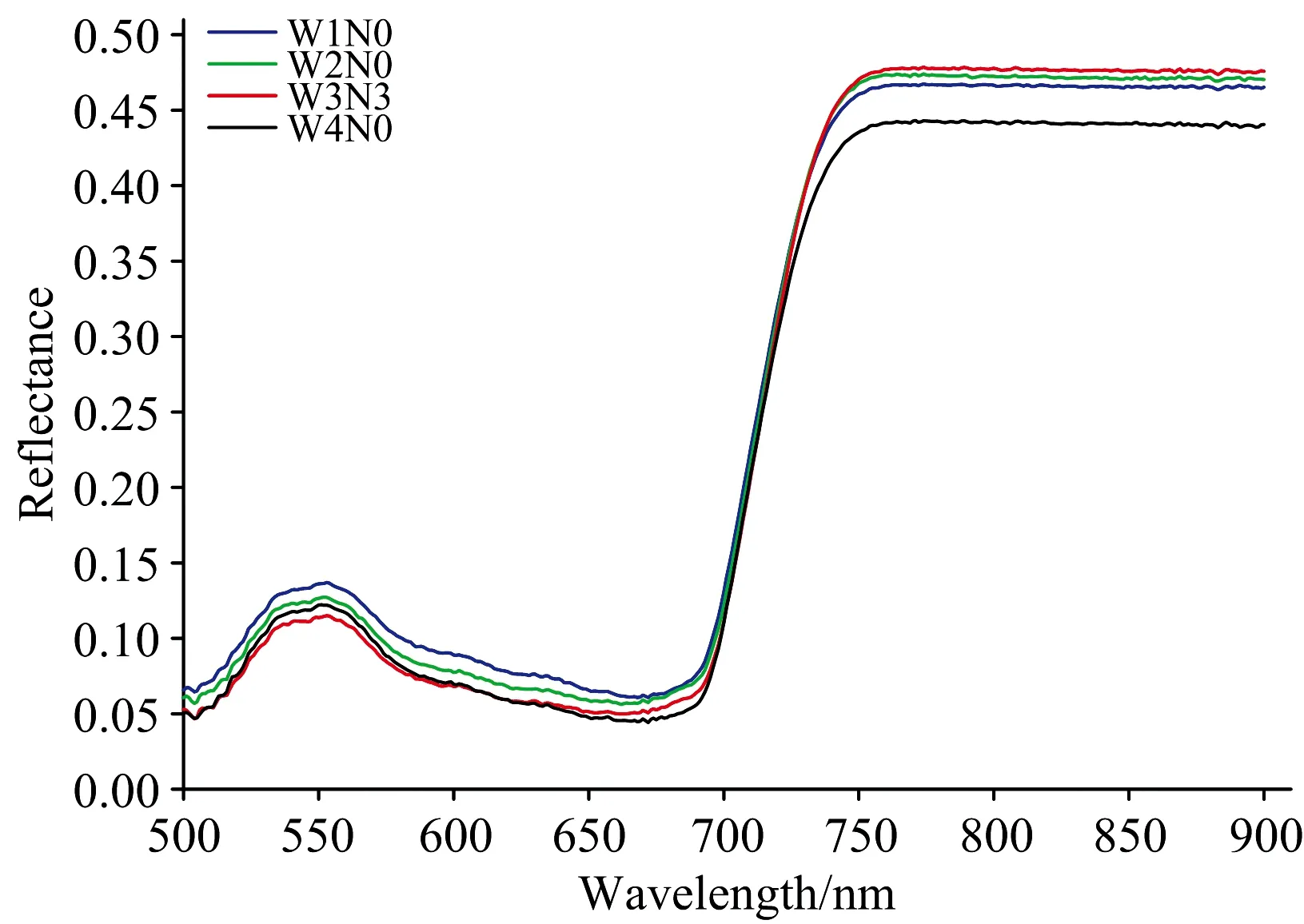
图1 大豆未受胁迫(W3N3)和受胁迫(W1N0,W2N0,W4N0)下的光谱特征
Fig.1 Spectral characteristics of unstressed (W3N3) and stressed (W1N0, W2N0, W4N0) soybeans
大豆在不同的水分和氮素水平下表现出不同的光谱反射率特征,在W3N3(未受胁迫)时,500~700 nm波段的反射率值低于受胁迫处理,760~900 nm波段的反射率值高于受胁迫处理。原因为大豆在500~700 nm波段的反射率主要受叶绿素含量的影响,而水氮胁迫会加速大豆体内已形成叶绿素的分解,使其含量降低,因此W3N3水平大豆的叶绿素含量高,对光的吸收多从而反射率低,760~900 nm波段植株的反射率主要受大豆内部构造的控制,水氮胁迫使会大豆内部结构发生一定程度的损伤,导致对光的吸收减少从而反射率高。
同一水分水平下的不同氮素水平的光谱特征各不相同,如图2(a),(b),(c)和(d)所示,N3水平(未受胁迫)的大豆光谱反射率在500~700 nm波段最低,760~900 nm波段最高,且随着氮素胁迫程度的增加(N4,N2,N1,N0),500~700 nm波段的反射率值逐渐增大。出现这种现象是因为在氮素胁迫下,大豆叶片的叶绿素合成受到抑制,对绿光的吸收减弱,大豆的光合作用受到抑制,对光的吸收减弱,反射率增加,胁迫程度越大,反射率越高。
2.2 敏感光谱植被指数的选取
光谱植被指数是几个波段间的不同光谱数据形式的组合运算,以增强植被的某一特性,可通过其值进行不同胁迫类型的检测[8]。对于复杂的光谱数据,为了能最大程度地反映植被的生理信息及生长状态,在处理光谱数据时,常用植被指数来反映所研究内容的特征[9]。
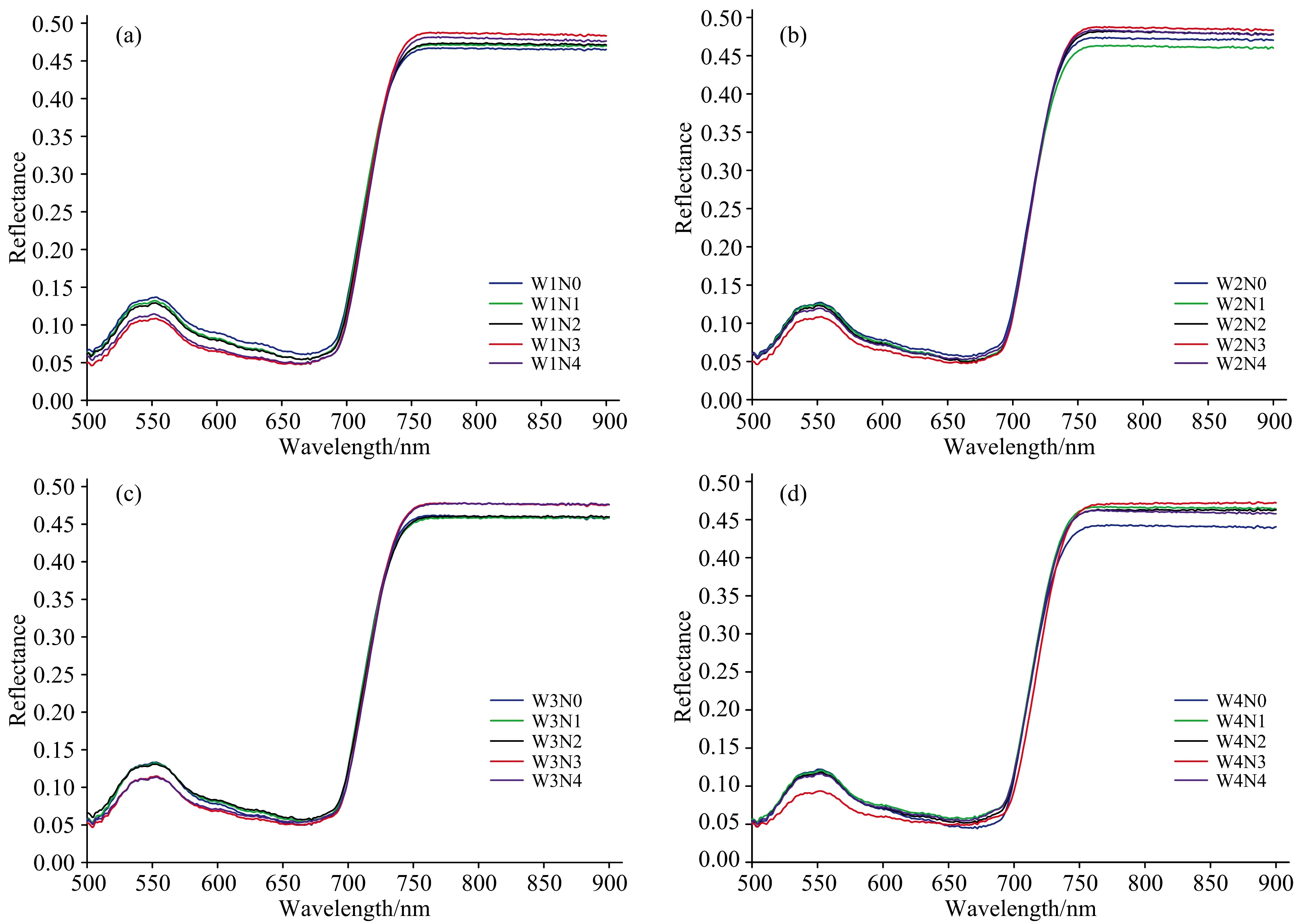
图2 不同水分和氮素胁迫下大豆叶片高光谱特征(a): W1与5种氮素水平交互作用; (b): W2与5种氮素水平交互作用;(c): W3与5种氮素水平交互作用; (d): W4与5种氮素水平交互作用Fig.2 Hyperspectral characteristics of soybean leaves under different water and nitrogen stresses(a): W1 combined with five nitrogen levels; (b) W2 combined with five nitrogen levels;(c): W3 combined with five nitrogen levels; (d): W4 combined with five nitrogen levels
相关分析法通常可以清楚地描述光谱植被指数与作物参数之间的关系[10]。采用相关分析法确定敏感的植被指数,以指示大豆农学参数的变化。15个光谱植被指数,标记为SI1—SI15如表2所示,包括光谱反射率值和一阶微分值,其中R,D分别代表反射率、一阶导数,其下标数字为对应数字的波长。

表2 光谱植被指数公式及参考文献Table 2 Spectral vegetation index formula and references
将15个光谱植被指数分别与叶绿素含量、净光合速率进行相关性分析,得到相关系数如图3所示,可见SI1,SI4,SI13,SI14和SI15与叶绿素含量和净光合速率的相关系数均较高,选取作为本工作所使用的植被指数。5个植被指数依次为NDVI,RVI,GNDVI,mNDVI705和LCI。
2.3 不同水氮胁迫处理对光谱植被指数的影响
为了更好地反应大豆高光谱对水氮胁迫的响应规律,进一步分析植被指数的变化情况,如表3所示,NDVI,RVI,GNDVI,mNDVI705和LCI具有相同的变化规律: 未受胁迫(W3N3)时具有较高的植被指数值。同一水分水平下,植被指数值N3>N4>N2>N1>N0,随着氮素胁迫程度的增加(N4,N2,N1,N0)呈现逐渐降低的趋势; 同一氮素水平下,植被指数值W3>W4>W2>W1,随着水分胁迫程度的增加(W4,W2,W1)也呈现逐渐降低的趋势,水分和氮素胁迫程度最大时植被指数值最低,表明可通过植被指数进行大豆胁迫及胁迫程度的识别。
很明显,受胁迫大豆叶片的植被指数值低于正常生长大豆,探究其原因,由前文所述可知受胁迫的大豆叶片在500~700 nm波段的反射率高于未受胁迫大豆,而760~900 nm波段的反射率低于未受胁迫大豆,由表3可知植被指数值是这两个波段反射率值进行不同运算后的比值,所以其植被指数值的变化规律如表3所示。
2.4 大豆单叶叶绿素含量和净光合速率反演模型的建立
由以上结果表明植被光谱特征与作物参数显著相关,因此,通过光谱建立大豆叶片叶绿素含量和净光合速率反演模型是可行的。将2种作物参数分别与对应的高光谱数据进行相关性分析如图4、图5所示,结果显示: 全波段中,相关系数绝对值大于0.443(p<0.05)的波长范围集中在520~622 nm波段(叶绿素含量)和485~664 nm波段(净光合速率),因此选取520~622和485~664 nm用于建立大豆叶片叶绿素含量和净光合速率反演模型所用波段。

图3 大豆叶片叶绿素含量值及净光合速率与植被指数相关系数
Fig.3 Correlation coefficient between chlorophyll content and net photosynthetic rate and vegetation index in soybean leaves
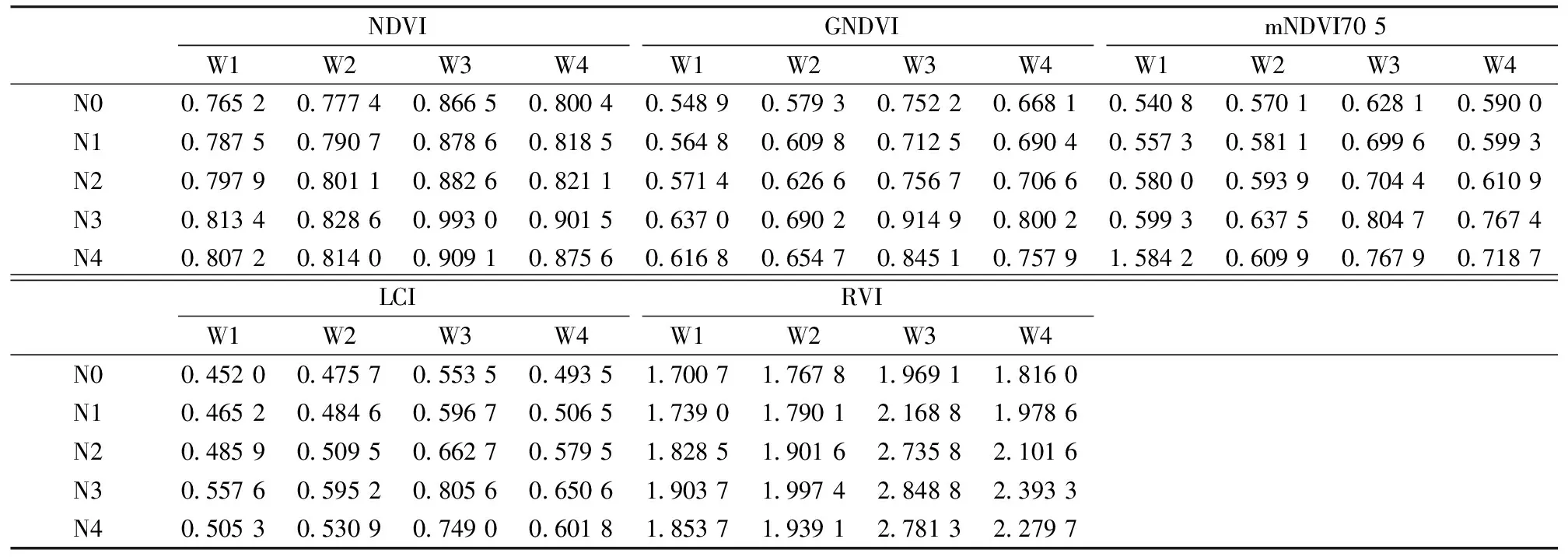
表3 不同水氮胁迫处理下大豆光谱植被指数值Table 3 Spectral vegetation index values of soybeans under different water and nitrogen stresses

图4 大豆单叶高光谱与叶绿素含量的相关性Fig.4 Correlation between hyperspectrum and chlorophyllcontent of soybean single leaf
用60个大豆叶片的高光谱数据建模,采用梯度法选取45个样本作为校正集,其余15个样本作为预测集。对比分析了不同的光谱预处理和建模方法的应用情况,选用的预处理方法有MSC,SNV,FD,SD和S-G。建模方法有PLS和PCR,用校正集和预测集的相关系数作为模型的评价指标。不同预处理和建模方法组合结果如表4所示,通过对比12种组合方法分析发现,采用MSC+FD+S-G+PLS组合的方法建立叶绿素含量反演模型的相关系数最高分别为0.960 6和0.972 0,采用SNV+SD+S-G+PLS组合的方法建立净光合速率反演模型的相关系数最高分别为0.992 7和0.970 8,因此确定这两种方法为最优建模方法。
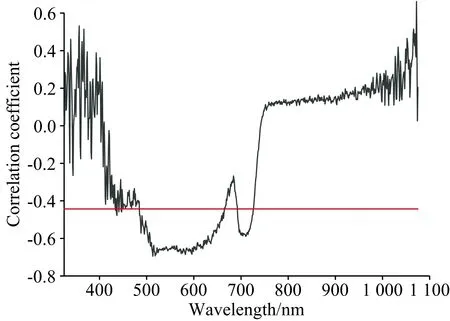
图5 大豆单叶高光谱与净光合速率的相关性Fig.5 Correlation between hyperspectrum and netphotosynthetic rate of soybean single leaf
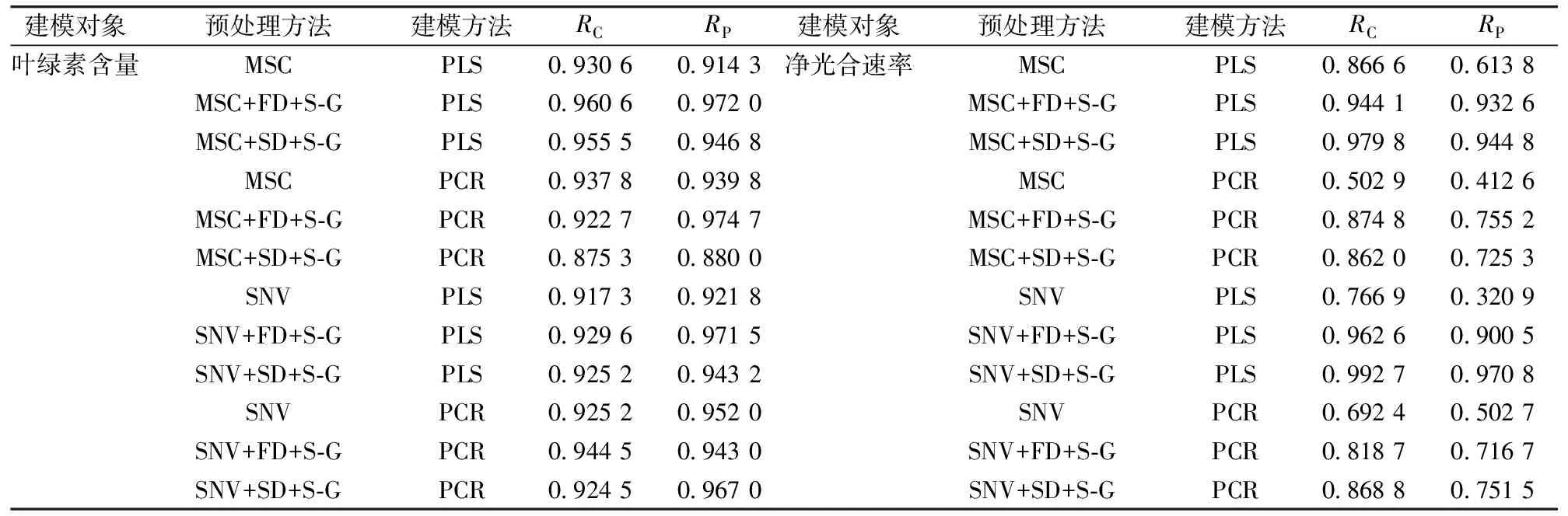
表4 不同预处理和建模方法组合结果Table 4 Combination results of different preprocessing and modeling methods
3 结 论
对不同水氮胁迫类型的大豆进行叶片高光谱、叶绿素含量和净光合速率测量,对光谱数据、植被指数及作物参数进行了相关分析,结果表明: (1)可通过大豆高光谱进行大豆水氮胁迫及胁迫程度的判断,具有500~700 nm波段最低反射率和760~900 nm波段最高反射率的光谱曲线代表未受胁迫大豆,在500~700 nm波段的反射率逐渐增加表示胁迫程度的增加; (2)也可通过植被指数进行大豆水氮胁迫及胁迫程度的判断,5种植被指数表现为一致的变化特征,植被指数的最大值代表未受胁迫大豆,其值逐渐降低表示胁迫程度的增加; (3)所建立的最优反演模型可对所有水氮处理的大豆进行叶片叶绿素含量和净光合速率的预测,可为大面积检测大豆受胁迫和未受胁迫下其内部生理信息提供技术支持,具有重要的指导和实践意义。
