青海地区胃腺癌患者TGFβI基因的甲基化状态※
2020-05-25王学红李春霞李苏华马雪芹绽永华杨生森李源化
赵 琳,王学红,安 琪,李春霞,王 昀,李苏华,马雪芹,郜 茜,绽永华,杨生森,李源化
(青海大学附属医院,青海 西宁 810001)
胃腺癌(Gastric adenocarcinoma)的发病机制尚不明确,目前认为是由遗传因素、生物因素和环境因素共同作用的结果。遗传学是肿瘤的研究基础,随着对肿瘤机制研究的不断深入,人们认识到肿瘤基因表达模式的改变不仅包含遗传学改变而且包含了更多的表观遗传学改变,表观遗传学改变在肿瘤的启动和进展中发挥着比遗传学更为重要的作用,因此表观遗传学的提出为肿瘤研究者带来了新的思路。表观遗传是没有DNA序列变化的可随细胞分裂而遗传的基因组修饰或基因表达调控,包括DNA甲基化、组蛋白修饰等,这种基因序列不变而基因表达改变的作用机制在多细胞生物的发育中至关重要[1],并能确保基因表达发生在正确的“时间”和“地点”[2]。DNA甲基化已经成为表观遗传学重要研究内容和国内外研究的热点。大量研究揭示了转化生长因子β诱导基因(transforming growth factorβ induced gene,TGFβⅠ)具有为抑癌因子或肿瘤启动因子的双重角色作用[3]。青海是我国胃癌高发区[4],其高发病率的确切机制尚不明确。本研究应用MethPrimer在线平台预测TGFβⅠ所富含CpG岛(共计15个CpG位点)的序列;利用亚硫酸氢盐测序(bisulfite sequencing PCR,BSP)法,对青海地区28例胃腺癌患者TGFβⅠ基因启动子区的甲基化状态进行检测,初步探讨TGFβⅠ基因甲基化与青海地区胃腺癌发生的相关程度。
1.对象及方法
1.1 一般资料
选择2019年3月至11月期间在青海大学附属医院住院经胃镜及病理首次确诊的28例胃腺癌病例为研究对象,收集患者的临床病理资料,在行胃镜检查时取胃腺癌组织、配对癌旁组织样本各28个;男性18例,女性10例。
1.2 纳入标准
①由胃镜确诊的胃癌患者;②在青海生活逾20年者;③未行放化疗;④未患有影响本研究结果的其他疾患;⑤所有研究对象均签署知情同意书,且通过青海大学附属医院伦理委员会批准(批准文号:XHK-2017-SKJT-001)。
1.3 研究步骤
①胃癌组织及癌旁组织DNA提取:按Ezup柱式组织基因组DNA抽屉试剂盒(B518251,上海生工)说明书步骤进行。②DNA亚硫酸氢钠修饰:将各标本的DNA(20μL)依照修饰试剂盒说明书进行。③引物设计、PCR扩增:应用MethPrimer在线平台预测TGFβⅠ基因(序列总长度:2040bp);CpG岛预测结果:共发现1个CpG岛(长度111bp),位于1875~1985 bp。其中包含有15个CpG位点。引物由上海生工生物公司设计,PCR扩增引物序列:上游引物TAAGGGTTGGGAAAATTGAGTA;下游引物CCCRAACCAAATTAAATAAACTAC。PCR反应条件:在95 ℃下预变性3~5 min;在94 ℃下变性30 sec;在55 ℃~60 ℃内退火25~30 sec;在72 ℃下延伸30~50 sec,将2~4环节做35个循环;在72 ℃下修复延伸5~8 min。④电泳检测条带:取PCR产物5 μL行1%琼脂糖凝胶电泳(150V,100mA,10~20min)观察。⑤连接反应体系组成:1 μL10Ligation Buffer,1 μL50%PEG,50 ng pUCmT Vector,0.2 pmolPCR Product,x μLH20,2.5 U T4 DNA Ligase,10 μL Final Volume〔按试剂盒说明书转化步骤制备感受态细胞(SK9307)〕。⑥ 蓝白斑筛选:将IPTG/X-gal平板上的白色菌落在含氨苄青霉素的液体培养基过夜(37℃)。最后采用3%糖凝胶电泳检测法,对目的片段TA克隆的菌落行PCR鉴定。⑦测序。
1.4 统计学方法
所有数据使用SPSS 19.0统计软件分析。两样本率的比较、分析采用χ2检验法或Fisher确切概率法,视P<0.05为有统计学意义。
2.结果
2.1 胃腺癌患者癌及癌旁组织中TGFβⅠ基因启动子区域甲基化状态
检测28例胃腺癌及其配对癌旁组织TGFβⅠ基因启动子区域的甲基化状态,总克隆8385个CpG位点(胃腺癌组织:4185;癌旁组织:4200),其中甲基化阳性克隆771个(胃腺癌组织:478个;癌旁组织293个)。癌组织中平均甲基化率为11.42%;配对癌旁组织中平均甲基化率为6.98%,差异具有统计学意义(P<0.001)(表1)。
2.2 TGFβⅠ基因启动子区域甲基化与临床病理特征的关系
整理28例胃腺癌患者的临床病理特征资料,进一步分析癌组织中TGFβⅠ基因启动子甲基化结果与临床病理特征之间的关系。胃腺癌患者癌组织中的TGFβⅠ基因启动子甲基化率在不同性别、年龄、肿瘤分化程度、浸润深度、TNM分期患者间未发现统计学差异(P>0.05)(表2)。

表1 胃腺癌患者癌及癌旁组织中的TGFβⅠ甲基化率
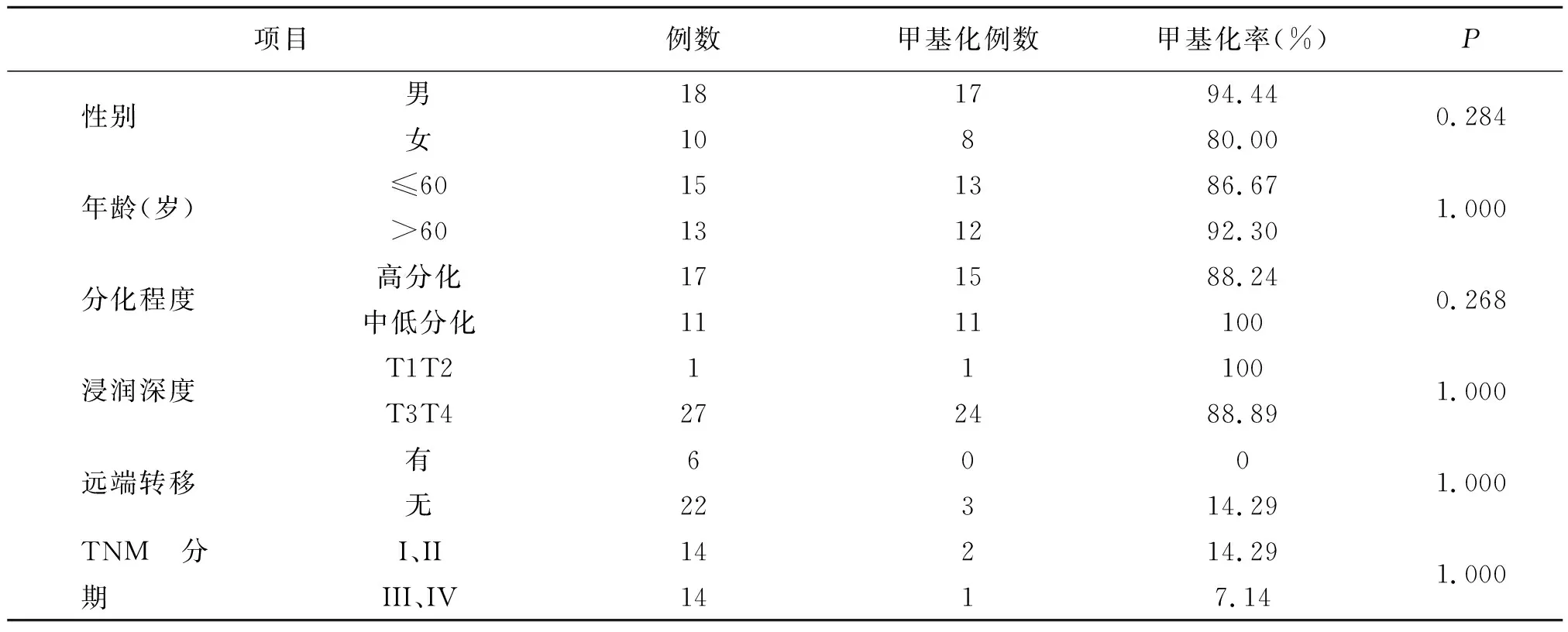
表2 胃腺癌组织TGFβⅠ甲基化状态与临床病理特征的关系
3.讨论
Feinberg和Vogelstein发现[5],在肿瘤中同时存在两个互相矛盾的表观遗传现象,即全基因组低甲基化和局部高甲基化。有研究认为[6][7],全基因组的低甲基化可以导致ras、c-myc等原癌基因激活,而DNA启动子区CpG的高甲基化可以导致p16、APC等抑癌基因失活,两者协同作用可致肿瘤发生。TGFβⅠ基因最早是从由TGF-β1刺激的A549肺腺癌细胞中克隆得到的基因,TGFβⅠ基因存在广泛,它可由多种类型的细胞产生,在人膀胱平滑肌和成纤维细胞中表达[8],也可以在肾近端小管细胞中表达[9]。作为细胞外基质分子之一,最先被关注的是其调节细胞黏附功能和迁移功能。随着研究的深入,发现TGFβⅠ基因在多种肿瘤中均有表达,但有关其作用的报道不一致。有研究认为[10],在肾癌、胰腺癌及结肠癌中TGFβⅠ基因呈现高表达,并可诱导、增强肿瘤发生侵袭转移的能力;与其相反的是[11][12],在肺癌、乳腺癌细胞中,TGFβⅠ表达水平明显下降或表达缺失。DNA甲基化,作为最热门的表观遗传学修饰方式之一,它在细胞生物学中有着十分重要的作用。DNA甲基化是在DNA甲基转移酶(DNMTs)的作用下,于胞嘧啶碱(5-甲基胞嘧啶)的碳-5位置加入一个甲基[13]。研究证明基因的表达结果会因为DNA甲基化而导致基因沉默致使该基因的表达降低,抑或是DNA甲基化反而导致基因过度表达[3],而这些过度表达的癌基因可促进肿瘤的发生[14]。因此,频繁、连锁性的DNA高甲基化和DNA低甲基化与肿瘤的产生和肿瘤的进一步发展可能有着密不可分的关系。
Han[15]等在对胃癌、肝癌等消化系统肿瘤的研究中用ELISA法测定胃癌患者血清TGFβⅠ水平,得到了患者血清TGFβⅠ水平明显升高的结论,考虑异常过量表达的TGFβⅠ基因可能来源于肿瘤本身,且TGFβⅠ基因过表达导致自发性肿瘤发生率增加,提示在胃癌中TGFβⅠ基因可能扮演的是“癌基因”角色。同时KiichiSugimoto[16]等收集了原发性胃癌(primarygastriccancers,PGC)及残胃癌(remnantgastriccancers,RGC)的病例样本,对全基因组DNA启动子进行甲基化分析证实了在基因普遍高甲基化组中PGC的贡献显著,表明PGC的启动子甲基化状态高于RGC(P=0.004),这也进一步阐明了PGC与甲基化的关系。我们的研究应用BSP法,检测28例胃腺癌患者癌组织及其配对癌旁组织中TGFβⅠ基因启动子区域的甲基化状态,并与相关临床病理资料进行相关性分析。本研究结果显示,胃腺癌患者癌组织中TGFβⅠ基因启动子甲基化程度明显高于癌旁组织(P<0.001)。因此我们的研究也得出了与Kiichi Sugimoto一致的研究结果,提示TGFβⅠ基因在胃癌中可能作为“癌基因”存在,高甲基化会上调其表达,从而参与胃癌的发生。Shah[10]、YangkiSeok[11]等的研究结果认为DNA高甲基化与肿瘤的淋巴转移、局部侵袭呈正相关;但我们的研究发现,胃腺癌患者癌组织中TGFβⅠ基因启动子甲基化率在不同性别、年龄、肿瘤分化程度、浸润深度、TNM分期患者间不存在统计学差异(P>0.05)。本研究样本数有限,需进一步行大样本研究。
TGFβⅠ基因在胃腺癌中可能为癌基因,其启动子区高甲基化状态可能与青海胃癌高发相关。
