组蛋白H3Ser10磷酸化对猪卵母细胞减数分裂的影响
2020-05-23田明明孙大康李清春王雁林孙洪亮
田明明,孙大康,孟 玮,王 楠,倪 娜,李清春,王雁林,孙洪亮
0 引 言
表观遗传修饰是当今生命科学领域中的研究热点,在没有基因序列改变的情况下,基因功能可逆及可遗传改变。其中,组蛋白修饰包括甲基化、乙酰化、磷酸化、泛素化及糖基化等,组蛋白修饰与许多基本的生物学功能密切相关,如细胞周期调控,DNA复制和修复,转录活性和染色体形态及功能的稳定性等[1-4]。其中,组蛋白磷酸化是对组蛋白氨基酸残基特殊位点的磷酸化修饰。组蛋白H3磷酸化可调控减数分裂过程,参与染色体的凝聚和分离过程进而影响纺锤体和微管装配[5]。关于组蛋白磷酸化修饰在卵母细胞成熟进程中的研究文献偏少,且部分研究结果间存在差异,Wang等[6]研究发现,小鼠卵母细胞在GV时期的组蛋白H3S10磷酸化修饰程度偏高;而Swain等[7]发现小鼠GV期卵母细胞未观察到H3S10磷酸化修饰;以上研究得出不同的结论可能与所用小鼠品系及不同抗体有关;在兔GV期的卵母细胞中研究发现组蛋白H3S10未发生磷酸化[8]。总之,哺乳动物卵母细胞成熟进程中组蛋白磷酸化修饰在减数分裂过程中的作用机制仍需进一步探讨。
组蛋白H3磷酸化修饰主要与Aurora激酶家族有关[9],研究发现Aurora激酶抑制剂ZM447439处理小鼠卵母细胞后,引起染色体及纺锤体发生异常[10],表明Aurora激酶调节卵母细胞组蛋白H3的磷酸化修饰,参与减数分裂发生过程。而Shuda等[11]研究表明过表达Aurora B可恢复ZM447439处理导致的染色体异常,这也表明Aurora B激酶负责卵母细胞染色体的调控。因此,卵母细胞的组蛋白磷酸化修饰可能由Aurora激酶介导调控,但具体以何种方式调控影响后续减数分裂过程需待进一步研究。
本试验以猪卵母细胞为研究对象,研究Aurora激酶抑制剂ZM447439对卵母细胞成熟、组蛋白H3Ser10磷酸化及Aurora B激酶变化的影响,进而探讨组蛋白磷酸修饰在卵母细胞成熟过程中的作用机制提供一定的理论依据。
1 材料与方法
1.1 主要材料 成熟液中除TCM-199购自Gibco公司外,除特殊说明外,实验所用试剂均购买于Sigma公司。ZM447439(Tocris Bioscience): 需溶于二甲基亚砜(DMSO),配制成3种不同浓度工作液(5、10 和30 μmol/L)。猪卵母细胞成熟液:TCM-199+10%猪卵泡液+10 IU/mL eCG+10 IU/mLhCG;抗体:一抗为小鼠单克隆抗H3Ser10抗体(1∶200,Abcom);二抗为FITC标记山羊抗小鼠IgG抗体(1∶200,Cell Signal)。
1.2 方法
1.2.1 猪卵母细胞获取和成熟 将从农贸市场收集运回实验室的卵巢冲洗消毒, 10 mL注射器抽取卵巢表面不同直径的卵泡,将卵泡液移入试管中置于39 ℃恒温箱放置15 min中,弃上清,在体视显微镜下选取颗粒细胞松散,胞质均匀的卵丘卵母细胞复合体(COCs),于洗卵液清晰去除组织块,移入成熟液中再38.5 ℃,5%CO2培养箱中培养22 h后,换成不含激素的成熟液再次培养20 h。体外成熟42 h后将COCs转移至1%透明质酸酶的洗卵液中孵育10 min,用100 μL移液枪反复吹打COCs,挑取卵母细胞做后续实验备用。
1.2.2 卵母细胞处理 将COCs分为4个组,一组正常培养作为对照组,另外3组分别添加5、10、30 μmol/L ZM447439的成熟液中,体外培养27 h,分别为5、10、30 μmol/L ZM447439处理组。收集猪卵母细胞进行后续组蛋白H3Ser10磷酸化修饰相关实验。
1.2.3 免疫组化分析 收集不同时期的卵母细胞,用T-BSA-PBS洗液(阻断液)清洗去除培养液中的血清等成分,移于含4%多聚甲醛的PBS中固定30 min。移入阻断液中静置5 min清洗3次。卵母细胞移入1%TritonX-100中透化处理10 min,移入阻断液中放置5 min重复2次。卵母细胞移入1%BSA中孵育1 h,目的是封闭非特异性位点。阻断液静置5 min清洗3次,将卵母细胞移入1%BSA稀释的小鼠单克隆抗H3Ser10抗体,于4 ℃冰箱中孵育过夜。第2天将胚胎置于培养箱中孵育20 min,随后移入阻断液中静置5 min清洗3次,将细胞取出并置于二抗FFITC标记山羊抗小鼠IgG抗体中,室温避光孵育1.5 h。移入阻断液中静置5 min清洗3次。10 mg/mL PI避光染色5 min。移入阻断液中静置5 min清洗3次,最后用凡士林封固。通过激光共聚焦显微镜(Leica TCS SP5)观察卵母细胞染色情况,并计算荧光强度。
1.2.4 实时荧光定量PCR 使用10 μL/管微量细胞裂解液(Cells-to-cDNATMII Kit,Ambion, UK),每管放入20个卵母细胞,每组试验重复3次。将含有卵母细胞的裂解液放入PCR仪中,75℃反应15 min,灭活RNase。加入DNase I和 10×Buffer,37 ℃反应 40 min,再加入random primer,EDTA和dNTP, 65 ℃水浴10 min,以中止反应。最后根据说明书加入Reverse transcriptase SSⅡRT,5×Buffer、DTT和RNase Inhibitor, 25 ℃中反应10 min,42 ℃反应90 min,95 ℃反应10 min,4 ℃停止。反转完成后将cDNA用ddH2O稀释成20 μL体积备用。实时荧光定量PCR的反应体系为20 μL:RT-PCR产物1 μL,2×FastStart Universal SYBR Green Master(ROX) 10 μL,Primer F/R(10 μmol/L)0.6 μL,Rnase Free water 8.4 μL。反应条件:95 ℃变性10 min;95 ℃ 15 s,60 ℃ 1 min,40个循环,每个样品至少重复3次。18 s(上游:5'-GATGGGCGGCGGAAAATTG-3',下游:5' -TCCTCAACACCACATGAGCA-3')作内参,采用2-△△Ct公式计算目的基因Aurora B(上游:5'- CCAAACATCTTGCGTCTCTA -3',下游:5'- TGGCAGTATATCAGAGCGTC -3')的表达量。
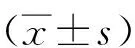
2 结 果
2.1 猪卵母细胞成熟过程中组蛋白H3S10磷酸化表达情况 GV期猪卵母细胞H3S10磷酸化未表达,从GVBD期组蛋白H3S10磷酸化开始表达,至AI期,磷酸化水平呈升高趋势,在MI或AI期磷酸化修饰达到最高水平; 至MII期磷酸化水平逐渐降低。与 GVBD期组蛋白H3S10磷酸化水平比较,MI期和AI期明显升高(P<0.05),AI期较MII期明显升高(P<0.05)。MI期与AI期差异无统计学意义(P>0.05)。见图1、图2。
2.2 组蛋白H3S10磷酸化对猪卵母细胞核成熟的影响 与对照组相比, 10、30 μmol/L ZM447439处理组GVBD期卵母细胞比例增加(P<0.05),MI、AI期明显下降(P<0.05),5 μmol/L ZM447439处理组对卵母细胞体外成熟核进程影响差异无统计学意义(P>0.05)。这也表明随着ZM447439浓度升高将严重影响卵母细胞核进程,卵母细胞无法完成减数分裂。见表1。

绿色代表H3S10磷酸化,红色代表DNA
图 1 不同成熟时期猪卵母细胞组蛋白H3S10磷酸化表达( ×200)
Figure 1 Immunolocalization of phH3S10 at during porcine oocyte maturation( ×200)

与GVBD期比较,*P<0.05;与AI期比较,#P<0.05
图 2 猪卵母细胞体外成熟各时期组蛋白H3S10磷酸化水平
Figure 2 Relative intensity level of phH3S10 during porcine oocyte maturation
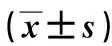
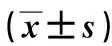
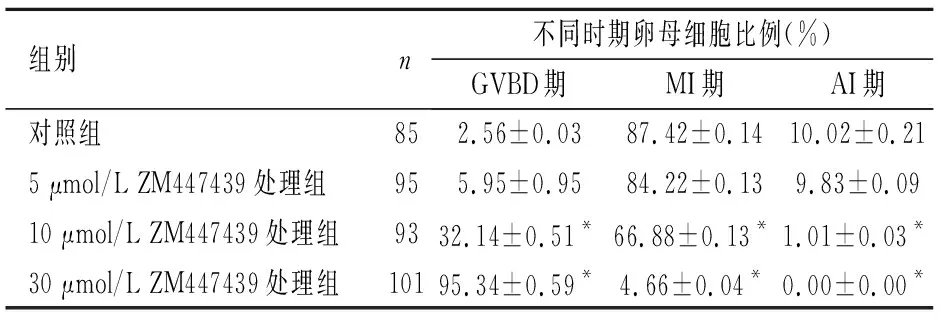
组别n不同时期卵母细胞比例(%)GVBD期MI期AI期对照组852.56±0.0387.42±0.1410.02±0.215 μmol/L ZM447439处理组955.95±0.9584.22±0.139.83±0.0910 μmol/L ZM447439处理组9332.14±0.51*66.88±0.13*1.01±0.03*30 μmol/L ZM447439处理组10195.34±0.59*4.66±0.04*0.00±0.00*
与对照组比较,*P<0.05
2.3 ZM447439对猪卵母细胞组蛋白H3S10磷酸化表达的影响 与对照组卵母细胞发生H3S10去磷酸化修饰比例(0)比较,5 μmol/L ZM447439处理组[(10.9±0.21)%]升高(P>0.05),10 μmol/L、30 μmol/L ZM447439处理组[(35.2±0.39)%、(95.4±0.65) %]明显升高(P<0.05)。以上结果表明,随ZM447439浓度逐渐增大,猪卵母细胞H3S10磷酸化表达水平逐渐降低,进一步发现卵母细胞中H3S10磷酸化消失的比例随之增加。 见图3。
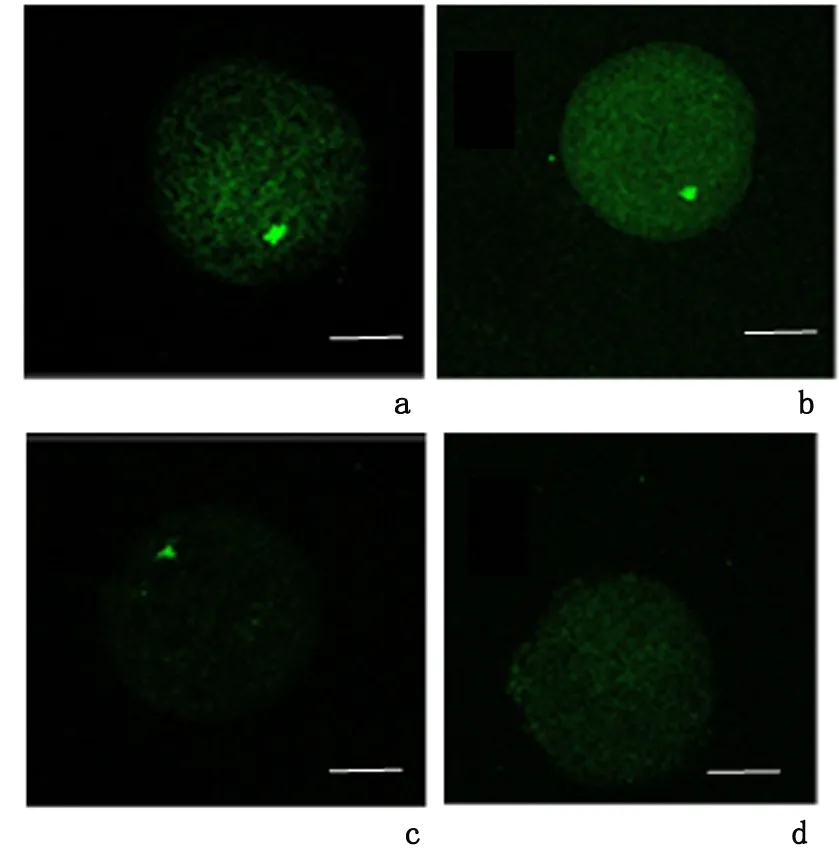
a:对照组; b-d:分别为5、10、30 μmol/L ZM447439处理组
图 3 ZM447439对猪卵母细胞H3S10磷酸化时空分布的影响( ×200)
Figure 3 Effects of ZM447439 on the distribution of H3S 10Ph at different stages of pig oocytes( ×200)
2.4 ZM447439对猪卵母细胞蛋白激酶Aurora B基因表达的影响 10、30 μmol/L ZM447439处理组AuroraB基因的相对表达量(0.65±0.10、0.53±0.09)较对照组(1.00±0.03)显著降低(P<0.05),而5 μmol/L ZM447439处理组(0.92±0.08)较对照组差异无统计学意义(P>0.05)。
3 讨 论
已有的研究发现从低等动物到高级的哺乳动物[13],组蛋白H3磷酸化修饰机制具有高度的保守性,其中,组蛋白H3第10个丝氨酸位点(S10)的磷酸化修饰可作为细胞分裂的一个标志。在卵母细胞减数分裂过程中,组蛋白磷酸化修饰随着染色质空间结构的变化也处于不断变化过程中[14]。有研究表明组蛋白H3S10磷酸化修饰与染色体的浓缩具有相关性[15]。而也有研究报道,Aurora B和组蛋白H3磷酸化不是卵母细胞减数分裂成熟过程中染色质凝聚必需的[5]。在哺乳动物卵母细胞减数分裂不同阶段,尤其是恢复后,组蛋白H3磷酸化的表达模式尚不清楚[16-17],而组蛋白H3磷酸化在猪卵母细胞减数分裂过程中的研究报道很少。
本试验从mRNA和蛋白层面,检测了组蛋白H3S10磷酸化在猪卵母细胞减数分裂各时期的动态分布情况。本研究发现组蛋白H3S10的磷酸化均开始于猪卵母细胞GVBD期,GV期均未检测到磷酸化信号,这与Bui等的报道一致[19],Wang等[16]研究发现小鼠卵母细胞GV期均发生磷酸化,这也表明在不同物种中卵母细胞的组蛋白H3S10磷酸化修饰模式各有差别,需更深入的研究与卵母细胞成熟相关性。本试验中发现猪卵母细胞从GVBD期组蛋白H3S10磷酸化开始表达,至AI期,磷酸化水平呈升高趋势,在MI或AI期磷酸化修饰达到最高水平;到MII期磷酸化水平逐渐降低。我们推测,随着减数分裂进程的发展,组蛋白磷酸化修饰的功能是通过影响转录因子与功能基因启动子的启动利于基因的调控,加速蛋白质合成,最终促进卵母细胞细胞质的成熟。与小鼠卵母细胞H3S10磷酸化模式有着不相同之处,Wang等[16]研究结果发现小鼠卵母细胞组蛋白H3S10磷酸化在GVBD发生,且MI期的高水平表达一直维持到MII期。对于上述结果我们推测可能与不同物种、品系及所用检测抗体相关。已有的研究结果表明小鼠和猪卵母细胞组蛋白H3S10在MI、AI和MII期均发生磷酸化[19],这进一步说明组蛋白H3S10磷酸化修饰存在于猪卵母细胞减数分裂过程中,并且对减数分裂发生具有重要调控作用。
哺乳动物卵母细胞中组蛋白的磷酸化状态可能是由功能相互拮抗的PP1/PP2A和Aurora激酶共同调控[20]。Aurora激酶分为三类:Aurora A,Aurora B和Aurora C。在卵母细胞成熟过程中,Aurora B激酶不仅参与组蛋白H3S10磷酸化的调控,而且调控染色体动态变化[21],且组蛋白H3S10磷酸化修饰随着染色体凝聚的变化而变化[9]。ZM447439是一种Aurora激酶抑制剂,具有有效抑制组蛋白H3S10的磷酸化的作用[22]。王慧利等[19]研究发现50μM ZM447439才能对小鼠卵母细胞组蛋白H3S10的磷酸化修饰起着显著地抑制作用。本研究发现随ZM447439浓度的提高,猪卵母细胞H3S10磷酸化水平及Aurora B激酶表达水平降低,该结果表明Aurora激酶抑制剂可调控猪卵母细胞H3S10磷酸化修饰及Aurora B激酶的功能。研究也发现低浓度ZM447439对卵母细胞核成熟进程影响不大,但是随着ZM447439浓度升高严重影响卵母细胞核成熟进程,影响到卵母细胞的成熟度,绝大多数卵母细胞阻滞在GVBD期,我们可以推测出ZM447439通过作用于Aurora B激酶及H3S10磷酸化修饰,导致卵母细胞减数分裂阻滞。
综上所述:本研究试验结果显示,组蛋白H3S10磷酸化及Aurora B激酶参与调控了卵母细胞减数分裂过程,这对研究人类辅助生殖领域中部分患者卵子不成熟提供一种思路,也为深入研究组蛋白磷酸化修饰在卵母细胞减数分裂过程调控的分子基础奠定了基础。
