miR-129-2靶向调节SOX4表达对子宫内膜癌细胞增殖和凋亡的影响
2020-05-23廖鸿力
廖鸿力,林 鹏,叶 琼
(1.温州市中心医院病理科,浙江 温州 325000;2.温州医科大学附属第一医院病理科,浙江 温州 325000)
子宫内膜癌为子宫内膜的一组上皮性恶性肿瘤,近年来发病率逐年升高,对女性的身心健康产生了严重影响[1]。已有研究指出无孕激素抵抗的雌激素长期刺激可诱发子宫内膜癌的发生,但临床中尚未明确其发病机制,也有研究表面子宫内膜癌是原癌基因激活、抑癌基因失活、细胞信号传导异常所致[2]。多数状态下,癌症是由异常全基因组的低甲基化和局部CpG岛高甲基化所致,几乎所有哺乳动物中的DNA甲基化均发生在CpG岛内,该区域的甲基化与基因的转录抑制相关。临床中抑制对某些抑癌基因和致癌基因的表达进行调控可影响细胞的增殖、迁移、侵袭和凋亡等。研究发现miRNA在多种肿瘤的发生和发展中均存在异常表达,miR-129-2低表达为常预示结肠癌患者的不良预后且在HER-2阳性的胃癌和乳腺癌患者体内miR-129表达也出现下调[3]。SOX4基因定位于人类染色体6p.23上,可编码一种分子量47kD含474个氨基酸的蛋白,位于N端的HMG结构域和C端的TAD结构域是SOX4发挥功能的主要区域。SOX基因的异常改变与多种肿瘤的发生和恶性生物学行为息息相关[4]。已有研究显示,在多种实体肿瘤中有SOX4基因的过量表达,并与患者的不良预后有关[5]。为探索子宫内膜癌的发生、发展和转移分子机制,确立防治靶点,寻求新的治疗策略,本研究以期通过实验探讨miR-129-2靶向调节SOX4表达对子宫内膜癌细胞增殖和凋亡的影响。
1资料与方法
1.1一般资料
子宫内膜癌细胞株Ishikawa由中科院上海细胞生物学研究所细胞库购入。购入60只雄性SPF级裸鼠,2月龄,体质量为18~22g,平均(20.02±1.28)g,由广西医科大学实验动物中心购入,合格证编号为:SYXK(桂)2019-1001,本研究遵循《实验动物保护条例》。
人体组织标本由本院病理实验室提供,来自本院近年接诊的妇女患者术前诊断和术中病理所采集样本,包括66例子宫内膜癌组织,42例正常子宫内膜组织。
1.2材料
TES裂解缓冲液:100mM NaCL,25mM EDTA(pH=8.0),10mM Tris-HCl(pH=8.0),1%SDS;RNaseA(10mg/mL)终浓度为0.05mg/mL;蛋白酶K(20mg/mL)终浓度为0.1mg/mL;氯仿;Tris-饱和酚;无水乙醇;乙酸钠溶液(3M,pH=5.0);1mM EDTA(pH=8.0);TE溶液:10mM Tris-HCl(pH=8.0)。
PCR 2x HotStar Taq MasterMix;限制性内切酶;琼脂糖;高保真性PCR扩增试剂盒;DNA marker;TAE电泳缓冲液:100mmol/L EDTA,2mol/L Tris碱,1mol/L冰乙酸;PCR产物纯化回收试剂盒。
DMEM低糖细胞培养基;LipofectamineTM2000转染试剂盒;质粒提取试剂盒;MTT;SOX4多克隆抗体;嘌呤霉素;链霉素和青霉素;载体miRNASelectTMpEGP-miR。
1.3细胞培养和转染
使用含10%胎牛血清、100μg/mL链霉素和100U/mL青霉素DMEM低糖细胞培养基于37℃、CO2体积分数为5%的培养箱内行常规培养,取对数生长期的Ishikawa细胞,以0.25%胰蛋白酶消化后支撑细胞悬液,接种在96孔培养板内,每组4个平行孔,每孔细胞密度为5 000个。在培养箱内过夜,若细胞融合度达到70%,按照LipofectamineTM2000说明书步骤进行转染。转染后6h更换含有血清的新鲜培养基,继续培养48h以便进行后续实验。同时设立空白对照组。
1.4 DNA提取
①取100mg液氮内冻存的组织,置于液氮研钵内,并装入2mL钢珠离心管内,震荡至粉末状;②加180μL ALT裂解缓冲液,20μL蛋白酶K溶液,混匀置于37℃水浴消化过夜;③依据试剂盒提取DNA,-20℃保存待测。
使用6cm培养基培养,回合率为90%时收取细胞沉淀,按照试剂盒抽提法提取细胞系基因组DNA。
1.5甲基化检测
①建立酶切反应预混合液;②混合液混合后取等量于200μL PCR反应管内建立酶切反应;③将反应管置于普通PCR反应仪内,37℃下4~6h,95℃下10min,处理后样本置于—20℃下保存待测;④在基因CpG岛区域内设计引物,所扩增DNA片段含有两个HhaI酶切位点,并确保酶切效率。
1.6 MTT检测
上述转染后的细胞在终止前4h每孔内加入5g/L MTT溶液20μL内,孵育4h后弃上清液,加150μL二甲基亚砜后振荡10min,结晶物完全溶解后,在荧光酶联分析仪上测光吸收值,使用490nm波长,重复三次。
1.7 Western Blot检测
收集细胞用蛋白裂解液,处理并取上清液,取各组蛋白30μL于8%SDS-PAGE电泳电转移至PVDF膜上,使用脱脂奶粉封闭1h,覆上1∶100的SOX4兔单抗过夜,使用TBST洗涤3次,10min/次。加入1∶200的辣根过氧化物酶标记的山羊抗兔二抗,37℃下孵育1h,洗膜后使用含有化学发光剂的水溶液激发荧光,暗室内压片,显影,定影,分析图像。
1.8建立裸鼠模型
将对数生长期的各组细胞经胰酶消化、离心、收集、计数,制备5×107个/mL细胞悬液注入裸鼠腋窝中部背侧皮下,腋下接种0.2mL/只,1周后出现肿瘤,每3d测量一次裸鼠的体重和瘤体大小,计算肿瘤体积。30d后处死裸鼠取瘤组织称重,计算抑瘤率。抑瘤率=(1-处理组平均瘤重/对照组平均瘤重)×100%。
1.9统计学方法
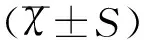
2结果
2.1 miR-129-2在子宫内膜细胞中的甲基化状态
Ishikawa细胞系中miR-129-2启动子区甲基化强度为74.47%。本研究中所选取的66例子宫内膜癌组织中38例存在miR-129-2启动子区高甲基化(占57.58%),且癌旁组织内无甲基化。Western Blot检测结果显示,空白对照组、阴性对照组、转染高表达组的子宫内膜癌Ishikawa细胞中SOX4蛋白表达量分别为0.43±0.01、0.34±0.03、0.10±0.04,高表达组的SOX4蛋白表达量显著低于阴性对照组和空白对照组(t值分别为2.436、3.786,均P<0.05),阴性对照组则显著低于空白对照组(t=2.897,P<0.05),各组SOX4蛋白表达见图1。
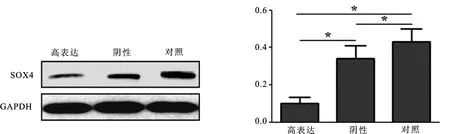
图1各组SOX4蛋白表达
Figure 1 SOX4 protein expression in each group
2.2 miR-129-2在子宫内膜癌及正常子宫内膜组织样本中的表达
将β-actin作为内参基因,将miR-129-2与各组的β-actin差值作为样本中目的基因的mRNA表达水平,比较66例子宫内膜癌组织和42例正常子宫内膜组织的miR-129-2表达,结果显示其在子宫内膜癌组织中的表达为0.001±0.001,显著低于正常子宫内膜组织的0.003±0.002(t=6.020,P=0.000)。
2.3各组Ishikawa细胞不同时间增殖活性比较
3组Ishikawa细胞培养24h、48h、72h、96h和120h细胞增殖能力比较均有显著性差异(均P<0.05),其中miR-129-2高表达组细胞增殖能力最低。进一步每两组之间比较显示miR-129-2高表达组在48h、72h、96h、120h时间点细胞增殖能力均显著低于阴性对照组和空白对照组(t值为2.356~10.987,均P<0.05),而阴性对照组和空白对照组比较差异均无统计学意义(t值为0.980~1.235,均P>0.05),见表1。
2.4 miR-129-2对裸鼠体质量及移植瘤重量的影响
3组裸鼠瘤体湿重、终体积、肿瘤相对体积比较均有显著性差异(均P<0.05),其中miR-129-2上述指标最低。进一步每两组之间比较显示miR-129-2高表达组瘤体湿重、终体积、肿瘤相对体积均显著低于阴性对照组和空白对照组(t值为3.124~19.446,均P<0.05),而阴性对照组和空白对照组比较差异均无统计学意义(t值为0.884~1.459,均P>0.05),见表2。
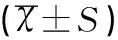
表1 各组Ishikawa细胞不同时间增殖活性比较
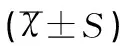
表2 miR-129-2对裸鼠体质量及移植瘤重的影响
2.5miR-129-2对子宫内膜癌的诊断价值分析
进一步探讨miR-129-2对子宫内膜癌预测诊断价值,以子宫内膜癌组织为阳性样本(n=66),以正常子宫内膜组织为阴性样本(n=42),建立ROC诊断分析模型。将miR-129-2的表达量分成7-10个组段。结果显示该指标对子宫内膜癌具有较高的诊断价值,ROC-AUC为0.768。理论阈值点为0.002,对应的敏感度和特异度分别为0.772、0.745,见图2。
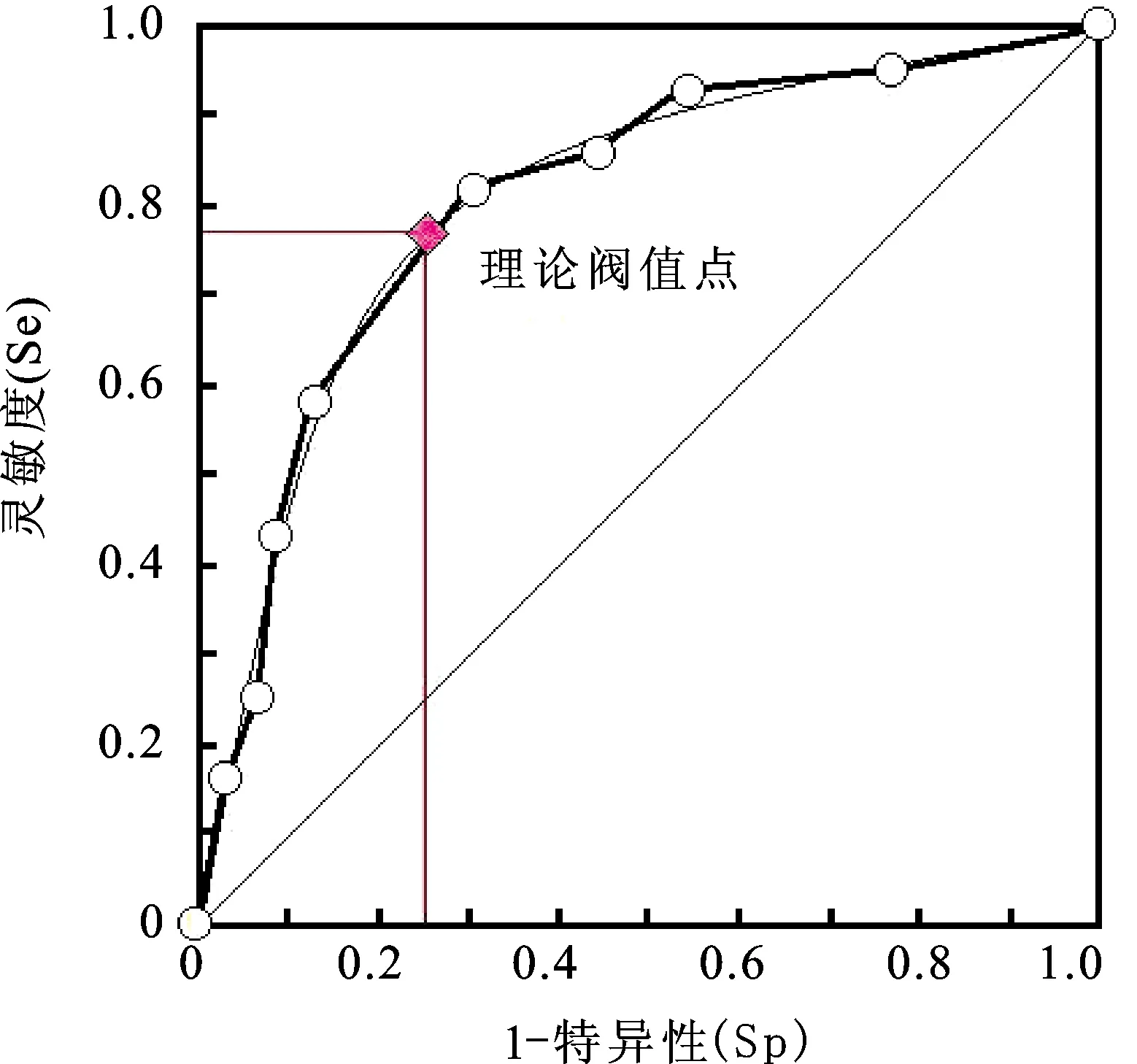
图2 miR-129-2对子宫内膜癌的诊断价值ROC曲线
3讨论
3.1 miR-129与子宫内膜癌的关系
近年来我国子宫内膜癌的发生率逐年增长,抑癌基因和癌基因异常变化均是促进肿瘤进展的重要机制之一[6]。子宫内膜癌的分期与临床治疗和预后均有密切相关性,中晚期或转移子宫内膜癌患者5年内生存率不足30%[7]。尽管临床中的经阴道超声检查、经腹超声检查、MRI、CT对子宫内膜癌具有较佳的诊断性和敏感性,但结构和形式的变化常滞于肿瘤功能障碍后。因此寻找与肿瘤生物学行为相近,且敏感性和特异性较高的分子标志物,是提高子宫内膜癌早期诊断和临床预后的重要途径[8]。
miR-129与肿瘤的发生、发展有密切相关性,可通过调控细胞增殖、侵袭、迁移、免疫系统和肿瘤耐药等途径参与肿瘤的发生与发展过程。有研究指出食管鳞状细胞癌中miR-129表达下调,可下调周期相关蛋白进而抑制癌细胞增殖、侵袭和迁移[9]。考虑SOX4基因主要在胚胎发育过程中表达于中枢神经系统、心脏和胸腺,可稳定干细胞,因此其突变、缺失、过量表达等均可能导致先天性疾病的发生,并与肿瘤的发生、发展密切相关。已有研究证实多种实体肿瘤中均存在SOX4基因过量表达,且常预示不良预后[10]。本研究由miR-129-2靶向调节SOX4表达入手进行研究,观察其对子宫内膜癌细胞增殖和凋亡的影响,以期能为后期临床诊断、治疗提供参考。
通过通量甲基化检测技术的不断发展,人们加深了对肿瘤发生前后各阶段整体基因组甲基化模式变化的认识。miR-129-2为miRNA家族之一,其异常表达与细胞周期的阻滞、侵袭、转移、凋亡和衰老相关。已有计算机预测miR-129-2的下游基因为SOX4,其为某种原癌基因,在Wnt通路中有重要作用[11]。不同类型的肿瘤组织中miR-129-2均呈现低表达,包括胃癌、结肠癌、食管鳞癌、膀胱癌等,但目前临床中尚未明确miR-129-2在子宫内膜癌中的作用机制[12]。本研究结果显示,Ishikawa细胞系中miR-129-2启动子区甲基化强度为74.47%。本研究中所选取的66例子宫内膜癌组织中38例存在miR-129-2启动子区高甲基化(占57.58%),且癌旁组织内无甲基化。高表达组的Ishikawa细胞中SOX4蛋白表达量显著低于阴性对照组和空白对照组(P<0.05),阴性对照组则显著低于空白对照组(P<0.05)。miR-129-2在子宫内膜癌组织中的表达显著低于正常子宫内膜组织(P=0.000)。
3.2miR-129在预测子宫内膜癌中的价值
鉴于DNA甲基化为潜在的可逆表现遗传变化,因此临床中可考虑给予患者脱甲基作用抑制剂进行抗癌治疗。目前已有研究指出SOX4基因在肝癌患者体内组织中过度表达,且与术后早期高危复发有密切相关性,但其表达水平与患者的年龄、性别、肿瘤直径、Edmonson分级、乙肝表面抗原等无关,其高表达可作为临床判断肝癌预后的指标之一[13]。Andersend等于2009年报道,SOX4高表达的结直肠癌肿瘤患者具有较高的复发率,总生存率较低。以上实验提示SOX4可作为癌基因参与肿瘤的侵袭、转移和复发。本研究中子宫内膜癌组织中miR-129-2的表达均低于癌旁组织,且miR-129-2能够降低子宫内膜癌Ishikawa细胞的增殖能力,并随着培养时间的延长抑制作用增强。β-actin与转录因子结合启动Wnt信号通路,miR-120-2高表达组大鼠体内SOX4的DNA结合部位与转录因子的DNA结合部位相似度较高,Wnt信号通路激活,进而抑制了子宫内膜癌细胞毒增殖能力[14]。沉默SOX4基因表达后可降低肿瘤细胞中核转录因子kB的表达,同时P53蛋白稳定性增强,凋亡抑制因子Survivin表达丢失,肿瘤凋亡增加。本研究中高表达miR-129-2组的裸鼠瘤体湿重、终体积和肿瘤相对体积均低于阴性对照组和空白对照组(P<0.05),提示miR-129-2可抑制子宫内膜的发生和发展。此外,本研究进一步分析的miR-129-2对子宫内膜癌的预测价值,结果显示其对子宫内膜癌具有较高的诊断价值,AUC为0.768,理论阈值点为0.002,对应的敏感度和特异度分别为0.772,0.745。
综上所述,miR-129-2在子宫内膜癌组织和细胞系内均存在明显甲基化,因基因启动子区miR-129-2在子宫内膜癌组织中表达降低,miR-129-2可抑制子宫内膜癌Ishikawa细胞的增殖,促进凋亡,其作用可能与靶向下调SOX4基因表达相关。
