一种改良的旱地土壤微生物DNA提取方法
2020-05-23侯海军秦红灵陈香碧陈春兰
胡 娴,彭 涛,王 逗,侯海军,秦红灵,陈香碧,陈春兰
(1.中国科学院 亚热带农业生态研究所,湖南 长沙 410000; 2.湖北工程学院 生命科学技术学院,湖北 孝感 432000; 3.甘肃农业大学 农学院,甘肃 兰州 730000)
土壤微生物是重要的生物类群,在物质循环和能量流动中起着重要的作用[1-2],与土壤肥力及土壤健康关系密切,也是反映生态环境健康的重要指标之一[3]。近年来,宏基因组学和分子生物学技术快速发展,如土壤微生物DNA/RNA的高通量测序、基因芯片技术等,可以直接在基因水平上研究土壤微生物的特性和功能,为探索土壤微生物群落功能开启了新途径[4],而从土壤环境中提取高质量的微生物DNA是关键步骤。探寻快速、简便、经济、高效的土壤微生物DNA提取方法是土壤微生物研究和利用的基础[5],已成为国内外研究者关注的热点。目前,关于土壤微生物DNA的提取方法较多[6-11]。ZHOU等[9]提出的土壤微生物DNA提取方法应用较广泛,但土壤样品及试剂用量较大,耗时较长,不利于大量样品的处理。陈春兰等[10]改进的SDS-GITC-PEG土壤微生物DNA提取方法在样品与试剂用量上取得一定优势,耗时也有一定缩短,试验操作更为简便。QIN等[11]对土壤微生物DNA提取方法进一步优化,将土壤样品用量减少到0.3 g,同时加入玻璃珠破碎使提取效率更高,此法对水稻土中微生物DNA的提取效果良好,但对旱地土壤DNA的提取效果很差(前期研究)。为此,本研究对QIN等[11]的方法(简称QIN法)进行了改良,旨在建立一种快速、简便、经济、高效并适用于旱地土壤微生物DNA的提取方法,为后续的微生物分子生态学研究奠定基础。
1 材料和方法
1.1 试验材料
1.1.1 土壤 供试稻田土为多年种植双季稻土壤,采自湖南省益阳市水稻丰产节水节肥试验田(29°08′N、112°27′E),土壤母质为湖积物,质地为粉(砂)壤土,其理化性质[12]:土壤pH值为6.16,铵态氮含量60.91 mg/kg,硝态氮含量3.38 mg/kg,可溶性有机碳含量417.74 mg/kg。旱地土来自湖南省桃源县宝洞峪试验站(111°26′E、28°55′N),母质为第四纪红壤,其土壤黏粒含量较高,结构差,持水性能差;土壤pH值为4.55、铵态氮含量65.30 mg/kg、硝态氮含量0.28 mg/kg、可溶性有机碳含量512.54 mg/kg、有机质含量13.81 g/kg、全氮含量0.84 g/kg、全磷含量0.38 g/kg、全钾含量12.33 g/kg、碱解氮含量77.81 mg/kg、速效磷含量6.05 mg/kg、速效钾含量103.40 mg/kg。
1.1.2 主要试剂 0.5 mm玻璃珠;十六烷基三甲基溴化铵(CTAB)提取液(5% CTAB、 0.7 mol/L氯化钠和0.12 mol/L磷酸钾缓冲液);20%十二烷基硫酸钠(SDS)溶液;酚-氯仿-异戊醇(25∶24∶1)混合液,pH值8.0;氯仿-异戊醇(24∶1)混合液;PEG 溶液(V50% PEG 6000∶V4 mol/L NaCl=3∶2);75%乙醇溶液;DNA Marker DL 2000;Fast DNA Spin Kit for Soil试剂盒(MP BIO)。
1.1.3 主要仪器 超净工作台、台式高速低温离心机(德国Eppendorf)、FastPrep-24快速核酸提取仪(MP BIO)、G:BOX F3凝胶成像系统、温度梯度变温PCR仪(德国Eppendorf)、NanoDrop One超微量分光光度计(Thermo Scientific)、 -80 ℃低温冰柜(美国REVCO)、水平琼脂糖电泳装置(美国BioRad)。
1.2 土壤微生物DNA的提取方法
1.2.1 QIN法 土壤微生物DNA的提取参照QIN等[11]的方法。
1.2.2 改良的QIN法 土壤微生物DNA的提取参照QIN法并进行改良。主要进行了2个步骤的修改:(1)称0.3 g干土加入300 μL无菌水,于-80 ℃过夜;(2)研究加入CTAB和SDS的最适配比,设置加入CTAB、SDS的总体积为500 μL。设2组不同梯度CTAB、SDS溶液的体积(μL)比,第一组(加玻璃珠):500∶0、400∶100、300∶200、200∶300、100∶400、0∶500;第二组(不加玻璃珠):125∶375、100∶400、75∶425、50∶450、25∶475、0∶500。具体步骤如下:
1)称0.3 g玻璃珠和0.3 g干土于1.5 mL EP管中,加入300 μL无菌水,于-80 ℃过夜。
2)加入100 μL CTAB、400 μL SDS、500 μL酚-氯仿-异戊醇溶液,混匀。
3)Fast-Prep-24快速核酸提取仪5.5 m/s裂解细胞30 s,4 ℃ 20 000×g离心10 min。
4)取出上清于另一新EP管中,加等体积氯仿-异戊醇溶液,混匀,4℃ 20 000×g离心5 min。
5)取出上清于另一新EP管中,加2倍体积PEG 溶液,混匀,室温放置1~2 h 或者 4 ℃过液。
6)4 ℃ 20 000×g离心10 min,弃上清,加200 μL预冷75%乙醇洗涤沉淀3次,离心1 min,弃上清,干燥20 min。
7)加30 μL无菌水溶解, -80 ℃保存,备用。
1.2.3 试剂盒法 采用MP BIO公司的土壤提取试剂盒FastDNA Spin Kit for Soil进行土壤微生物DNA提取,方法见使用说明书。
1.3 DNA含量和纯度检测
使用Thermo Scientific公司的NanoDrop One超微量分光光度计测定DNA的含量、A260/A280以及A260/A230。用1%琼脂糖凝胶对土壤微生物DNA质量进行电泳检测。
1.4 16S rDNA序列PCR扩增
以土壤DNA样品为模板,扩增16S rDNA序列以检测DNA质量是否满足PCR扩增要求。用16S rDNA的通用引物1369F、1492R进行扩增,引物序列分别为5′-CGGTGAATACGTTCYCGG-3′,5′-GGWTACCTTGTTACGACT-3′。PCR扩增体系为25 μL:引物各1 μL,Taq酶混合液12.5 μL,模板 (土壤DNA)1 μL,加ddH2O至总体积达到25 μL。PCR反应条件:95 ℃5 min;95 ℃ 45 s,50 ℃ 45 s,72 ℃ 1.5 min,共设35个循环;72 ℃ 10 min。采用琼脂糖凝胶电泳检测PCR产物。
2 结果与分析
2.1 QIN法提取稻田土和旱地土微生物DNA效果的比较
用QIN法提取稻田土和旱地土微生物DNA(表1、图1)发现,对稻田土微生物DNA的提取效果较好,但对旱地土微生物的DNA提取效果不佳,含量低,仅为1.11 μg/g,无法用琼脂糖凝胶电泳检测到。因此,此法适合于稻田土微生物DNA的提取,而不适用于旱地土微生物DNA的提取。

表1 QIN法提取稻田土和旱地土微生物DNA的含量和纯度Tab.1 Content and purity of microbial DNA extracted from paddy soil and dryland soil by the QIN’s method

M: DNA Marker DL 2000,下同;1—6:提取的土壤DNAM: DNA Marker DL 2000,the same below; 1—6:Microbial DNA extracted from soil图1 QIN法提取稻田土(A)和旱地土(B)微生物DNA的琼脂糖凝胶电泳结果Fig.1 Agarose gel electrophoresis detection of microbial DNA extracted from paddy soil (A) and dryland soil(B)
2.2 旱地土DNA提取方法的改良
2.2.1 CTAB/SDS体积比对DNA提取效果的影响 在QIN法基础上进行改良,对细胞裂解剂CTAB/SDS加入比例进行试验。由表2可知,在加入CTAB、SDS体积比为100∶400、0∶500时,得到的DNA含量分别为2.70、440.13 μg/g,但由图2可见,后者所提取的DNA已降解。通过对所提取DNA纯度进行检测发现,CTAB、SDS体积比为100∶400时,A260/280和A260/230均较高,说明该配比下所提取DNA纯度较高,蛋白质和腐植酸等杂质的污染较小。且通过凝胶电泳也能检测出完整DNA条带,其他体积配比均未见DNA条带(图2)。因此,在添加玻璃珠情况下,CTAB、SDS体积比为100∶400时,所提取旱地土微生物DNA浓度及纯度最好。
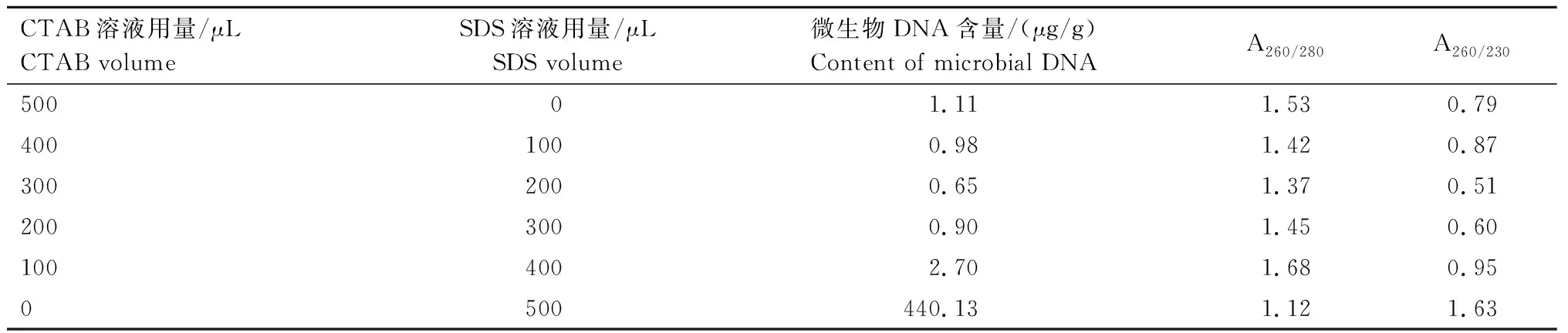
表2 不同CTAB/SDS配比提取旱地土微生物DNA的含量和纯度Tab.2 Content and purity of microbial DNA extracted from dryland soil with different ratios of CTAB to SDS
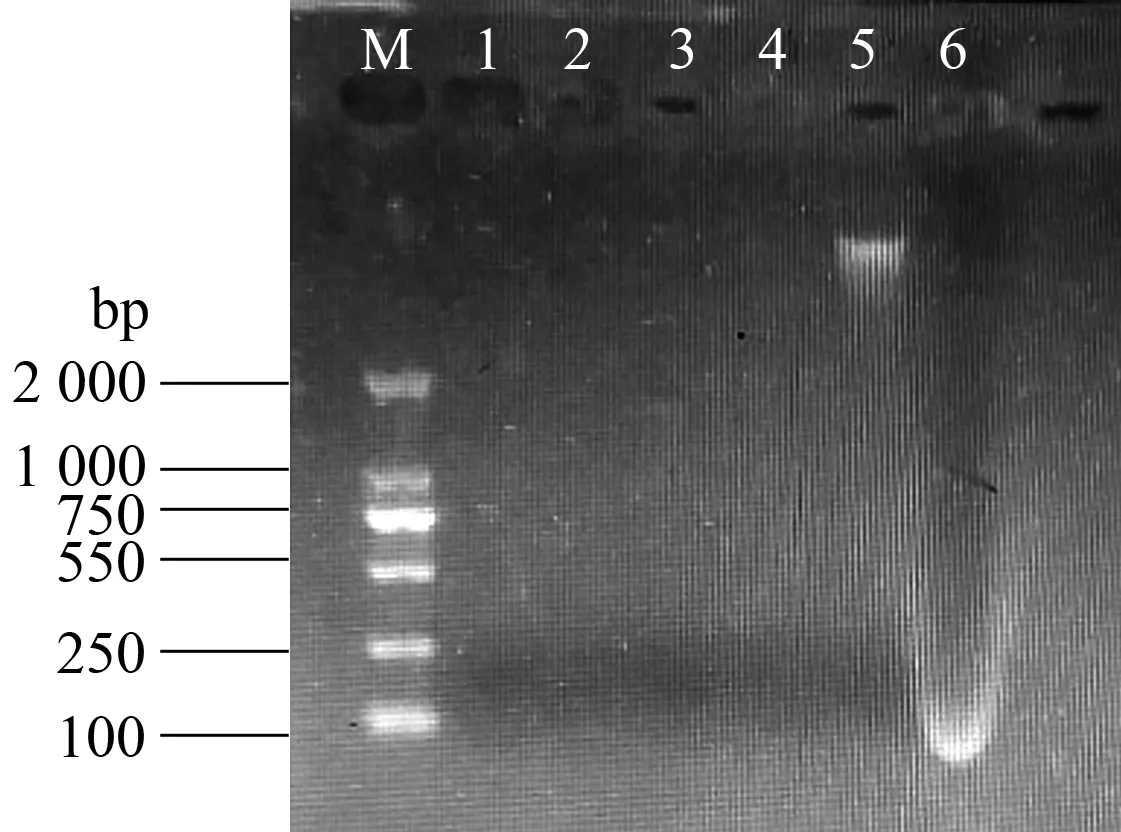
1: CTAB 500 μL,SDS 0 μL; 2: CTAB 400 μL,SDS 100 μL; 3: CTAB 300 μL,SDS 200 μL; 4: CTAB 200 μL,SDS 300 μL; 5: CTAB 100 μL,SDS 400 μL; 6: CTAB 0 μL,SDS 500 μL图2 不同CTAB/SDS配比提取旱地土微生物DNA的琼脂糖凝胶电泳检测结果Fig.2 Agarose gel electrophoresis detection of microbial DNA extracted from dryland soil with different ratios of CTAB to SDS
2.2.2 玻璃珠对DNA提取效果的影响 添加玻璃珠有助于微生物细胞的裂解,同时也可能促使DNA降解成小片段,或者提取效果不明显而增加步骤和成本,所以在调节CTAB/SDS配比基础上,对是否添加玻璃珠进行试验。从表3可以看出,不添加玻璃珠,CTAB/SDS的配比为100∶400时DNA浓度和质量较好,25∶475和0∶500时虽然DNA含量很高,但纯度不够,可能是蛋白质等杂质污染造成。通过凝胶电泳结果(图3)也发现,不添加玻璃珠,CTAB/SDS的配比为100∶400和75∶425时有条带,而前者的条带较亮,25∶475和0∶500 时的DNA已降解,说明不添加玻璃珠时,旱地土微生物DNA提取的CTAB/SDS最适配比为100∶400。通过表2(添加玻璃珠)和表3(不添加玻璃珠)可知,在CTAB/SDS最适配比下,添加玻璃珠对旱地土微生物DNA提取的含量及纯度均高于不添加玻璃珠。因此,在QIN法基础上确定改良法为:添加玻璃珠,CTAB/SDS的体积配比为100∶400。
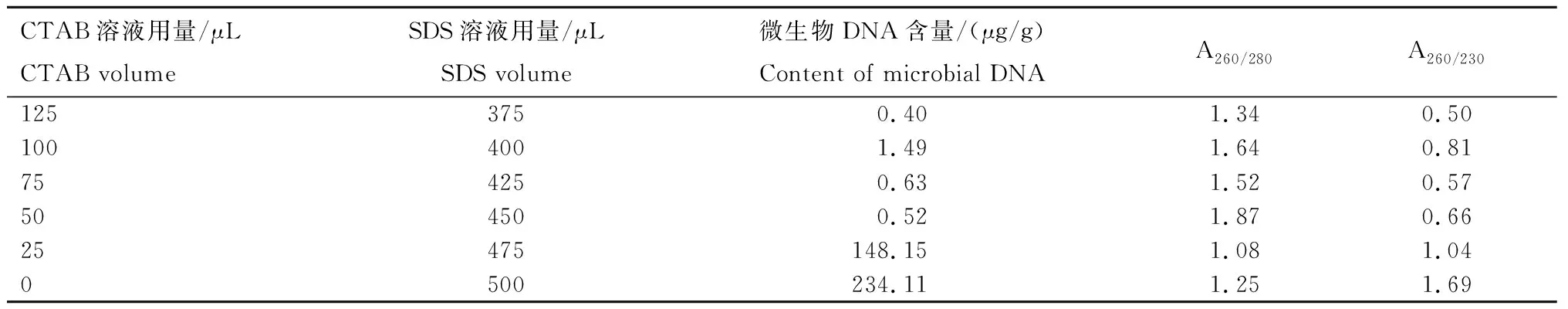
表3 不添加玻璃珠提取旱地土微生物DNA的含量和纯度Tab.3 Content and purity of microbial DNA extracted from dryland soil without glass beads
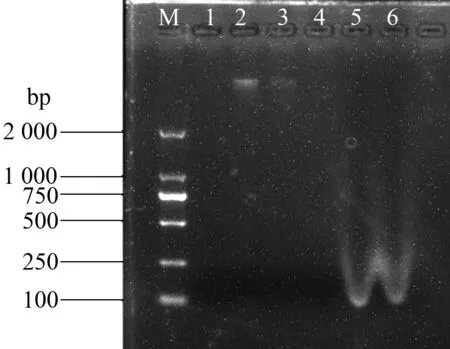
1: CTAB 125 μL,SDS 375 μL; 2: CTAB 100 μL,SDS 400 μL; 3: CTAB 75 μL,SDS 425 μL; 4: CTAB 50 μL,SDS 450 μL; 5: CTAB 25 μL,SDS 475 μL; 6: CTAB 0 μL,SDS 500 μL图3 不添加玻璃珠提取旱地土微生物DNA的琼脂糖凝胶电泳检测结果Fig.3 Agarose gel electrophoresis detection of microbial DNA extracted from dryland soil without glass beads
2.3 改良QIN法和试剂盒法提取旱地土微生物DNA效果的比较
利用改良QIN法和试剂盒法提取旱地土壤微生物DNA,结果见表4。从表4可以看出,改良QIN法得到的DNA含量比试剂盒法低,而质量比试剂盒法好。通过琼脂糖凝胶电泳检测(图4)发现,2种方法均得到比较完整的DNA片段。因此,综合分析DNA含量、纯度以及成本,选取改良QIN法作为本试验的DNA提取方法。
2.4 16S rDNA序列PCR扩增
用上述改良QIN法所提取的旱地土壤DNA 为模板进行16S rDNA PCR 扩增,均可扩增出明亮的150 bp的目标条带(图5),表明提取的DNA质量良好,不需纯化即可用于PCR 扩增。

表4 改良QIN法和试剂盒法提取旱地土壤微生物DNA的含量和纯度比较Tab.4 Content and purity of microbial DNA extracted from dryland soil by modified QIN’s method and reagent box method
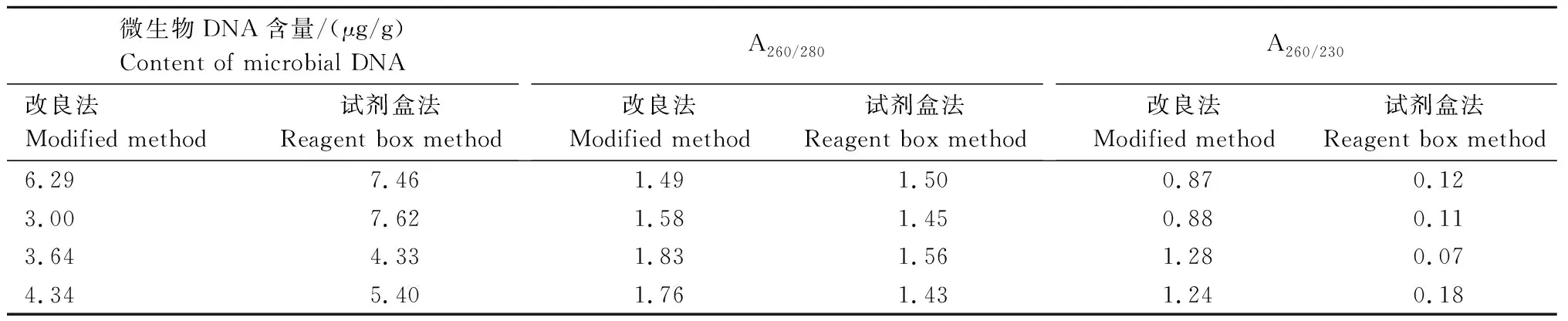
续表4 改良QIN法和试剂盒法提取旱地土壤微生物DNA的含量和纯度比较Tab.4(Continued) Content and purity of microbial DNA extracted from dryland soil by modified QIN’s method and reagent box method
3 结论与讨论
利用现代分子生物学技术研究土壤微生物的前提条件是提取高质量的土壤微生物DNA,而土壤类型、肥力及质量存在差异,导致一种土壤DNA提取法无法满足某些土壤DNA提取要求,因此,选取适合某种土壤类型的有效的DNA提取方法至关重要。前人[11,13]对水稻土土壤微生物DNA的提取方法已有比较成熟的研究,而此水稻土微生物DNA提取法对旱地土壤中微生物DNA的提取效果较差,无法满足后续分子技术试验要求。因此,一种简便高效经济的旱地土壤微生物DNA提取法的探索迫在眉睫。
QIN等[11]的方法可以高效提取第四纪红壤发育的水稻土中微生物DNA,而红壤旱地土壤中腐植酸、重金属离子、多糖类物质等成分与水稻土存在差别,这些因素影响了DNA的提取效果及后续的PCR扩增[14-19]。因此,在QIN法基础上对土壤微生物DNA提取法进行改进。在改良方法试验中,对土壤样品进行预处理,称0.3 g干土加入300 μL无菌水,于-80 ℃过夜,是因为旱地土壤水分含量较低,增加水分可以使土壤微生物得到活化,有利于土壤微生物DNA的提取,同时,在-80 ℃过夜,控制了土壤微生物活化温度及时间,能更好地维持土壤微生物原有丰度。研究表明,在28 ℃加水培养28 d后的风干土中,氨氧化古菌和细菌的种群数量大多出现增加趋势,但其物种组成未发现显著变化[20]。改良QIN法通过对细胞裂解液CTAB与SDS溶液的加入体积配比,以及是否添加玻璃珠裂解微生物细胞进行试验,选择出可适用于红壤旱地土壤微生物DNA提取的方法。与ZHOU等[9]的传统方法相比,此改良方法所需土壤样品量极少,约是ZHOU等[9]方法(需样5.0 g)的6%,且过程更简便、快速,每次可进行更多样品的处理,更能满足于当前对大批量样品的研究需求。改良QIN法与试剂盒法相比,土壤微生物DNA提取效率略低,但纯度较高,且更加经济,同时能满足后续PCR等试验的要求。因此,该改良法是一种适合红壤旱地土的既经济又高效的土壤微生物DNA提取方法。
