基于SERS阵列的铜绿假单胞菌代谢产物铜绿菌素即时检测
2020-05-21陈燕陈欢陈周恬李颖颖杨丹婷沈立亮
陈燕,陈欢,陈周恬,李颖颖,杨丹婷*,沈立亮
(1 宁波大学医学院, 浙江 宁波 315000;2 宁波大学附属人民医院, 浙江 宁波 315040)
1 引言
铜绿假单胞菌(Pseudomonasaeruginosa)在自然界广泛分布,在水、空气、正常人的皮肤呼吸道和肠道存在,最早由Gessard于1882年分离[1],是一种机会致病者,且能分泌铜绿菌素等有害物质。有调查显示,桶装饮用水中铜绿假单胞菌污染非常严重。据世界卫生组织 (WHO) 统计, 人类70%~80%的疾病都来源于不洁净的饮用水。铜绿假单胞菌也是医院内主要的病原体,存在于免疫功能低下的慢性患者,尤其是烧伤、囊性纤维化、泌尿道感染、支气管扩张等感染中,导致严重的发病率和死亡率(40~60%)[2]。铜绿假单胞菌的常规检测和鉴定目前主要有铺板培养法、流式细胞仪法、酶联免疫吸附法(ELISA)、聚合酶链式反应(PCR)等方法。其中铺板培养法是金标准方法,具有很高的灵敏性和选择性,但它们非常耗时,通常需要24~48小时。同时,抗生素不合理使用造成的细菌耐药性导致病人产生严重的并发症、治疗成本增加和临床用药困难等问题。由铜绿假单胞菌污染导致的疾病治疗依赖于对细菌早期、准确和快速的识别。因此,建立铜绿假单胞菌准确快速地早期检测方法是治疗感染性疾病的重要前提和必要手段。
铜绿假单胞菌在生长过程中会分泌大量的生物毒素以保证其在宿主内的生存[5]。在早期感染中,铜绿菌素(pyocyanin,PYO)是唯一能被铜绿假单胞菌分泌的次级代谢产物,可以作为检测铜绿假单胞菌的生物标志物。它是一种蓝色的、具有氧化还原活性的含N芳香族化合物。铜绿菌素在环境中可以作为信号分子、毒性因子和微生物的媒介发挥作用,即使在复杂环境基质中,低浓度的细菌代谢产物也可被成功检测并用以识别被污染的水源或医疗器械等。临床上检测标本中PYO的传统方法是通过氯仿提取然后采用高效液相质谱联用方法(HPLC-MS)测试,前处理耗时、昂贵和复杂的实验室程序在很大程度上限制了HPLC作为临床诊断工具的使用[8]。因此开发成本低、快速、简单、灵敏度高、特异性好的PYO即时检测平台,以省去实验室复杂处理程序,有助于快速获得患者的检查结果,辅助医生进行精准治疗,是临床细菌检测迫切的需求。
表面增强拉曼光谱(Surface-enhanced Raman spectroscopy, SERS)技术是近年来时兴的振动光谱技术,具备高灵敏度、高分辨率、检测速度快、免标记、可提供生物样品指纹图谱的突出优势,满足病原菌快速检测需求。自2016年以来,SERS技术不断被应用在PYO的检测研究中,例如在金纳米颗粒覆盖的SERS基底上铺一层琼脂对铜绿假单胞菌生物膜的信号分子进行成像研究,或者结合微流控技术实现对PYO的检测。但是无论是成像还是实现微流控均需要额外的设备及专业人员进行操作,耗时长,临床样本往往需要进行氯仿前处理,不适用于即时检测的快速、便捷要求。因此,本文开发了一种低成本的SERS阵列以实现对复杂基质中PYO的快速即时检测。通过静电吸附的作用将银纳米颗粒稳定修饰于硅烷化的玻璃片表面以形成灵敏度高的SERS基底,无需任何预处理可实现培养基和唾液中PYO微摩尔级别的直接快速检测。
2 实验
2.1 试剂与仪器
氯金酸(HAuCl4·3H2O,99.9%)、硝酸银(AgNO3,≥99.0%)、硼氢化钠(NaBH4,99.99%)、3-氨丙基三乙氧基硅烷(APTES,≥98%)、4-巯基苯甲酸(4-MBA,99%)、铜绿菌素(Pyocyanin)购于Sigma-Aldrich公司;甲醇(CH4O)、无水乙醇(C2H6O)、柠檬酸钠(Na3C6H5O7,98%)购于国药集团化学试剂有限公司;盐酸(HCl,37%)购于浙江中星化工试剂有限公司;硝酸(HNO3)购于兰溪市六洞山化工试剂厂; Hellmanex III购于Hellma GmbH;LB肉汤购于杭州微生物试剂有限公司。
氮气购于宁波东钱湖方辛炼气压厂;HORIBA XploRA ONE拉曼光谱仪购于上海HORIBA Scientific公司;真空干燥箱、电热鼓风干燥箱购于上海一恒科学仪器有限公司;紫外可见光分光光度仪购于南京菲勒仪器有限公司;台式高速冷冻离心机购于湖南赫西仪器装备有限公司;超纯水(18.25 MΩ·cm-1)取自杭州永洁达净化科技有限公司的超纯水器。
2.2 实验方法
2.2.1金、银纳米颗粒(AuNPs、AgNPs)的合成
AuNPs的合成:采用Frens G[15]发明的柠檬酸钠还原氯金酸方法合成。将2.5 mL的10 mM氯金酸溶液加入到97.5 mL的去离子水中在磁力剧烈搅拌的同时加热到沸腾,快速加入1.5 mL 1%柠檬酸钠溶液并继续加热搅拌30 min。反应结束后自然冷却至室温。红色的AuNPs合成后用0.22 μm滤膜过滤后将其密封避光置于4℃的冰箱保存以备用。
AgNPs的合成:采用Lee和Melsel[16]的方法略加改进合成而得。将102.9 mg的柠檬酸钠溶解在45 mL去离子水中,混合均匀,待溶液沸腾后加入5 mL硝酸银(1 mM)和10 μL 1 mM硼氢化钠,继续加热并搅拌1 h。反应结束后自然冷却至室温。黄绿色的AgNPs合成后用0.22 μm滤膜过滤后将其密封避光置于4 ℃的冰箱保存以备用。
2.2.2银纳米颗粒阵列制备
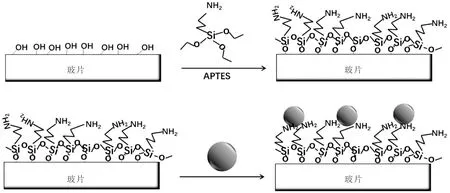
图1 银纳米颗粒阵列示意图Fig.1 Schematic of AgNPs array
本文使用玻璃片作为SERS阵列的修饰基底,原因在于其稳定的物理、化学性质,表面具有均一性,钝化性和有效性,成本低,表面易被修饰。银纳阵列的构建步骤如下:1. 清洗:将普通的玻璃载玻片放于装有2%的Hellmanex溶剂的塑料染色盒中并超声清洗1 h,继而用200 mL的去离子水超声清洗5 min共5次并用氮气吹干,然后 将玻璃片没入200 mL的甲醇/盐酸溶液(v∶v=1∶1)中在室温下震荡孵育1 h,之后用200 mL去离子水超声清洗5 min共5次并氮气吹干,放在真空干燥箱内100 ℃ 烘干1 h。2. 表面修饰氨基:将清洗后的玻片浸入到APTES/乙醇(1% v/v)内在60 ℃水浴加热30 min使其表面覆盖氨基,结束后玻片用乙醇超声清洗5 min共2次,最后放入120 ℃的真空干燥箱内烘干1 h。3.表面修饰纳米颗粒:干燥后浸入至上述准备好的AuNPs或AgNPs溶液中孵育2 h,用氮气吹干后储存在惰性气体的干燥箱中备用。
2.2.3纳米阵列的表征
AuNPs和AgNPs胶体溶液及其阵列的消光光谱测量:由紫外-可见分光光度计获得。取AuNPs或AgNPs胶体溶液于1 mL比色皿中进行吸光度的检测。以空白玻片作为对照,将表面修饰AuNPs或AgNP阵列的玻璃片夹于分光光度计光路可通过的卡槽内进行检测。检测参数设置:扫描波长为300~800 nm,分辨率为2 nm。
玻片阵列的扫描电子显微镜图像获取和分析:表面修饰有AgNPs的玻片阵列表面形貌由Hitachi SU-70扫描电子显微镜获得。
玻片阵列的拉曼成像表征:玻片阵列的均匀性测试使用Renishaw inVia型显微共聚焦拉曼光谱仪获得。在样品检测前对拉曼光谱仪利用硅片(Si)在520.1 cm-1峰作为基准峰进行仪器校准。表面增强拉曼光谱采集激光波长为488 nm,扫描光谱范围为400~2000 cm-1,分辨率为1 cm-1,成像检测区域为7.5 μm×7.5 μm。10 μL罗丹明6G(1 μM)滴于玻片阵列上进行拉曼成像。
2.2.4肉汤培养基及唾液中不同浓度PYO的制备
称取25 g LB肉汤溶于1000 mL蒸馏水中,121 ℃ 15 min高压灭菌后,在培养基里加标不同浓度的PYO,使其最终浓度为10-5M、2×10-6M、10-6M、2×10-7M、10-7M、5×10-8M。
取1 mL正常人的唾液,在唾液中加标不同浓度的PYO,使其最终浓度为5×10-5M、2×10-5M、10-5M、5×10-6M、2×10-6M、10-6M。
2.2.5样品的拉曼检测
使用HORIBA XploRA ONE拉曼光谱仪获得拉曼光谱。在样品检测前对拉曼光谱仪利用硅片(Si)在520.1 cm-1峰作为基准峰进行仪器校准。表面增强拉曼光谱采集激光波长为785 nm,激光强度设置为50%,功率为120 mW,50×目镜,曝光时间为60 s,扫描光谱范围均为400~2000 cm-1,分辨率为1 cm-1。
AuNPs及AgNPs阵列的比较:移液枪取3 μL 1 mM 4-MBA溶液各滴于表面修饰AuNPs或AgNPs的玻片阵列上,至少选取3个不同的位置进行拉曼光谱采集。
PYO样品的SERS光谱测量:移液枪取2.5 μL含有PYO的培养基或者唾液样本分别滴于修饰AgNPs的玻片阵列上,直接进行拉曼光谱采集,每个样品至少采集3次。
2.2.6数据处理
(1)使用NGSLabSpec 5.0软件对拉曼光谱数据的采集和处理,在进行拉曼峰强的计算时,采用软件中的三级多项式算法的基线自动校正功能减除背景。
(2)使用Origin 8.0软件和Adobe Illustrator软件对数据图和光谱图进行处理。
3 结果与讨论
3.1 AgNPs胶体及表面修饰AgNPs的玻片阵列的光学表征
紫外-可见分光光度计用来对合成的AgNPs胶体溶液和修饰AgNPs的玻片阵列进行光学表征。从图2a可看出AgNPs胶体溶液的消光光谱在420 nm有最大峰值;虽然修饰了AgNPs的玻片阵列的消光光谱图最强的峰值发生14 nm的红移,但其谱图与AgNPs胶体溶液的谱图相似,说明AgNPs成功修饰在玻片上。同时,为获得最佳覆盖度的SERS基底阵列,我们对AgNPs胶体溶液在玻片上修饰的时间进行了比较。结果表明,修饰时间为2小时的玻片阵列消光光谱峰强度最高,被选为样品检测的最优修饰时间。
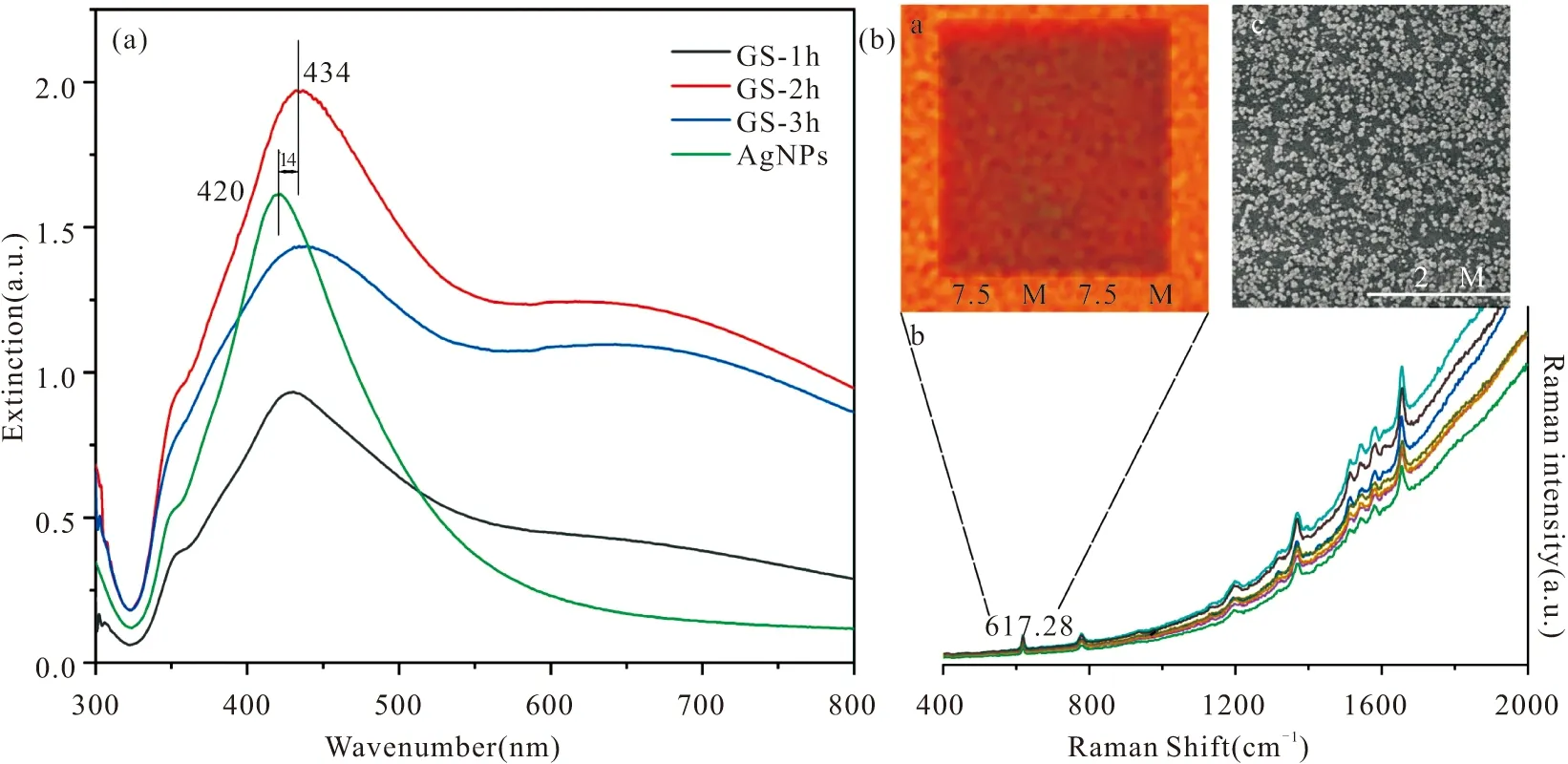
图2 (a) AgNPs胶体及不同孵育时间下(1 h,2 h,3 h)的AgNPs玻片阵列(GS)的消光光谱;(b) a. AgNPs阵列在617.28 cm-1拉曼位移下的拉曼成像图;b. R6G的SERS光谱图;c. AgNPs玻片阵列的SEM图像Fig.2 (a) Extinction spectra of AgNPs array at different incubation time with Ag NPs colloidal solution (1h, 2h, 3h) and AgNPs colloidal solution; (b) a. Raman mapping of AgNPs array at 617.28 cm-1 of R6G; b. SERS spectra of R6G; c. SEM of AgNPs array
3.2 修饰AgNPs玻片阵列的拉曼表征
首先我们比较了分别由AgNPs和AuNPs修饰的玻片基底增强效果,从图3可以看出,AgNPs修饰的玻片基底无论是从出峰的数量还是强度均优于AuNPs修饰的玻片基底。探针分子4-MBA主要被增强的两个特征拉曼峰位于1069 cm-1和1577 cm-1处,通过计算1577 cm-1处的拉曼强度,可知AgNPs修饰玻片基底的增强效果约是AuNPs修饰玻片基底的10倍。同时,为更好的检测阵列的均匀度,我们对2 h修饰的AgNPs玻片阵列进行了SEM图像(图2b(b))及拉曼成像的表征(图2b(a、c))。从SEM的图像可看出,AgNPs在玻片上形成了较为均匀的阵列结构,AgNPs的平均颗粒大小约为38 nm,颗粒间的平均间距约为30 nm;通过对1 μM的罗丹明6G 617.28 cm-1处的拉曼峰进行7.5 μm×7.5 μm的拉曼成像,也可看出图2b(a)中黑色数据点较为均匀的分布,证明我们的阵列具备较好的数据点重复性。
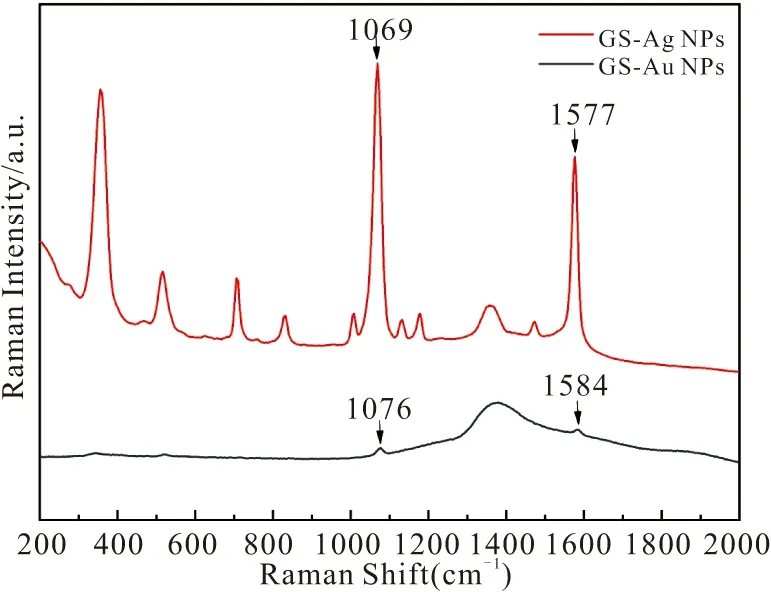
图3 4-MBA在AgNPs和AuNPs修饰的玻片阵列上的SERS光谱Fig.3 SERS spectra of 4-MBA (1 μM) on AgNPs array and AuNPs array
3.3 PYO的特征光谱
铜绿菌素是一种蓝色的、具有氧化还原活性的含N芳香族化合物,其化学结构式可见图4(a)。其在550~800 nm处有一个宽吸收峰,根据文献研究[17],当选择785 nm的拉曼激光波长时,铜绿菌素可实现共振拉曼增强效应,获得高灵敏度的拉曼信号。如图4(b)所示,PYO的拉曼光谱特征峰分别位于420,530,543,597,680,1354,1598和1615 cm-1等。其中,420 cm-1的峰主要归属于环内扭曲,543 cm-1的峰主要归属于C-N扭曲,597 cm-1的峰主要归属于C-C,C-N和C-H平面外弯曲振动,680 cm-1的峰主要归属于环变形,1354 cm-1的峰主要归属于C-C伸缩、C-N伸缩和C-H面内弯曲,1598 cm-1和1615 cm-1的峰主要归属于环变形,C-C伸缩振动和面内弯曲。在接下来的培养基和唾液PYO的SERS检测中,我们将选择各自最强的特征峰作为定量峰,建立各自的定量分析模型。
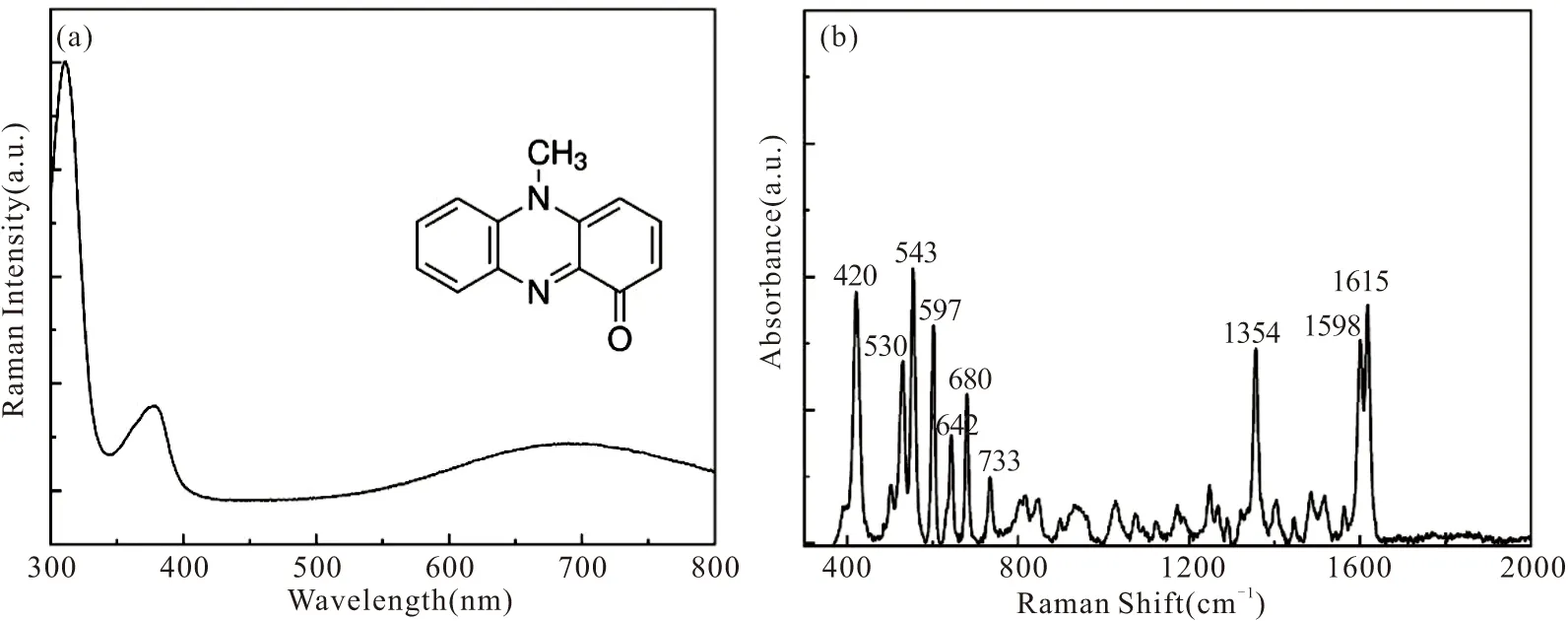
图4 (a) PYO的吸光度光谱和结构式;(b) PYO水溶液的SERS光谱(10 μM)Fig.4 (a) Absorbance spectrum and chemical structure of PYO; (b) SERS spectrum of PYO in aqueous solution (10 μM)
3.4 LB培养基中不同浓度PYO的SERS检测
为测试所构建的SERS玻片阵列直接用于复杂基质中PYO的检测可行性,我们挑选了可培养铜绿假单胞菌的LB培养基作为首选的测试基质,在其中加标不同浓度的PYO,使其最终浓度为10-5M、2×10-6M、10-6M、2×10-7M、10-7M、和5×10-8M。通过图5(a)可以看出,随着PYO浓度的不断增加,420、543、1354、1598 cm-1处的拉曼信号强度也随之增强。通过计算不同拉曼位移下的PYO拉曼强度,以PYO浓度的对数为横坐标,SERS信号强度为纵坐标,可得不同拉曼位移下,PYO浓度和SERS信号强度之间的线性关系。通过比较四个拉曼位移下所得的线性相关系数可得,当拉曼位移为420 cm-1时,R2为0.959,相关系数最大,被选择为培养基溶液中的定量峰。
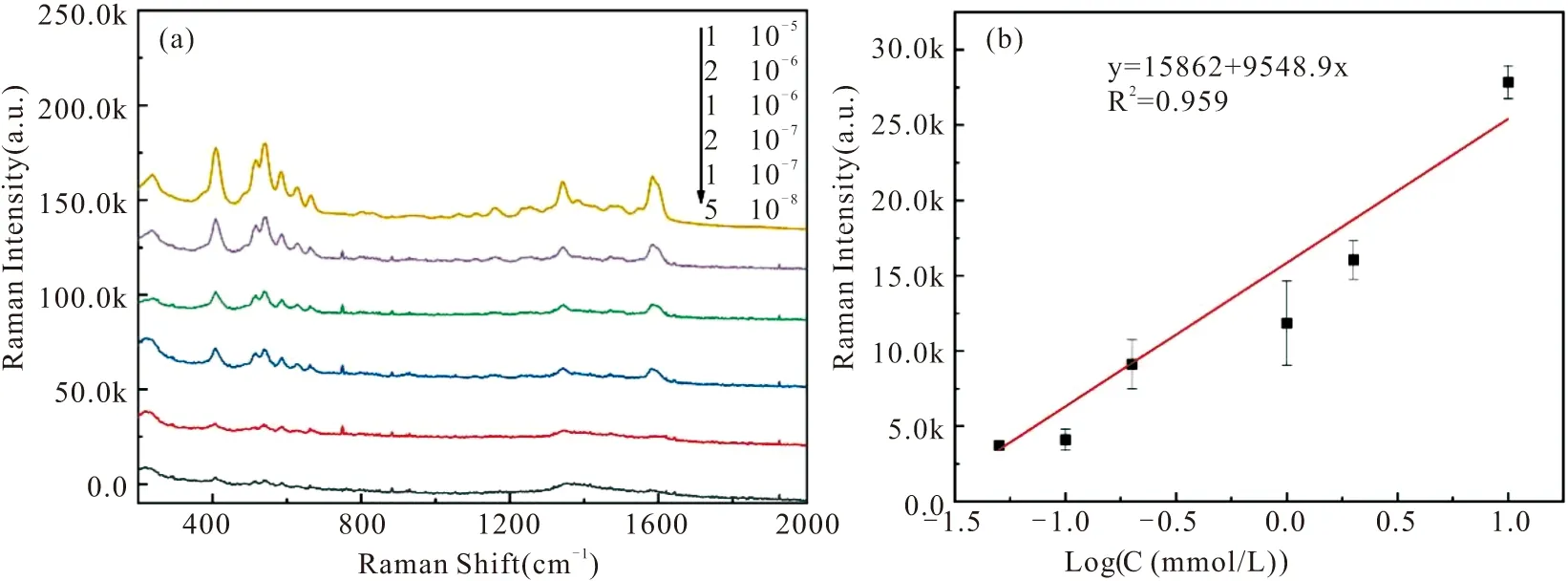
图5 (a) 培养基中不同浓度PYO的SERS 光谱;(b)PYO浓度及拉曼强度建立的标准曲线Fig.5 (a) SERS spectra of PYO at different concentrations in LB medium; (b) The calibration curve based on PYO concentration vs Raman intensity
采用线性回归方法,在PYO浓度(5×10-8M~10-5M)范围与SERS光谱在420 cm-1处的拉曼特征峰的峰强之间建立了线性回归模型y=15862+9548.9x,检测限(S/N=3)为0.5 μM。
3.5 唾液中不同浓度PYO的SERS检测
为验证SERS玻片阵列在临床应用中的可行性,我们在正常人的唾液中加标不同浓度的PYO(10-4M、5×10-5M、2×10-5M、10-5M、5×10-6M、和2×10-6M)。图6(a)为PYO在唾液中不同浓度的SERS光谱。从图中可以看出,随着PYO的浓度增高,420、543、1354、1615 cm-1处的拉曼信号强度也随之增强。通过计算不同拉曼位移下的PYO拉曼强度,以PYO浓度的对数为横坐标,SERS信号强度为纵坐标,可得不同拉曼位移下,PYO浓度和SERS信号强度之间的线性关系。不同于LB培养基,唾液中在拉曼位移为1615 cm-1时,R2为0.9962,线性关系最大,因此在唾液中选择1615 cm-1作为定量峰。在PYO浓度(2×10-6M~10-5M)范围与SERS光谱在1615 cm-1处的拉曼特征峰之间建立了线性回归模型为y=-125+257.8x,检测限(S/N=3)为0.35 μM。
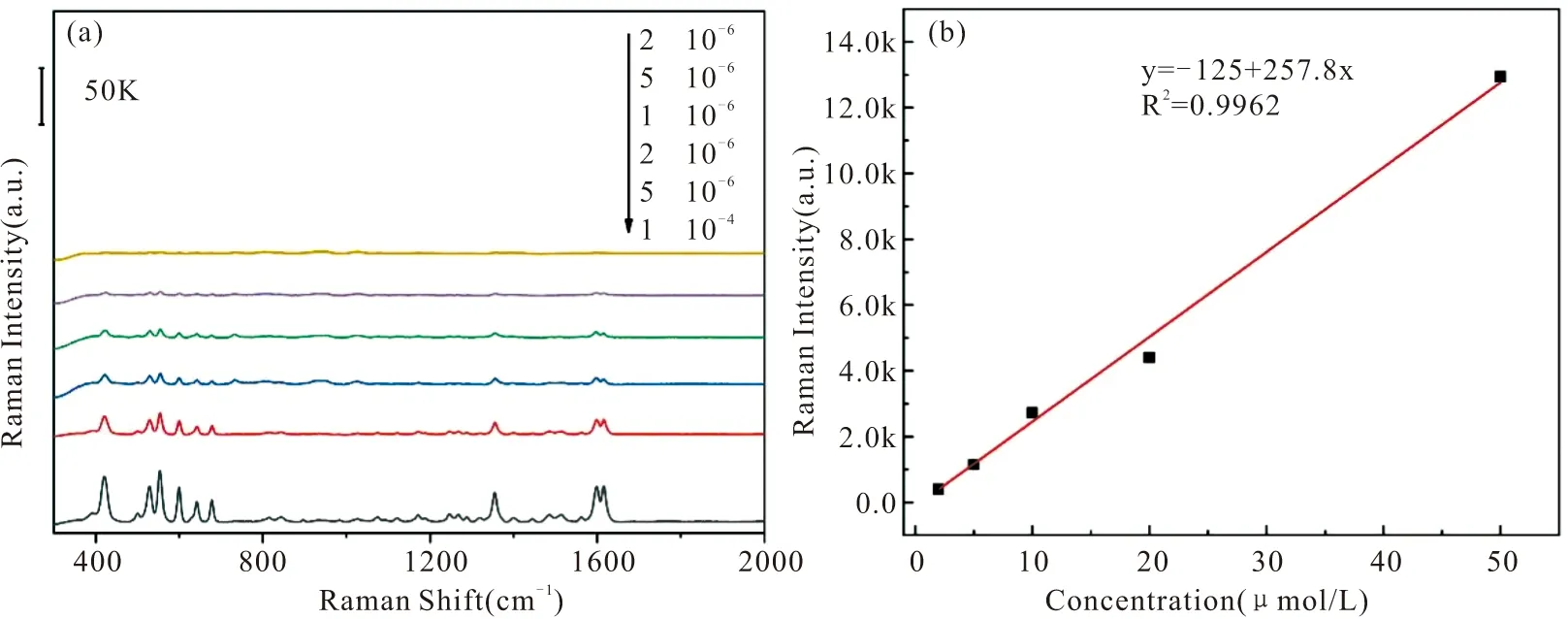
图6 (a) 培养基中不同浓度PYO的SERS 光谱; (b)PYO浓度及拉曼强度建立的标准曲线Fig.6 (a) SERS spectra of PYO at different concentrations in saliva; (b) The calibration curve based on PYO concentration vs Raman intensity
4 结论
本文构建了一种低成本的、AgNPs修饰的玻片SERS阵列,无需任何前处理可直接实现在培养基及唾液中对铜绿假单胞菌的分泌物铜绿菌素的定量分析。通过对玻璃片进行氨基硅烷化修饰并利用静电吸附原理在其表面均匀吸附一层银纳米颗粒,可构建具有重复性好、灵敏度高的表面增强拉曼效应的可抛弃式阵列,以获得铜绿菌素的表面增强共振拉曼光谱。此SERS阵列则可以直接获得铜绿菌素的有效拉曼光谱峰,其主要的特征峰主要为420,543,597,680,1354,1598,和1615 cm-1,其中用来进行定量分析的420 cm-1和1615 cm-1处拉曼位移分别归属于-CCN环弯曲和-C-N弯曲,及C=C环拉伸和C=N环拉伸。此阵列对肉汤培养基和唾液的PYO检测限分别为0.5 μM和0.35 μM,远低于临床样本中检测铜绿菌素的浓度,表明我们所构建的SERS玻片阵列,方法简单、携带方便、可抛弃,具备适用于临床上铜绿假单胞菌代谢产物铜绿菌素高灵敏的即时检测潜力。
5 致谢
感谢浙江省自然科学基金(LY17H260003)、浙江省病理生理学技术研究重点实验室/省重点实验室开放项目、宁波大学王宽诚基金对本研究的资助。
