单链DNA表面增强拉曼散射检测条件的优化
2020-05-21蒋承顺李旺柳艳陆峰
蒋承顺,李旺,柳艳,陆峰,*
(1.福建中医药大学药学院,福州 350122;2.海军军医大学药学院,上海 200433)
1 引言
DNA即脱氧核糖核酸,由脱氧核苷酸组成,具有复杂的结构。每个脱氧核苷酸都由磷酸、脱氧核糖和含氮碱基组成。其中,含氮碱基又分为腺嘌呤A、鸟嘌呤G、胞嘧啶C和胸腺嘧啶T四种类型。四种含氮碱基含量与排列顺序的不同决定了遗传物质的多样性。作为大多数生物的遗传信息载体,对DNA的研究一直是科学研究的热点之一。
传统的DNA分析方法,如聚合酶链反应和微阵列技术,通常需要荧光标记,不仅程序复杂、成本较高,还会导致DNA分子内在化学结构信息出现损失。而目前建立的检测分析技术常涉及DNA标靶的标记和杂交后标记,使检测过程更加复杂[1,2,3]。表面增强拉曼光谱是一种超灵敏的检测方法,当分子与粗糙的贵金属表面接近时,可产生强Raman散射信号[4,5]。许多学者运用SERS对DNA进行检测和分析。Papadopoulou[6,7]用硫醇化修饰DNA,使之附于金属粒子表面,得到了增强的拉曼信号。而后发现在Ag胶基底中加入一定量的MgSO4能够促进Ag纳米颗粒的聚集从而获得DNA的SERS光谱,而不需要对DNA进行硫醇化。2015年,Xu[8]等人用碘化钾修饰Ag纳米颗粒(Ag IMNPS),同时添加MgSO4以中和表面电荷并增强DNA与Ag纳米颗粒的相互作用,在模仿人生理环境的溶液中检测到具有高度可重复性的拉曼信号。该方法操作简单,不需要特殊的基底,能检测到丰富的信号且重现性较好。因此,本文以此方法为基础,进一步优化SERS对ssDNA(single-stranded deoxyribonucleic Acid)的检测条件。
已有的文献研究中,SERS检测ssDNA常使用大型且昂贵的台式显微共聚焦系统,有时不能满足快速现场检测的需求。相比之下,便携式拉曼光谱系统具有易于携带、操作简便、快捷、价格低的优点,在现代分析中应用越来越广泛。然而,以Ag IMNPS为基础的方法却不直接适用于便携式拉曼系统对DNA的检测。因此,本文对该方法的检测条件进行优化,使其适用于便携式拉曼光谱系统,并对优化后的方法进行稳定性、重复性和检测限的考察,还对检测结果进行峰位归属,为便携式拉曼光谱系统检测ssDNA提供一种新的方法基础。
2 材料与方法
2.1 样品与试剂
单链DNA GO18(序列为AACCTTTGGTCGGGCAAGGTAGGTT (5′~3′)),购自生工生物工程(上海)股份有限公司;硝酸银(AgNO3)、柠檬酸三钠(Na3C6H5O72H2O)、硝酸(HNO3)均为分析纯,购于国药集团化学试剂有限公司;碘化钾(KI)、硫酸镁(MgSO4)均为分析纯,购自上海泰坦科技股份有限公司;其他实验耗材均购于探索平台;实验用水为去离子水。
2.2 仪器与设备
便携式拉曼光谱仪(BWS415-785H),激光激发波长785 nm,分辨率5 cm-1,配有放大倍数为20倍的物镜,购自美国必达泰克公司;双光束紫外可见分光光度计(TU-1902),购自北京普析通用仪器有限责任公司;高速离心机(TG16-WS),购自上海卢湘宜离心机有限公司;扫描电子显微镜(Zeiss EVO MA-10),购自德国Carl-Zeiss公司;多功能旋涡混合器(Vortex-Genie2),购自美国Scientific Industries 公司;实验室纯水系统(Smart-D UV),购自上海和泰仪器有限公司;集热式恒温加热磁力搅拌器(DF-101S),购自上海梅颖浦仪器仪表制造有限公司;电子天平,购自北京赛多利斯仪器系统有限公司;圆底烧瓶,冷凝管等。
2.3 纳米银胶的制备与表征
本实验采用经典的Lee法制备纳米银胶[9]。首先,精密称取36 mg的硝酸银,溶于200 mL的去离子水中,倒入500 mL三颈烧瓶内,加热并磁力搅拌,当溶液微沸时,保持搅拌状态,将4 mL质量分数1%的柠檬酸三钠水溶液缓慢加入,继续回流搅拌加热60 min,可以观察到溶液的颜色逐渐由无色透明变为深棕色,最后变为淡黄色并略显绿色,停止反应后室温冷却,即得到粒径约为50 nm 的纳米银球,最后倒入干净的棕色瓶中避光保存。由于银胶属于介稳体系,因此每次取用纳米银胶时,均需摇晃均匀。取银胶原溶液1 mL离心(5000 r/min,5 min),除去上清液,用等量去离子水复溶,再加去离子水至5 mL,然后在300~500 nm波长范围进行紫外扫描。取银胶原溶液1 mL离心(5000 r/min,5 min),除去上清液,加去离子水至1 mL,取2~3 μL滴于硅片上,在红外灯下照射,待溶剂挥发完全后进行电镜扫描。
2.4 待测体系的配制
单链DNA初始为粉末状,加入去离子水配制成浓度为50 μM的母液,置于-20℃的冰箱中储存。精确称取KI粉末16.6 mg溶于100 mL去离子水中,得1 mM KI溶液。精确称取MgSO4粉末60 mg溶于50 mL去离子水中,得10 mM MgSO4溶液。基于参考文献[8]并适当改变,用移液枪取2.5 μL浓缩胶,向其中精密加入2.5 μL 1 mM的KI溶液,涡旋,使其充分混合,并在室温下孵育20 min,以确保KI完全清洗AgNPs表面。然后加入2.5 μL DNA溶液和适量10 mM的MgSO4溶液充分混合,再加去离子水至50 μL,混匀即得。
2.5 SERS检测条件的优化和检测方法的确定
为了获得更加灵敏的信号,同时阐明不同检测参数对单链DNA SERS图谱的影响,分析单链DNA GO18在便携式拉曼光谱仪的不同检测条件下的SERS谱图。试验参数设置为:银胶浓缩倍数50倍、100倍和150倍;激发功率为30%(60 mW)、50%(100 mW)、80%(160 mW);积分时间为10 s、20 s、30 s;扫描次数为1次;显微系统放大倍数为20倍;装样方式为96孔板、高纯度石英毛细管1.0~0.8(外径1.0 cm,内径 0.8 cm)、1.0~0.7、1.75~0.9);凝聚剂MgSO4(10 mM)用量0.5 μL、1.0 μL、2.0 μL、3.0 μL、4.0 μL、5.0 μL。分析不同试验参数对SERS结果的影响,以获得优化的检测条件。
2.6 数据处理
采用BWSpec4软件对采集的原始光谱进行平滑(savitzky-golay平滑)、基线校正(airPLS法)等处理。然后用MATLAB 13.0软件对数据做进一步的处理,使其能够用于Origin 8.5软件进行绘图。由于光谱波段400 cm-1之前和1800 cm-1之后几乎没有光谱特征,因此选取光谱波段400~1800 cm-1进行绘图分析。
3 结果与讨论
3.1 纳米银胶的表征
对制得的银胶原溶液进行紫外扫描和电镜扫描。扫描电镜显示所制得的纳米银胶颗粒呈直径为50 nm的球体状态,且大小分布较为均一。紫外扫描只在410 nm处出现了一个尖锐的单峰,且其半峰宽较小,反映出纳米银胶颗粒具有良好的分散性与均一性,能够满足试验的需要。
3.2 银胶浓缩倍数的优化
选择合适的银胶浓缩倍数是SERS实验顺利实施的一个重要因素。本实验配制了浓缩50倍、100倍和150倍三种浓缩胶,在其他条件相同的情况下,探究浓缩倍数对SERS检测结果的影响。图1的结果表明:浓缩100倍与50倍的检测信号强度相似,但前者能更快检测到稳定的信号,而浓缩150倍的银胶未能出现正常的ssDNA SERS信号。原因可能是:50倍浓缩胶中,银纳米颗粒的量相对较少,不能够最大程度地增强ssDNA的SERS信号,而且较少的银纳米颗粒需要更多时间聚沉到稳定状态;100倍浓缩胶中银纳米颗粒的数量相对充足,能够最大程度地增强ssDNA的SERS信号,且较多的银纳米颗粒能够更快地聚沉至稳定状态,更快检测到稳定的SERS信号;150倍浓缩胶中的银纳米颗粒数量过多、易聚沉,导致银胶本身的信号较强,而ssDNA反而不易与银胶接触,导致ssDNA的信号变弱而被银胶本身的信号掩盖,出现了异常峰信号。总之,银胶浓缩100倍时,能更快地检到稳定且强度大的SERS信号。

图1 不同银胶浓缩倍数检测结果Fig.1 Testing results of different silver sol concentrations
3.3 装样方式的优化
不同装样方式对检测结果有较大影响,文献[8]中使用96孔板进行检测,该方式所需要的样品量大且待检体系易于沉淀,所以尝试选用高纯石英毛细管装样。考虑到不同内外径毛细管管壁不同,单位激光照射面积上的液体体积不同可能对检测结果有影响,选用三种不同内外径毛细管1.0~0.8(表示该高纯石英毛细管外径1.0 cm,内径0.8 cm,下同)、1.0~0.7、1.75~0.9进行检测并与96孔板相比较。96孔板的检测结果峰信号很弱,原因是96孔板中待检体系出现明显沉淀,导致激光照射处ssDNA和银纳米颗粒浓度较低。1.75~0.9毛细管的信号也明显低于1.0~0.7和1.0~0.8毛细管,可能是因为1.75~0.9毛细管的管壁较厚,降低了入射激光的效率导致检测信号较弱。1.0~0.8和1.0~0.7毛细管的检测结果基本相同,但考虑到1.0~0.8毛细管的内径更大,更有利于移液枪进样,所以后续都使用1.0~0.8毛细管装样。
3.4 激光功率和积分时间的优化
由于激光功率和积分时间对SERS检测结果有比较大的影响,所以对二者同时进行优化。首先,选择三个常用激光功率(30%(60 mW)、50%(100 mW)和80%(160 mW))和三种积分时间(10 s、20 s、30 s),再将二者进行两两组合,即对9种检测条件进行比较。激光功率-积分时间为10 s-30%、10s-50%和20s-30%的峰信号较弱,而20s-80%、30s-50%、30s-80%的峰信号超出量程,所以这6种条件加以排除。对10s-80%、20s-50%、30s-30%这三种检测条件进行筛选(图2),10s-80%的强度略低于20s-50%和30s-30%,而后两者强度几乎无差别,但是激光功率为30%(60mW)时,对低浓度样品的检测更有优势,检测限更低,所以最终选择30s-30%作为优化条件。
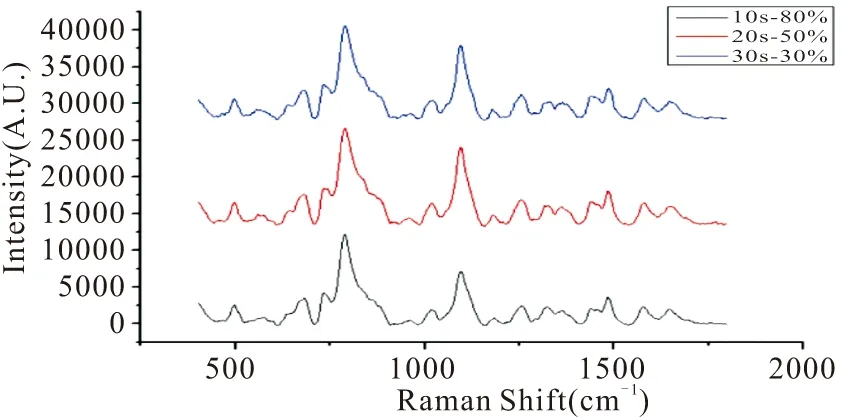
图2 激光功率-积分时间检测结果筛选Fig.2 Screening of laser power-integration time detection results
3.5 凝聚剂MgSO4加入量的优化
在检测体系中加入MgSO4,可以中和Ag IMNPS表面电荷并增强ssDNA与Ag IMNPS的相互作用,从而能够检测到强烈且可再现的SERS信号[8]。加入MgSO4量的多少对检测结果有较大影响,所以考察其加入量。在检测体系的配制过程中,分别加入MgSO4(10 mM)0.5 μL、1.0 μL、2.0 μL、3.0 μL、4.0 μL、5.0 μL进行检测,结果如图3。可见加入0.5 μL、1.0 μL MgSO4的信号较弱,可能是因为MgSO4的量不能够使Ag IMNPS与ssDNA充分凝聚。加入MgSO4体积为2.0 μL、3.0 μL、4.0 μL、5.0 μL的峰信号强度无明显差别,说明2.0 μL MgSO4就足够使得Ag IMNPS与ssDNA充分凝聚,再增加MgSO4反而可能会因为凝聚剂过多,使得检测体系出现沉淀,影响检测结果。因此,加入2.0 μL MgSO4(10 mM)是最优的条件。
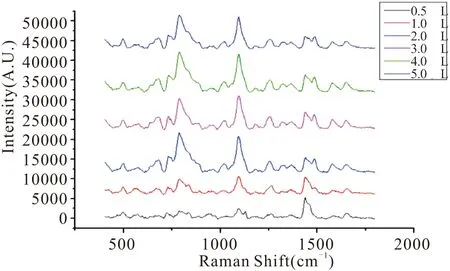
图3 不同MgSO4加入量的检测结果Fig.3 Testing results of different MgSO4 addition amount
综上,便携式拉曼光谱仪对单链DNA检测的最佳条件为:银胶浓缩100倍,高纯石英毛细管 1.0~0.8(外径 1.0 cm,内径 0.8 cm)装样,激光功率30%(60 mW),积分时间30 s,凝聚剂MgSO4(10 mM)2.0 μL。
3.6 方法学考察与峰位归属
3.6.1重复性考察
按照优化后的条件,对同一浓度待测体系进行6次检测,检测体系中样品浓度为2.5 μM,每次取稳定后的光谱图进行重复性的检验。拉曼位移在788cm-1处出现最强峰,归属于PO2-的骨架伸缩振动,以该峰峰强计算RSD值,结果为4.72%,显示该方法重复性较好。
3.6.2稳定性考察
按照优化后的条件,对同一待测体系进行了连续的SERS检测,检测体系中样品浓度为2.5 μM,每次测量间隔为0 s,共采集120张光谱。图4为第1、2、3、4、5、10、20、40、60、80、100、120张光谱图,可见前5张图谱信号一直上升,然后趋于稳定(即检测150s后)。主要原因为:在加入MgSO4之后,激光照射下银纳米颗粒的聚集加快,前5张图谱是在凝聚点到达稳定过程中检测的,随后纳米颗粒聚集达到稳定状态,信号也随之稳定。
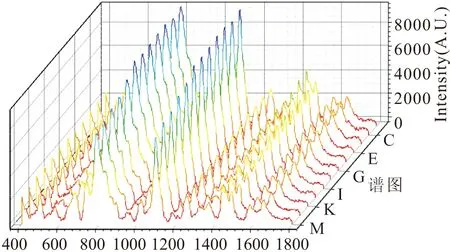
图4 同一样品采集120次部分谱图Fig.4 Part of 120 spectra from the same sample
3.6.3检测限考察
按照优化后的条件,采用倍比稀释法配制了ssDNA终浓度为5.0μM、2.5μM、1.25μM、0.625μM、0.313μM的检测体系,如图5所示,拉曼位移在1094 cm-1处出现最稳定特征峰,文献中已有报道其为ssDNA中磷酸骨架的特征峰,以此峰计算检测限。当样品最终浓度为0.625μM时,S/N>3;终浓度为0.313μM时,S/N<3,因此0.625μM可作为检测限。该浓度已低于大多数文献报道的SERS测定DNA的浓度,说明优化后的方法具有一定优势。

图5 不同样品浓度检测结果Fig.5 Testing results of different sample concentrations
3.6.4峰位归属
文献中对ssDNA的SERS峰位进行了初步的归属但并不详细,而且由于方法的改进及选用仪器的改变,可能会与已有报道的峰位归属存在一定的偏差,所以需要对优化条件所得到的SERS图谱重新进行峰位归属。
首先设计了存在单一碱基类型的单链ssDNA序列,即在一条 ssDNA 链中所有的碱基类型都为A或T或C或G,即A11、T11、C11、G5(下标表示碱基个数,需要注意的是,在单链ssDNA的合成中,一条链中连续G的个数不能超多5个,因此,G5的碱基个数为5个G,其他序列为11个同种碱基)。然后分别进行SERS检测,与样品检测结果进行归一化后相对比。
图6为A11、T11、C11、G5以及GO18的SERS光谱图,可以看出,四种不同的ssDNA具有丰富且独特的SERS指纹信息。它们在1094cm-1处(归属于PO2-的对称伸缩振动)显示出共同的SERS强峰,在788 cm-1附近也能观察到明显的由PO2-骨架伸缩振动所产生的SERS峰,表明在该待测体系中磷酸骨架非常接近Ag IMNPs表面,从而产生增强的拉曼信号。A11的SERS光谱在730 cm-1处出现腺嘌呤的主要特征峰,来源于腺嘌呤的环呼吸振动。T11的SERS光谱图在745 cm-1的峰为胸腺嘧啶的SERS特征峰,来源于胸腺嘧啶的环呼吸振动,同时1649 cm-1也出现胸腺嘧啶强的特征峰。对于C11的SERS光谱,其只在683 cm-1左右出现较小的特征峰,而在790 cm-1处出现一强峰,该峰并不完全来源于胞嘧啶的环呼吸振动,而是由于C的环呼吸振动所产生,它与磷酸骨架伸缩振动所产生的788 cm-1处的峰拉曼位移比较接近,两者重叠后在791 cm-1左右处出现很强的包埋复合SERS峰。对于G5的SERS光谱,在683 cm-1、1325 cm-1、1487 cm-1、1576 cm-1处存在其主要的特征峰,分别对应G环的呼吸振动、dG C2′-endo/syn、dG N7 H-bond to H2O、dG δNH (N2HH-bond to H2O)。另外,800 cm-1~1150 cm-1范围内也具有较为丰富的SERS峰,来源于磷酸骨架和脱氧核糖的分子振动。

图6 样品与单碱基单链DNA检测结果Fig.6 Testing results of the sample and the single-base ssDNA
与文献相比,可以很明确地发现方法的改进与检测仪器的改变会对ssDNA的SERS峰位归属产生一定的影响(如文献中PO2-的对称伸缩振动在1087cm-1处出峰,而本文所测得的峰为1094cm-1),主要体现在峰位的小幅度偏移,以及个别峰的强度差异上。但同时也可以表明该方法可以真实地反映ssDNA的基本结构组成的指纹信息,包括碱基、磷酸骨架及脱氧核糖,进一步证明了该方法具有较高的可靠性与一定的应用前景。
通过对四种不同单一碱基类型的ssDNA的分析,以及参照已有文献对各种ssDNA的SERS峰位归属,本文对改进的SERS方法检测GO18得到的峰位进行了更加完善详细的归属(表1)。

表1 GO18的SERS峰归属Table.1 The SERS peak position assignment of GO18
4 结论
本文以GO18为例,研究银胶溶液浓缩倍数、激发功率及积分时间、装样方式、凝聚剂MgSO4的用量等不同检测条件对单链DNA的SERS检测结果的影响,确定了最佳的检测条件。该条件下,方法稳定性和重复性好,峰位归属明确,检测限达0.625 μM。本研究为进一步扩大和推动SERS技术在单链DNA检测中的应用提供了方法基础。
