混菌发酵生产芒果醋条件优化及其产品质量评价
2020-05-21张开平1刘燕丽1黄江奇2农建鹏1周利宏1吴文标
张开平1,刘燕丽1,黄江奇2,农建鹏1,周利宏1,吴文标
(1.百色学院农业与食品工程学院,广西百色 533000; 2.龙邦海关,广西靖西 533800; 3.西南大学食品科学学院,重庆 400716)
醋的流行源于其具有调节高血脂的作用[1]。此外,有大量的研究表明食醋还具有其它一些保健作用如:缓解静脉曲张[2]、降血糖[3-7]、抗氧化作用、改善非酒精型脂肪肝患者的生育力[8]和减轻高脂饮食导致的肝损伤[9]等。
芒果(MangiferaindicaL.)属于仙人掌漆树科杧果属,富含各种维生素和人体必需矿物质元素,俗称“热带水果之王”[10-11]。随着现代农业的高速发展以及国家政策对农业的大力支持,芒果种植面积大幅增加,产量逐年升高,因此,其资源十分丰富[12-13]。但是,我国对于芒果的加工程度仍然不高,造成了较大的资源浪费,不能发挥其优势创造良好的经济效益[14-15]。以芒果为原料酿制成果醋,不仅具有芒果固有的果香,而且还具有比芒果更高的营养价值,芒果经发酵制成芒果醋后,其总抗氧化能力(FRAP法测定)为(4.8±0.5) mmol·L-1,较芒果果实高,同时还能增加芒果醋中挥发性脂肪酸含量,赋予芒果醋特殊风味[16-17]。
混菌发酵是指利用两种或两种以上具有共生作用的微生物,联合完成某种发酵过程的新型技术,是单一菌株纯培养技术上的创新,目前混菌发酵主要研究热点在于酵母-乳酸菌、酵母-醋酸菌的混合发酵。Wang等采用酿酒酵母与巴氏醋杆菌混合发酵,并对发酵工艺进行正交优化,结果发现混菌发酵能减少发酵损失,提高产酸率,混菌发酵产酸率为66.0 g/L,比对照组提高约50%[18]。Nguyen等[19]采用酵母菌-醋酸菌混菌发酵葡萄糖醛酸,酵母菌(23×108CFU·mL-1)与醋酸菌(2×108CFU/mL)最佳初始组合比例为4∶6,该比例下葡萄糖醛酸产量为175.8 mg·L-1,发酵周期7 d,显著提高了生产效率(P<0.05)。我国民间传统红茶菌发酵饮料一般都是由几种醋酸菌与酵母菌共同发酵而成,其中,醋酸菌和酵母菌共生,酵母菌是“启动子”,酵母菌分解蔗糖,供自身繁殖并生成乙醇;醋酸菌利用酵母分解蔗糖获得碳源,酵母产生的乙醇会刺激醋酸菌产生乙酸,而乙酸又能刺激酵母菌产生乙醇;此外,不同醋酸菌、酵母菌菌种发酵红茶,由于菌种差异性和代谢途径的复杂性,所形成的发酵产物的风味物质、活性成分数量和含量也有所差异[20-22]。由此可见,与传统的纯种分段发酵相比,混菌发酵中的多种微生物之间形成特殊的共生关系及复杂代谢通路,使得发酵过程得以缩短,简化工艺,提高生产效率,还可改进传统发酵产品风味欠佳的缺点[23]。虽然近几年在采用其它原料混菌发酵生产食醋方面有研究报道,例如王陶等[24]开展了以紫薯和杏鲍菇为原料,经果酒酵母和醋杆菌混合发酵生产复合醋方面的研究,但混菌发酵应用于生产芒果醋目前鲜见报道。
本研究以百色市芒果为原料,对采用酵母菌醋酸菌混菌发酵生产芒果醋的条件进行优化,并对生产的芒果醋的质量进行了评价,旨在为芒果的进一步深加工利用提供有效的技术参考。
1 材料与方法
1.1 材料与仪器
芒果 购于百色市芒果街水果批发市场;酵母菌 安琪葡萄酒果酒专用酵母粉(SY10 g);醋酸菌SS-019 实验室保藏;果胶酶(30万 U/g) 泰安信得利生物工程有限公司;白砂糖(一级品) 柳冰食品厂;异抗坏血酸钠(食品级) 河南康之旺生物科技有限公司;其它试剂 均为分析纯。
LRH-70型生化培养箱 上海一恒科学仪器有限公司;FAI2048型电子分析天平 上海市安享电子仪器厂;HH-S1型数显恒温水浴锅 江苏金怡仪器有限公司;HYG-B型全温摇瓶柜 江苏常州金坛良友仪器有限公司;JYL-Y917型榨汁机 九阳股份有限公司;手持折光仪 上海勃基仪器仪表有限公司;GJJ-0.03/100型高压均质机 上海诺尼轻工机械有限公司。
1.2 实验方法
1.2.1 培养基的配制 醋酸菌活化培养基(g/L):酵母膏12.0,葡萄糖12.0,碳酸钙15.0,琼脂18.0,pH5.5,培养基灭菌后,加入5%经过滤除菌的无水乙醇。
醋酸菌种子培养基(g/L):酵母膏12.0,葡萄糖12.0,pH5.5,培养基灭菌后,加入5%经过滤除菌的无水乙醇。
1.2.2 芒果醋酿制工艺流程 在Kaushik等[25]所报道的制取芒果浆工艺流程基础上加以改进制作出芒果汁;然后发酵芒果汁生产芒果醋。整个试验过程中具体的操作流程如下:

1.2.3 芒果醋酿制工艺的操作要点 芒果汁的制备:挑选芒果表皮光滑且果皮皮色黄橙,无机械损伤、无病虫害的新鲜芒果,洗净之后放入90 ℃的热水浴中烫3 min,剥皮切块、打浆,加0.01%异抗坏血酸钠防止果汁发生酶促褐变[26],然后再加0.1%果胶酶于55 ℃的恒温水浴锅中酶解1.5 h,用四层无菌纱布过滤,得芒果汁备用。
调整芒果汁糖度与酸度:取少量芒果汁先溶解白砂糖,然后加入芒果汁中,调整芒果汁糖度到发酵用糖度,再添加适量的柠檬酸调整果汁酸度到pH5.0。
灭菌:将调配糖度和酸度后的芒果汁放入热水浴中进行杀菌灭酶,待果汁中心温度达到80 ℃时,继续保温8 min,保温时间结束后,立即冷却至28~30 ℃,备用。
菌种活化:酵母菌活化种子液:按照10 g酵母粉加100 mL 5%糖浓度的芒果汁的比例,称取所需酵母于38 ℃条件下搅拌,活化约15~20 min,出现大量小气泡即可[27],备用。醋酸菌活化种子液:将保藏菌种进行平板划线培养,然后将活化的醋酸菌接入种子培养基中,于30 ℃、130 r/min的恒温摇瓶柜培养36 h[24],备用。
果醋酿造:将50 mL调配糖度和酸度后的芒果汁装入经过高温灭菌的三角瓶中,分别接入一定量的酵母菌与醋酸菌种子液,然后分别放置在一定的温度条件下,于130 r/min的恒温摇瓶柜分别培养6~11 d。发酵期间每天测定醋酸含量,直到醋酸含量不再上升或上升缓慢时即可停止发酵。发酵原果醋经过陈酿、过滤、均质、杀菌、无菌装瓶等工序,即得芒果醋成品。
1.2.4 混菌发酵单因素实验
1.2.4.1 芒果汁初始糖度对混菌发酵的影响 按照“1.2.3”所述的基本步骤,调节芒果汁初始糖度分别为10、12、14、16、18和20 °Bx,其它固定因素如下:酵母菌接种量0.15%,醋酸菌接种量8%,发酵温度30 ℃,发酵时间7 d,发酵结束后,测定果醋中乙酸含量。
1.2.4.2 酵母菌接种量对混菌发酵的影响 按照“1.2.3”所述的基本步骤,酵母菌接种量分别为0.05%、0.1%、0.15%、0.20%、0.25%(v/v),其它固定因素如下:芒果汁糖度16 °Bx,醋酸菌接种量8%,发酵温度30 ℃,发酵时间7 d,发酵结束后,测定果醋中乙酸含量。
1.2.4.3 醋酸菌接种量对混菌发酵的影响 按照“1.2.3”所述的基本步骤,醋酸菌接种量分别为4%、6%、8%、10%、12%、14%(v/v),其它固定因素如下:芒果汁糖度16 °Bx,酵母菌接种量0.15%,发酵温度30 ℃,发酵时间7 d,发酵结束后,测定果醋中乙酸含量。
1.2.4.4 发酵温度对混菌发酵的影响 按照“1.2.3”所述的基本步骤,将发酵温度分别设置为26、28、30、32、34、36 ℃,其它固定因素如下:芒果汁糖度16 °Bx,酵母菌接种量0.15%,醋酸菌接种量8%,发酵时间7 d,发酵结束后,测定果醋中乙酸含量。
1.2.4.5 发酵时间对混菌发酵的影响 按照“1.2.3”所述的基本步骤,发酵时间分别为6、7、8、9、10、11 d,其它固定因素如下:芒果汁糖度16 °Bx,酵母菌接种量0.15%,醋酸菌接种量8%,发酵温度30 ℃,发酵结束后,测定果醋中乙酸含量。
1.2.5 正交试验 为了确定混菌发酵芒果醋的最优条件,以发酵结束时果醋中乙酸含量为指标,根据单因素实验的结果分析,固定酵母菌添加量为0.15%(v/v)、恒温摇瓶柜的转速为130 r/min,选取芒果汁初始糖度、醋酸菌添加量、发酵温度和发酵时间4个因素进行L9(34)正交实验,因素与水平见表1。按照“1.2.3”所述的基本步骤进行了各种组合试验。
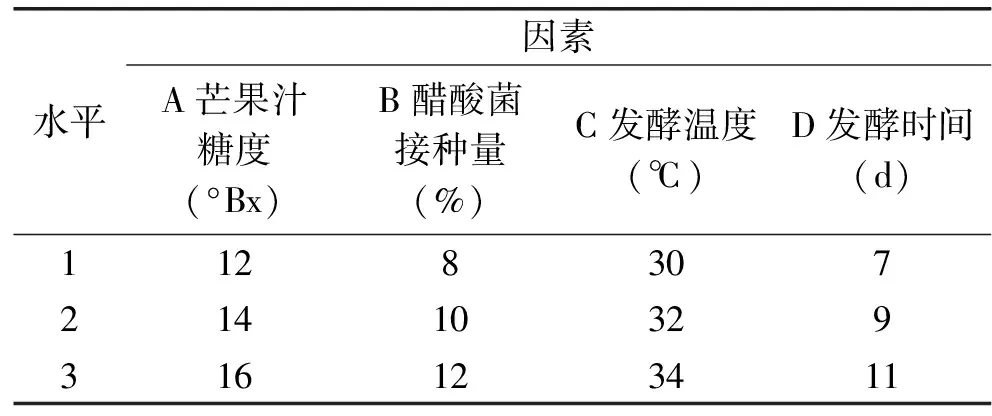
表1 正交试验因素与水平Table 1 Factors and levels of orthogonal experiment
1.2.6 芒果醋指标的测定 总糖:DNS法,准确量取适量待测液,加入DNS试剂并沸水浴5 min后定容,在520 nm处测定吸光值,以g/100 mL的葡萄糖为单位[28]。总酸:采用酸碱滴定法,准确量取适量待测样品,用80 ℃煮沸过的水在沸水浴中提取30 min后,定容并过滤,滤液用NaOH溶液滴定,以g/100 mL的乙酸为单位[29]。可溶性固形物:采用阿贝折光仪直接测定,数值表示为20 ℃时的质量分数(%)[30]。大肠菌群:依据GB 4789.3-2010中大肠菌群MPN计数法对芒果醋中大肠菌群进行计数,通过观察月桂基硫酸盐胰蛋白胨肉汤管、煌绿乳糖胆盐肉汤管产气情况来检验,以每mL检样中大肠菌群最可能数(MPN)计[31]。沙门氏菌:依据GB 4789.4-2016对芒果醋中的沙门氏菌进行检验,以每mL样品中检出或未检出沙门氏菌为结果[32]。金黄色葡萄球菌:依据GB 4789.10-2016第一法对芒果醋中金黄色葡萄球菌作定性检验,以每mL样品中检出或未检出金黄色葡萄球菌为结果[33]。
1.2.7 芒果醋感官评价方法 将在优化条件下发酵得到的芒果醋按照国家标准配制成含0.4%醋酸浓度与鲜芒果汁配制成芒果醋饮料后,以《NY/T 2987-2016 绿色食品果醋饮料》[34]标准为感官评价依据,采用9段愉悦标度[35]评价芒果醋饮料的感官属性(色泽、滋味和气味、组织状态、杂质)和整体评价;给分标准如下:1-极讨厌,2-很讨厌,3-中度讨厌,4-稍讨厌,5-既不讨厌也不喜欢,6-稍喜欢,7-中度喜欢,8-很喜欢,9-极喜欢。评价小组成员人数为50名,男女各占一半,成员通过在自然光亮处目测色泽、组织状态和杂质,嗅其气味、品尝滋味后对芒果醋的感官属性和整体评价进行赋分。
1.3 数据处理
每个试验点重复三次,结果用平均值±标准偏差来表示。实验数据采用PASW Statistics 18软件进行方差分析,多重比较采用LSD法。
2 结果与分析
2.1 单因素实验
2.1.1 芒果汁初始糖度对果醋发酵的影响 由图1可知,乙酸含量随发酵糖度的增加而呈现先增加后下降的趋势,不同芒果汁初始糖度对醋酸发酵的影响显著(P<0.05)。当初始糖度小于14° Bx时,果醋中乙酸含量随着芒果汁糖度的增加而升高;初始糖度超过14° Bx后,生成乙酸的含量反而下降。前者糖浓度低,导致酵母菌与醋酸菌得不到充足的营养进行生长繁殖与代谢,因此产乙酸量较低;后者初始糖度过高,对酵母菌的生物活性起到抑制作用,葡萄糖转化率下降,进而被醋酸菌转化成的乙酸量就少[36]。再者,由多重比较得出,14° Bx的初始糖度产酸能力较强,其乙酸含量与其它糖度的相比差异显著(P<0.05)。因此,芒果汁初始糖度为14° Bx最佳。

图1 芒果汁初始糖度对乙酸含量的影响Fig.1 Effect of the initial sugar content ofmango juice on the content of acetic acid注:不同小写字母表示差异显著(P<0.05);图2~图5同。
2.1.2 酵母菌接种量对果醋发酵的影响 由图2可知,不同酵母菌接种量对产酸含量差异显著(P<0.05)。酵母菌接种量在小于0.15%范围内,芒果醋中乙酸含量随着酵母菌接种量的增加而逐渐升高;当酵母菌接种量为0.15%(v/v)时,产乙酸含量最高,达到4.68 g/100 mL;当酵母菌接种量超过0.15%(v/v)时,乙酸含量明显下降,这是由于酵母菌快速繁殖消耗了过多的营养,从而导致菌体老化[37],同时,醋酸菌得不到足够的营养,导致生长受到抑制,产醋酸量减少。由LSD法多重比较可知,0.15%(v/v)接种量的乙酸含量显著高于其它接种量(P<0.05),因此,选择酵母菌最佳接种量为0.15%(v/v)。

图2 酵母菌接种量对乙酸含量的影响Fig.2 Effect of the inoculation quantity ofyeast on the content of acetic acid
2.1.3 醋酸菌添加量对乙酸含量的影响 醋酸菌接种量对菌体的产酸能力和发酵周期具有较大的影响。当接种量过大时,菌体快速增长以及分泌大量的代谢物,从而导致菌体提前老化而衰亡,产酸量减少[38]。醋酸菌的接种量过小,菌体生长慢,发酵周期延长[39],产酸量低。不同的醋酸菌接种量(4%~14%(v/v))对芒果醋发酵的影响见图3。由图3可知,不同醋酸菌接种量对醋酸发酵的影响明显。当接种量为10%(v/v)时,乙酸含量最高,当接种量超过10%时,产乙酸含量迅速下降。由LSD法多重比较可知,10%醋酸菌接种量产酸显著高于其它接种量(P<0.05),因此,选择醋酸菌接种量为10%。
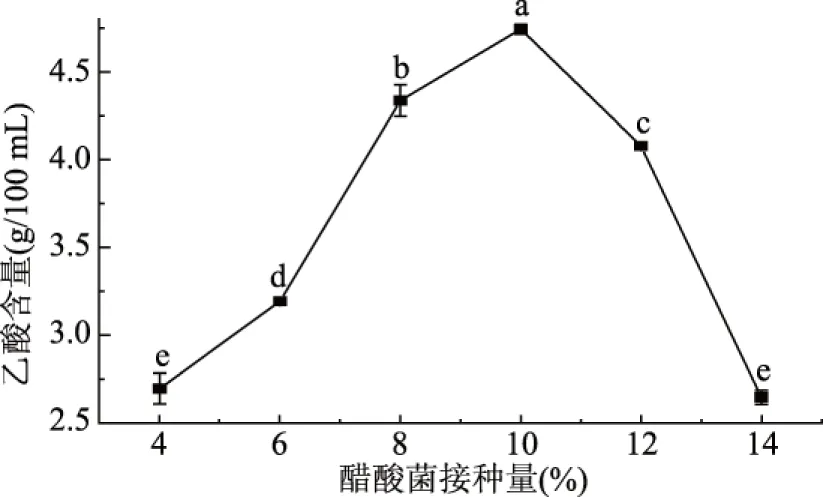
图3 醋酸菌接种量对乙酸含量的影响Fig.3 Effect of the inoculation quantity ofacetic acid bacteria on the content of acetic acid
2.1.4 发酵温度对果醋发酵的影响 由图4可以看出,不同发酵温度对醋酸发酵的影响显著(P<0.05)。醋酸含量随着发酵温度的升高呈现先上升后下降的趋势,当发酵温度为32 ℃,芒果醋中乙酸含量最高,为4.66 g/100 mL;发酵温度高于32 ℃,加快菌体老化,菌体内酶系活性降低,反而会导致果醋中乙酸含量下降。此外,高温(36 ℃)对菌体酶系活性破坏比低温(26 ℃)抑制菌体活性还要大,因此36 ℃下产酸量比26 ℃的产酸量减少了8.72%。由LSD法多重比较可知,32 ℃下产酸显著高于其它温度(P<0.05),因此,选择芒果醋醋酸发酵的发酵温度为32 ℃。

图4 发酵温度对乙酸含量的影响Fig.4 Effect of the fermentation temperature on the content of acetic acid
2.1.5 发酵时间对果醋发酵的影响 由图5可以看出,在发酵过程中,产酸量随着发酵周期的延长呈先增加后缓慢下降趋势,不同发酵时间对乙酸含量的影响明显。在9 d时,发酵液中的乙酸含量最高,继续延长芒果醋的发酵时间,产酸量反而下降。可能的原因是当乙醇被醋酸菌完全消耗后,醋酸菌又将部分乙酸降解为H2O和CO2,发生过氧化现象[40]。由LSD法多重比较可知,发酵到第9 d时的产酸量虽然和第10 d的产酸量差异不显著(P>0.05),但显著高于其他发酵时间(P<0.05),考虑时间成本、低耗能等因素,选择发酵9 d为最合适的发酵时间。

图5 发酵时间对乙酸含量的影响Fig.5 Effect of the fermentation time on the content of acetic acid
2.2 芒果醋发酵正交试验结果分析
按照表1选取的因素和水平,进行正交试验,结果见表2。由表2中极差分析可知,各因素对芒果汁发酵液中乙酸含量的影响主次顺序为:B(醋酸菌接种量)>D(发酵时间)>C(发酵温度)>A(芒果汁糖度);其中芒果醋发酵的最优方案为A2B3C2D2,即:芒果汁发酵初始糖度为14 °Bx,醋酸菌加入量为12%(v/v),芒果醋发酵温度为32 ℃,发酵周期为9 d。对正交实验结果做主效应的方差分析,结果见表3。由表3可知,根据混菌发酵芒果醋的四个因素的均方大小来判断主次因素为B>D>C>A,与极差分析结果一致;四个因素对醋酸发酵的影响极显著(P<0.01)。
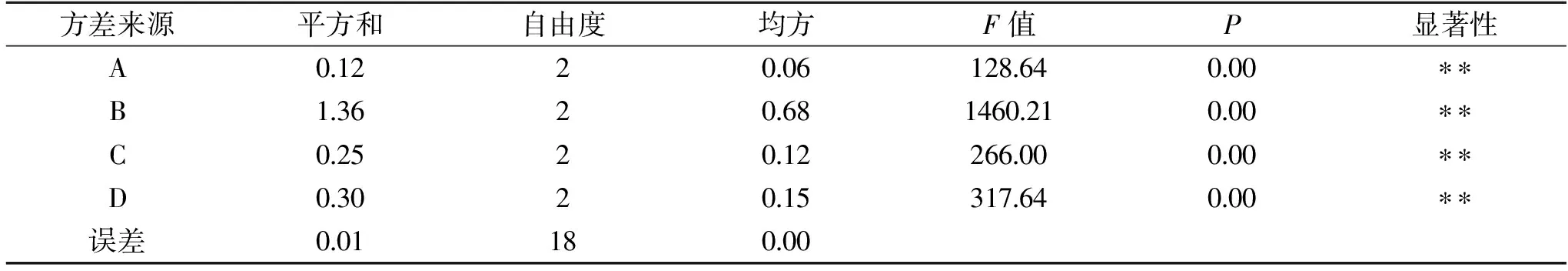
表3 方差分析Table 3 Variance analysis
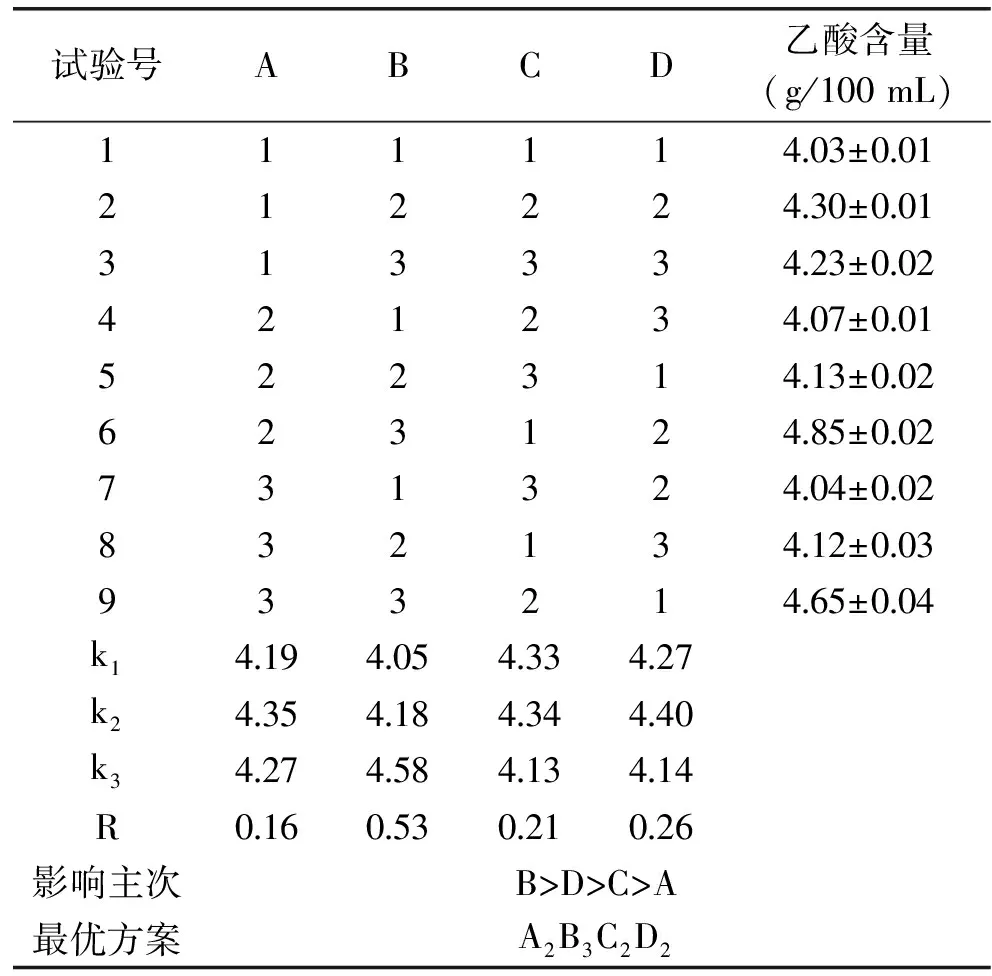
表2 正交试验结果Table 2 Results of orthogonal experiment
2.3 验证实验
经极差分析和正交分析,得出最佳组合为A2B3C2D2,但不在正交试验表中,因此需要进行验证实验。将A2B3C1D2和A2B3C2D2两个方案分别进行3次重复试验,结果:A2B3C2D2工艺产乙酸含量(4.93±0.02) g/100 mL,比A2B3C1D2工艺的产酸量高1.65%,对两个组合的结果进行方差分析,结果显示A2B3C2D2工艺产乙酸含量显著高于A2B3C1D2工艺的产酸量(P<0.01)。因此,选择发酵条件的最佳组合为A2B3C2D2,即芒果汁糖度为14 °Bx、醋酸菌接种量为12%(v/v),在32 ℃恒温振荡器中发酵9 d,产酸量达到4.93 g/100 mL。
2.4 芒果醋及其饮料的质量指标
2.4.1 感官指标 芒果醋感官评价主要从芒果醋色泽、风味(滋味和气味)、组织状态和杂质等方面评分,从图6可以看出,就色泽而言,成品芒果醋饮料色泽金黄、澄清透明、有光泽,视觉感官让人十分愉悦,分值为7.8分。从风味来看,芒果醋饮料香气明显,有伴有芒果清香,醋饮料味酸,滋味丰富,有层次感,爽口,分值为7.9分。对于饮料的组织状态来说,醋饮料清澈,较均匀细腻,无分层,无凝块,分值为6.8分。在正常视力下,芒果醋饮料中无可见外来杂质,分值最高,为9分。综合色泽、滋味和气味、组织状态和杂质等感官属性的整体评价为8.0分。
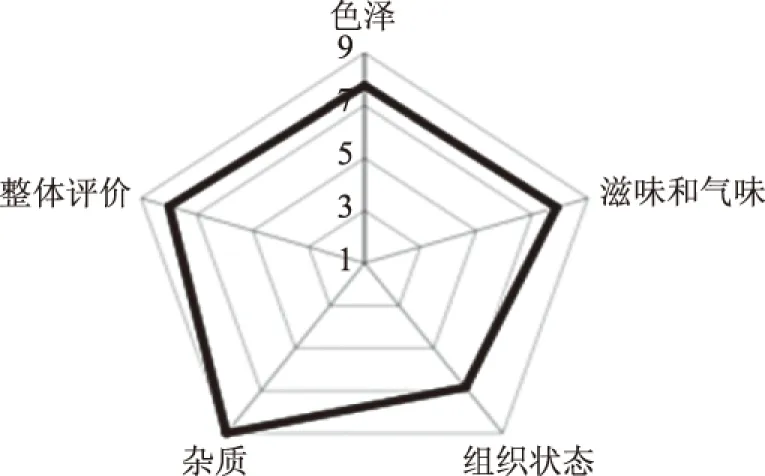
图6 芒果醋饮料的感官评价Fig.6 Sensory evaluation of mango vinegar drink
2.4.2 微生物和理化指标测定 关于所得芒果醋的卫生指标和理化指标见表4和表5。由这两个表可以看出,所得芒果醋的卫生指标和理化指标都达到了《NY/T 2987-2016 绿色食品果醋饮料》的标准。

表4 芒果醋的微生物指标Table 4 Microbe of mango vinegar

表5 芒果醋的理化指标Table 5 Physicochemical indexes of mango vinegar
3 结论
采用酵母菌醋酸菌混菌发酵芒果汁生产芒果醋的优化条件如下:酵母菌添加量为0.15%(v/v),芒果汁初始糖度为14 °Bx,醋酸菌接种量为12%(v/v),在32 ℃、130 r/min的恒温摇瓶柜培养9 d,芒果醋中乙酸含量达到4.93 g/100 mL。发酵完成后对芒果醋进行离心澄清,经过陈酿后可得到色泽均匀、金黄,无悬浮物,酸味柔和不刺激,具有芒果独特的香味和醋香,卫生和理化指标均符合发酵果醋的国家标准要求。将果醋按国家标准配制成芒果醋饮料后,采用9段愉悦评分法进行的感官评定结果表明,芒果醋饮料具有很好的消费者可接受性。所发展出来的新的芒果醋加工方法,能生产出新型的营养保健型果醋及其饮料,具有广阔的开发价值。
