Rapidplan优化模块在宫颈癌容积调强计划中的可行性应用研究
2020-05-20
1.湖南省肿瘤医院 中南大学湘雅医学院附属肿瘤医院 放射物理技术部,湖南 长沙 410013;2.中南大学湘雅三医院,湖南 长沙 410013
引言
计划设计是整个放射治疗的核心,其目的在于利用治疗计划系统模拟射线照射时患者体内的剂量分布,来预测和评估患者实际治疗中的情况。在传统的计划设计过程中,计划的质量往往依赖于计划设计者的经验和技巧,不同地域、不同年资的物理师计划质量存在差异性;而且传统计划设计的过程是一个反复优化迭代的过程,设计过程非常耗时。由此,自动计划应运而生。近年来,随着现代放射治疗计划系统的快速发展,自动计划已成为放疗界研究的热点[1-3],具有代表性的有美国瓦里安公司Eclipse计划系统的Rapidplan以及飞利浦公司Pinnacle计划系统的Autoplan。
瓦里安Eclipse V13.6计划系统的Rapidplan模块是一种基于先验知识的机器学习方法,它通过提取分析模型库中靶区和危及器官(Organ at Risk,OAR)的空间位置信息以及剂量分布信息,能够很好地预测放疗计划。经国外的临床验证表明,该模块在头颈[4]、肺[5]、食管[6]、乳腺[7]、肝[8]、前列腺[9]等部位已得到初步应用,并能得到比传统人工计划更佳的计划方案。本研究利用Rapidplan优化模块建立宫颈癌容积调强计划(Volumetric Modulated Arc Therapy,VMAT)模型,并利用该模型对另外12例宫颈癌计划进行测试,比较经Rapidplan优化模块的自动计划和人工计划间的剂量学差异,依此来评价Rapidplan优化模块在宫颈癌放射治疗应用中的可行性和潜在优势。
1 材料与方法
1.1 模型库的创建与病例选择
Rapidplan是Eclipse计划系统一个基于先验知识的优化模块,需要通过计划数据库来建立和训练剂量体积直方图(Dose Volume Histogram,DVH)预测模型。模型库的具体创建流程是:首先,在模块中创建一个新的模型,对其进行模型描述、临床描述、适用范围、添加结构等信息的填写;然后,从湖南省肿瘤医院患者数据库中选取50例于2017年1月至2019年9月期间经临床验证并已执行的宫颈癌VMAT计划,将其一一输入到该模型中。所有患者病例均为宫颈癌术后放疗,具有相同的勾画标准、处方和照射方式:靶区勾画标准以ICRU-52[10]、ICRU-62[11]号报告为依据,肿瘤计划靶区(Planning Target Volume,PTV)给予4500 cGy/25 f照射,OAR的保护目标在保证靶区适形度和均匀性指数不超过2%的前提下,尽可能地低(脊髓最大剂量Dmax≤40 Gy;小肠Dmax≤47 Gy,V30<40%,V40<30%;乙状结肠Dmax≤47 Gy,V45<50%;直肠Dmax≤ 47 Gy,V45<60% ;膀胱V40<50% ;股骨头V40<5% ;肾脏Dmean<11Gy,V20<20%[12-14])。所有计划均采用瓦里安Eclipse V13.6计划系统制作VMAT计划(2~3弧),瓦里安Trilogy直线加速器数据,6 MV光子,AEB剂量体积算法。
1.2 模型库的训练及统计学分析处理
模型库的训练是基于病例的OAR和靶区的空间位置关系以及剂量分布。在建立和训练DVH预测模型时,每个OAR根据与靶区之间的空间位置关系会被分割成射野外、叶片漏射区、射野内、射野内和靶区重合等不同区域。通过提取和计算这些不同区域的体积、DVH、几何预期剂量来建立各个OAR的预测模型。模型训练后,通过查看各个OAR、靶区的模型分析报告以及一些统计学图表(回归曲线、残差表曲线)对模型库进行质量评估,对统计曲线中出现的几何、剂量异常值和拟合强影响点进行严重程度、原因分析及处理。Rapidplan模型库统计学分析处理步骤,见图1。其中,几何异常值、剂量异常值和拟合强影响点分别可以通过改进的Z值(modified Z-Score,mZ)、学生化残差值(Studentized Residual Value,SR)和库克距离(Cook’s Distance,CD)是否超过阈值来分析判断。几何异常值产生的原因可能有:靶区或OAR形状,体积是否明显异于其它患者,膀胱充盈程度是否相差较大等;剂量异常值产生的原因可能有:对OAR的限制是否太严或太松,临床要求是否与其它病例相差较大等。在对模型库中的离群值综合分析和处理后,需要对模型库进行再训练,以期达到一个各OAR拟合优度较高的模型,将修改后的模型库作为后续研究的基础。
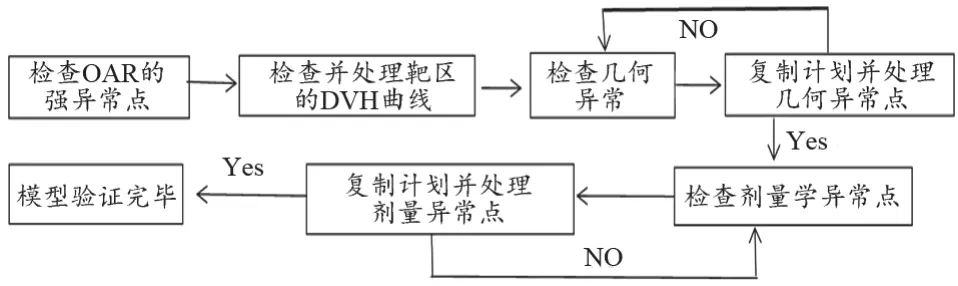
图1 Rapidplan模型库统计学分析处理流程图
1.3 Rapidplan计划模型库的验证测试设计
在湖南省肿瘤医院患者病例库中,另外选取12例宫颈癌测试病例。测试病例与模型库中的靶区勾画要求、处方一致。采用瓦里安公司的Eclipse V13.6计划系统分别为这12例测试病例设计两组计划:一组是已完成临床验证的VMAT计划(Clinical-plan);一组是经Rapidplan优化模块的自动计划(Rapid-plan)。两组计划具有相同的布野条件(2~3个弧)、能量(6 MV光子)、加速器数据、处方(45 Gy/25 f)和优化算法(AEB算法)。
1.4 评估指标
(1)靶区评估指标。适形度指标(Conformity Index,CI)采用公式 CI=(VPTV95%/VPTV)×(VPTV95%/V95%)[15],其中VPTV95%表示95%等剂量线所覆盖的PTV总体积,VPTV表示PTV的总体积,V95%表示95%等剂量线所覆盖的总体积。CI的取值范围在0~1之内,CI越接近于1表示靶区的适形度越好。均匀性指数(Homogeneity Index,HI)采用公式HI=D5/D95,其中D5、D95分别表示5%、95%的PTV体积受照的剂量。HI越大,表示靶区内的剂量分布越不均匀。
(2)OAR的评估指标。脊髓:最大剂量(Dmax)、平均剂量(Dmean);小肠:Dmean、接受10 Gy及以上的体积占小肠总体积的百分数(V10)、V20、V30、V40;直肠:Dmean、V10、V20、V30、V40;膀胱 :Dmean、V10、V20、V30、V40;肾脏 :Dmean、V5、V10、V20;股骨头 :Dmean、V5、V10、V20;乙状结肠 :Dmean、V10、V20、V30、V40。
(3)两组计划的优化效率。比较两组计划在优化过程中所需要的时间。
(4)两组计划的执行效率。比较两组计划的机器总跳数(Monitor Unit,MU)。
1.5 数据处理
(1)平均DVH图。将每个测试病例的两组计划从Eclipse传至MIM,并利用MIM软件将每个病例的DVH数据导出,采用ORIGIN 2017作图软件绘制平均DVH图。
(2)统计学处理。采用SPSS 22.0统计软件,对两组数据采用配对t检验的方法进行统计分析。结果用x-±s来描述,P<0.05表示具有统计学差异。
(3)图像处理。采用ORIGIN 2017作图软件,分析比较两组计划对OAR的剂量偏差。
2 结果
2.1 平均DVH图比较
图2显示了12组测试病例Rapid-plan组和Clinicalplan组的平均DVH图,图3显示了其中1例患者的Clinical-plan和Rapid-plan放疗剂量分布图。结果显示,与Clinical-plan组相比,Rapid-plan组的PTV剂量-体积曲线跌落更陡直,小肠、直肠等OAR的受量也明显更低。

图2 Rapid-plan组和Clinical-plan组的平均DVH图对比
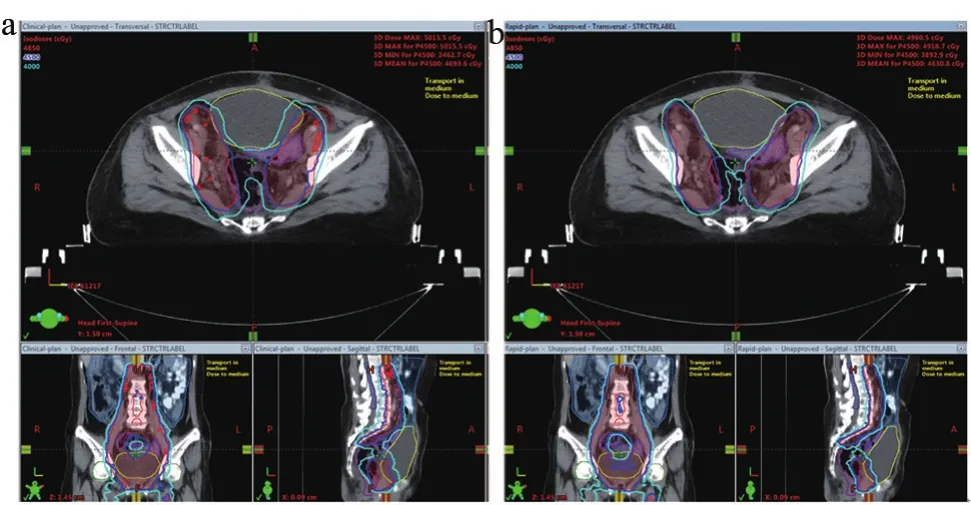
图3 Clinical-plan和Rapid-plan的层面剂量分布比较
2.2 靶区的剂量学参数比较
Clinical-plan组和Rapid-plan组均能满足临床剂量学要求,两组不同计划的PTV剂量学参数,见表1。从表1中得知,Clinical-plan组和Rapid-plan组的CI分别为0.7927±0.6686和 0.8275±0.03788,HI分别为1.0597±0.01058和1.0459±0.0079。与Clinical-plan组相比,Rapid-plan组在靶区的HI和CI上均有所提高,且差异具有统计学意义(P<0.05)。
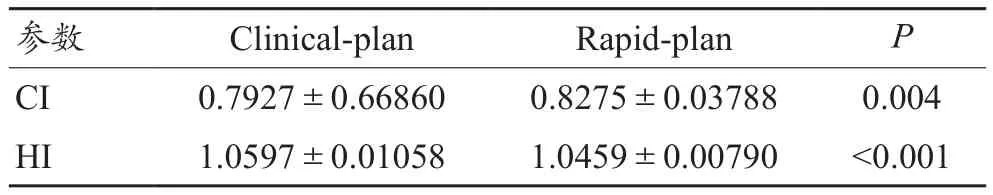
表1 宫颈癌Clinical-plan组和Rapid-plan组的PTV剂量学比较
2.3 OAR的剂量学比较
通过对两组计划进行统计学分析,可以得出:与Clinical-plan组相比,Rapid-plan组各OAR(小肠、直肠、乙状结肠、股骨头)的V20、V30、V40显著降低,差异有统计学意义(P<0.05);对于V10,Rapid-plan组也有一定的程度的降低,但是两组计划差异并无统计学意义(P>0.05);在平均剂量上,Rapid-plan组同样表现出优势,差异具有统计学意义(P<0.05);对于串行器官脊髓,Rapid-plan组最高剂量点Dmax显著降低,差异具有统计学意义(P<0.05);对于肾脏,两组计划在V5、V10和平均剂量的差异均无统计学意义(P>0.05)。但是对于V20,左肾没有表现出统计学上的差异(P>0.05),而右肾表现出明显的统计学差异(P<0.05)。分析其原因,样本中靶区和右肾重叠部分较少,和左肾重叠部分较多,Clinical-plan予以相同的剂量限制时,对左肾而言约束条件显得相对更为严苛,在制作Rapidplan计划时左肾已无更多可调空间,所以没有统计学差异;而右肾的约束条件则显得相对较为宽松,还有改善的空间,显示出了统计学差异。两组计划OAR的剂量学比较,见表2。为了更清晰地描述两组计划的差异,本研究利用ORIGIN 2017软件绘制了不同OAR的剂量-体积图,见图4。
2.4 两组计划的优化效率比较
在使用Rapidplan优化模块过程中,Rapid-plan的结果也不是全自动的,其优化过程往往需要手动调整靶区的权重和参数,仍然需要第2次甚至多次的微调,但优化的时间相对于Clinical-plan还是有了大幅度降低。Clinical-plan组和Rapid-plan组在进行宫颈癌VMAT优化过程中所使用的平均时间分别为(607.5±52.9)s和(537.9±70.8)s。虽然Rapid-plan并非“全自动”,但是使用Rapidplan模块优化所使用的时间远远低于Clinical-plan,两者差异为11.45%,且差异具有统计学意义(P<0.05)。
2.5 两组计划的执行效率
计划的执行效率通常取决于计划各个野的MU总和(即总MU数)。在临床上,总MU数越低,计划执行的效率也就越高,患者治疗所需的治疗时间也就越短,这在一定程度上能改善患者的治疗舒适度。表3展示了两组计划的平均总MU数,结果显示Rapid-plan组的MU值和Clinical-plan组的平均总MU数分别为586 MU和524 MU,两组计划相差62 MU,差值达到10.58%,且差异具有统计学差异(P<0.05)。

表2 宫颈癌Clinical-plan组和Rapid-plan组OAR的剂量学比较
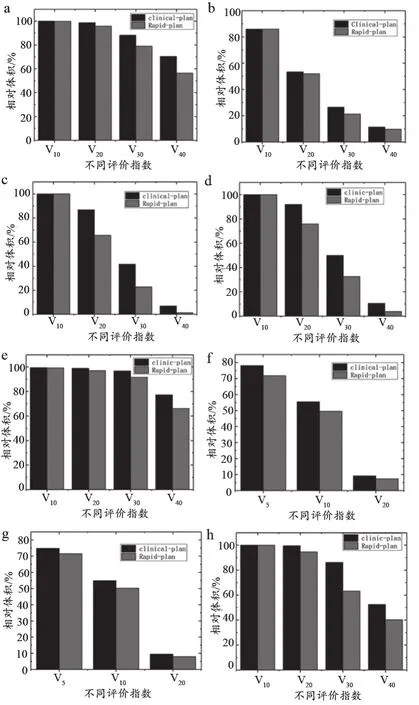
图4 Clinical-plan和Rapid-plan各OAR的剂量-体积差异图

表3 Clinical-plan组和Rapid-plan组计划MU比较
3 讨论
分析结果中的数据可以发现:在计划质量方面,对于宫颈癌VMAT计划,Rapid-plan相较于Clinical-plan无论在提高靶区剂量分布HI和CI方面,还是降低OAR受量方面,都有了明显的改善;在计划效率方面,Rapid-plan的优化时间更短。其产生差异的根本原因在于Rapidplan是一种基于解剖结构和先验知识的人工智能方法。在使用Rapidplan模块进行计划制作时,模块一方面可以为每个OAR提供了一个预测区间供物理师参考;另一方面,使用Rapidplan自动计划生成的Line函数进行优化时,OAR的剂量是按照预测区间的整个下限线进行优化。两个方面的优势不仅可以有效地避免人工优化过程由于主观性导致的欠优计划,在优化过程中帮助物理师在制作过程中快速修改;而且对于每个OAR而言,优化的目标参数也从常规的点扩大到了线,可以达到尽可能低的限值,从而获得了比常规临床计划更佳的剂量分布,也提高了计划制作的效率。
尽管基于先验知识的Rapidplan模块能够高效地制作出高质量的计划,但这个模块应用的关键还是在于模型库的质量。而模型库的质量很大程度上决定于模型库计划的质量和计划数[15-19]。Wang等[17]研究了模型库计划的质量对盆腔VMAT计划Rapidplan预测模型的影响,研究选取了81例临床计划作为初始模型库,再利用初始模型库重新预测这81例临床计划,得到75例更优计划以及6例无改善计划将其作为进化模型库,研究得出提高模型库计划的质量可以改善模型的预测能力。Li等[18]研究了数据库大小对直肠癌VMAT计划预测模型的影响,样本选取了30例、60例、90例计划对预测模型进行质量评估,但结果表明数据库大小并没有明显影响,其原因是少数离群值可能被大量的训练病例所“稀释”。所以,在使用Rapidplan模块时为了准确的达到剂量预测的目的,应注重对模型库的病例的挑选和筛选。
综上所述,使用基于靶区、OAR位置关系和先验知识的Rapidplan优化模块,能够高效高质地完成宫颈癌VMAT计划,并且可以达到比临床要求更佳的剂量分布。因此,在使用瓦里安Eclipse计划系统时推荐使用Rapidplan模块进行宫颈癌的计划制作,但使用时应注重挑选优质的计划用于模型库的建立。
