黑果腺肋花楸组培快繁技术研究
2020-05-20张成霞袁季平独居想纪晓晓
刘 行, 夏 群, 张成霞, 居 涛, 王 瑞, 袁季平,独居想, 陈 丽, 纪晓晓
(1.江苏农牧科技职业学院 园林园艺学院, 江苏 泰州 225300;2.河北农业大学 园林与旅游学院, 河北 保定 071000)
黑果腺肋花楸(AroniamelanocarpaElliot)为蔷薇科腺肋花楸属落叶小灌木,树型优美,叶色多变,复伞房花序,花期20 d,暗红色浆果,可冬季宿存于树上,且富含抗氧化物质,具有医药价值,另外,果实可加工成果酱、果汁等口味独特的食品,是可四季观赏兼药用食用价值的珍贵树种[1-3]。在欧美地区,花楸属植物在园林绿化中应用较广泛,且对其药用食用功效也有所研究[4],但在我国主要集中于其药用价值方面的研究,而园林中花楸属植物应用较少,繁殖方面的研究更少。
黑果腺肋花楸的种子具有深休眠性,且收集和处理难,耗时长,因而有性繁殖较困难[5];其枝条木质化程度高,生根困难,扦插成活率偏低,且受季节与环境的影响,扦插繁殖困难,且对扦插繁殖条件要求高,成本增加[6-9];而组织培养繁殖方式,繁殖系数高,苗木繁育速度快,可在短时间内解决市场苗木短缺问题。为提高组织培养繁殖系数,选用黑果腺肋花楸嫩芽为外植体,以影响黑果腺肋花楸增殖生长、生根培养、移栽驯化的因素为研究对象,以期筛选出最适宜的离体再生体系,为黑果腺肋花楸实现规模化生产提供依据。
1 材料与方法
1.1 试验材料
试验材料来源于江苏农牧科技职业学院中药科技园引种栽培的黑果腺肋花楸。选取当年生嫩芽作为组培外植体,并用流水冲洗干净。冲洗后的嫩芽在超净工作台内用75%酒精分别浸泡40 min,无菌水冲洗3次,再用2%的次氯酸钠(NaClO)浸泡12 min,浸泡过程中不断搅动,使外植体与NaClO充分接触。再用无菌水冲洗5次(以上操作环节动作要迅速),之后接种于MS+1.0 mg·L-1BA(6-苄氨基腺嘌呤)+0.5 mg·L-1NAA(a-萘乙酸)+30 g·L-1蔗糖+0.5 g·L-1活性炭+7 g·L-1琼脂(pH 5.8)的培养基上。培养温度(25±2)℃,相对湿度70%,光照1 600 lx,每天光照16 h。
1.2 试验方法
1.2.1黑果腺肋花楸组培苗增殖培养的筛选
无菌条件下,将组培苗切取1 cm长茎段转接于MS+30 g·L-1蔗糖+0.5 g·L-1活性炭+7 g·L-1琼脂的培养基,6-BA浓度设置为0.1、0.5、1.0、1.5、2.0 mg·L-1,NAA浓度设置为0.1、0.2、0.3、0.4、0.5 mg·L-1,进行2因素5水平的正交试验,培养温度(25±2)℃,相对湿度70%,光照1 600 lx,每天光照16 h。每个处理50个外植体,3次重复,其它培养条件与方法35 d后观察组培苗增值及生长情况。
增殖系数=增殖的苗数/接入的茎段数。

图1 黑果腺肋花楸无菌苗
1.2.2黑果腺肋花楸组培苗生根培养基的筛选
试验设计MS培养基浓度、NAA浓度对黑果腺肋花楸生根的影响。将黑果腺肋花楸组培苗在无菌条件下切成1.5 cm左右,分别接种于不同处理的培养基上,MS培养基浓度设置为1/4 MS、1/2 MS、3/4 MS、MS,NAA浓度为0.2、0.4、0.6、0.8、1.0 mg·L-1,进行正交试验,每瓶接入5个茎段,每处理重复3次,40 d后调查鲜重、干重、株高、根长、根数、生根率等情况。其它培养条件同试验1.2.1。
生根率(%)=(生根植株数/接入的茎段数)×100%。
1.2.3黑果腺肋花楸组培苗驯化的移栽基质的筛选
当黑果腺肋花楸组培苗长出正常短根(≤1 cm)时,即可出瓶驯化。将组培苗开盖,喷雾处理7 d后,移栽于50穴黑色育苗盘(54 cm×28 cm×4.8 cm,上口径4.8 cm,下口径2.3 cm),选用不同基质配比进行组培苗的驯化(如表1),观察植株生长状况,调查成活率及生长状况。用透明塑料布覆盖育苗盘表面,并每天喷雾3~5次,以保持湿度达85%以上。在中午光照强烈的情况下,采用遮阳网遮荫。3 d后逐步撤去塑料布,30 d后移栽到营养钵中并移至室外条件进行养护,逐步撤去遮阳网,观察并记录植株的生长状况与成活率。
成活率(%)=(成活植株数/移栽植株数)×100%。
表1 黑果腺肋花楸组培苗驯化移栽基质筛选试验设计
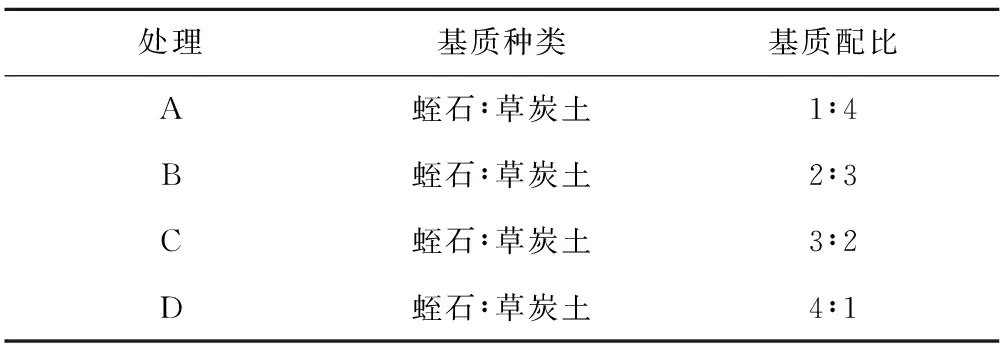
处理基质种类基质配比A蛭石∶草炭土1∶4B蛭石∶草炭土2∶3C蛭石∶草炭土3∶2D蛭石∶草炭土4∶1
1.3 数据分析方法
数据处理和图表制作应用Excel软件,方差分析采用SPSS 13.0软件(p=0.05)。
2 结果与分析
2.1 NAA与6-BA不同浓度配比对黑果腺肋花楸增殖的影响
2.1.16-BA不同浓度配比对黑果腺肋花楸增殖的影响
从表2可看出,在同一NAA浓度下,6-BA浓度在0.1~2.0 mg·L-1范围内,随6-BA浓度增加,组培苗的增殖系数增加,当6-BA浓度为1.0 mg·L-1时,达到最大值,显著高于其他处理,且植株的鲜重、干重、株高均显著高于6-BA浓度为0.1 mg·L-1时,植株长势强,叶片伸展。随6-BA浓度增加至浓度1.5 mg·L-1、2.0 mg·L-1时,增殖系数逐渐下降,植株玻璃化现象逐步严重,植株矮小,长势弱。综合比较,黑果腺肋花楸增殖生长最适宜的6-BA浓度为1.0 mg·L-1。
表2 6-BA浓度对黑果腺肋花楸增殖的影响
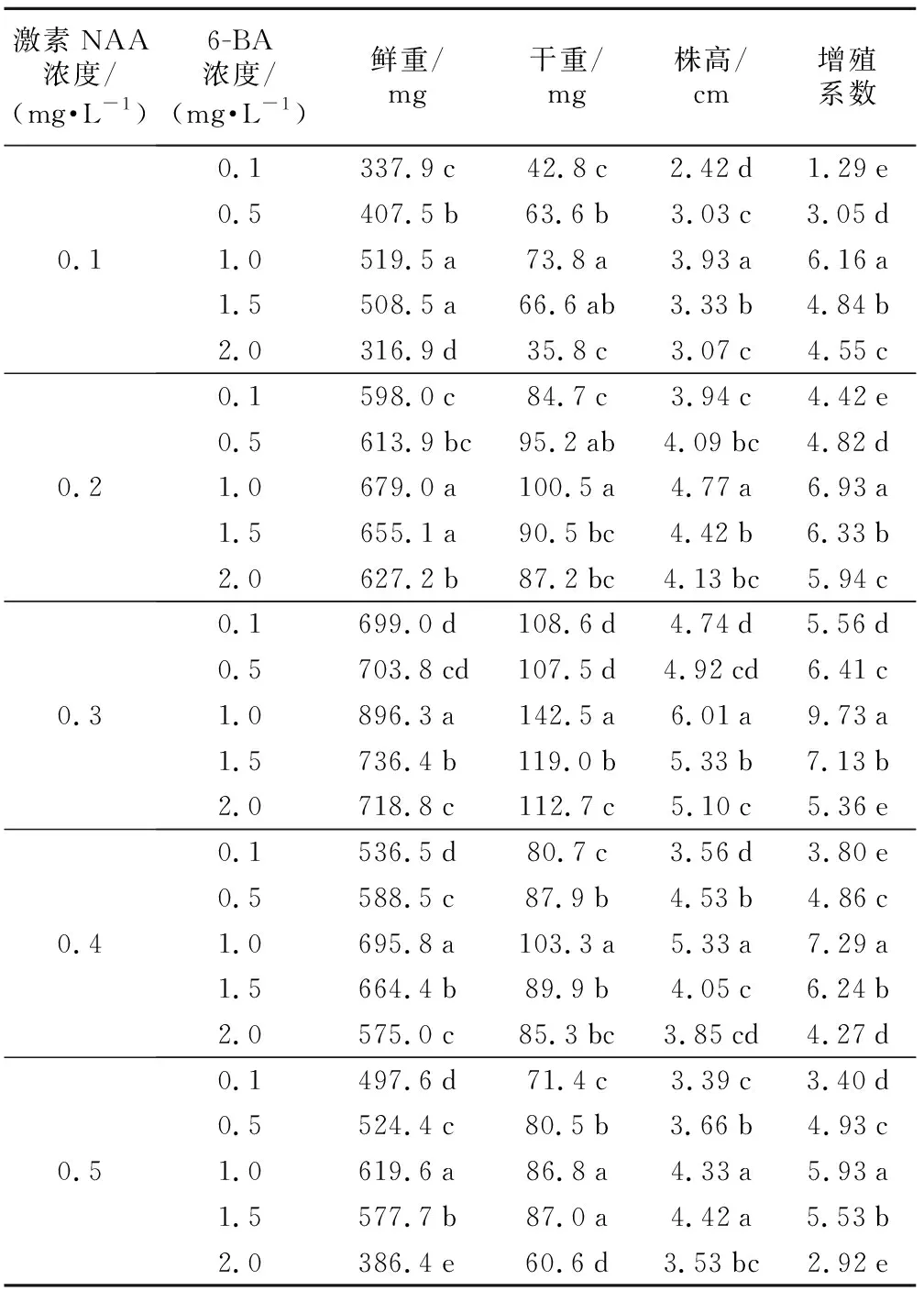
激素NAA浓度/(mg·L-1)6-BA浓度/(mg·L-1)鲜重/mg干重/mg株高/cm增殖系数0.10.1337.9c42.8c2.42d 1.29e0.5407.5b63.6b3.03c3.05d1.0519.5a73.8a3.93a6.16a1.5508.5a66.6ab3.33b 4.84b2.0316.9d35.8c3.07c4.55c0.20.1598.0c84.7c3.94c4.42e0.5613.9bc95.2ab4.09bc4.82d1.0679.0a100.5a4.77a6.93a1.5655.1a90.5bc4.42b6.33b2.0627.2b87.2bc4.13bc5.94c0.30.1699.0d108.6d4.74d5.56d 0.5703.8cd107.5d4.92cd6.41c 1.0896.3a142.5a6.01a9.73a1.5736.4b119.0b5.33b7.13b2.0718.8c112.7c5.10c5.36e0.40.1536.5d80.7c3.56d3.80e 0.5588.5c87.9b4.53b4.86c 1.0695.8a103.3a5.33a 7.29a 1.5664.4b89.9b4.05c6.24b 2.0575.0c85.3bc3.85cd4.27d 0.50.1497.6d71.4c3.39c3.40d 0.5524.4c80.5b3.66b4.93c 1.0619.6a86.8a4.33a5.93a1.5577.7b87.0a4.42a5.53b 2.0386.4e60.6d3.53bc2.92e
注:结果为3次重复平均值,用不同字母标记的数字在p=0.05水平差异显著,以a,b,c……表示不同6-BA浓度间的差异。下同。

图2 黑果腺肋花楸无菌苗接种
表4 NAA浓度对黑果腺肋花楸生根的影响
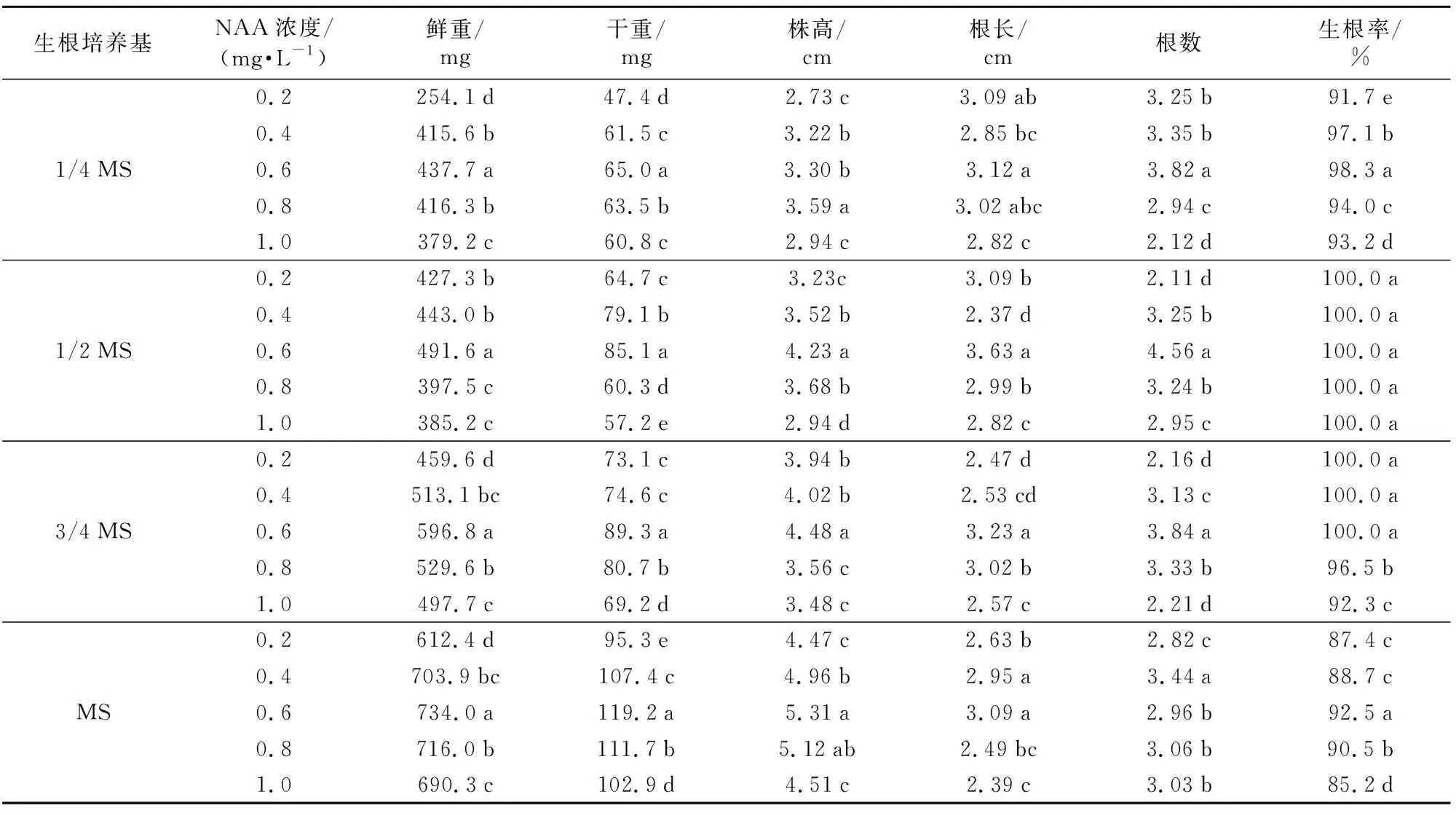
生根培养基NAA浓度/(mg·L-1)鲜重/mg干重/mg株高/cm根长/cm根数生根率/%0.2254.1d47.4d2.73c3.09ab3.25b 91.7e 0.4415.6b61.5c3.22b2.85bc 3.35b 97.1b 1/4MS0.6437.7a65.0a3.30b3.12a3.82a98.3a0.8416.3b63.5b3.59a3.02abc2.94c94.0c 1.0379.2c60.8c2.94c2.82c2.12d93.2d 0.2427.3b64.7c3.23c3.09b2.11d100.0a0.4443.0b79.1b 3.52b2.37d3.25b100.0a1/2MS0.6491.6a85.1a4.23a3.63a4.56a100.0a0.8397.5c60.3d 3.68b2.99b3.24b100.0a1.0385.2c57.2e2.94d2.82c2.95c100.0a0.2459.6d73.1c3.94b2.47d 2.16d100.0a0.4513.1bc74.6c4.02b2.53cd 3.13c100.0a3/4MS0.6596.8a89.3a 4.48a3.23a3.84a100.0a0.8529.6b80.7b3.56c3.02b3.33b96.5b 1.0497.7c69.2d3.48c2.57c2.21d92.3c0.2612.4d95.3e4.47c 2.63b2.82c87.4c 0.4703.9bc107.4c4.96b2.95a3.44a88.7c MS0.6734.0a119.2a5.31a3.09a2.96b92.5a0.8716.0b111.7b5.12ab2.49bc 3.06b90.5b 1.0690.3c102.9d4.51c2.39c3.03b85.2d
2.1.2NAA不同浓度配比对黑果腺肋花楸增殖的影响
设定6-BA浓度为1.0 mg·L-1的基础上,选用NAA不同浓度配比。如表3所示,随NAA浓度的增加,增殖系数为增加趋势,于NAA浓度为0.3 mg·L-1时,增殖系数达到最大值,为9.73,显著高于其他处理,且植株鲜重为896.3 mg,干重为142.5 mg,株高为6.01 cm,植株生长旺盛,叶片舒展,显著高于其他处理。NAA浓度继续增加,为0.4 mg·L-1时,愈伤组织出现于植株近根部,植株长势较弱,且增殖系数下降为7.29。NAA浓度增加至0.5 mg·L-1时,茎基部愈伤组织呈坚硬的片状,增殖系数也降低至5.93。因而适宜黑果腺肋花楸增殖生长的NAA浓度为0.3 mg·L-1。总体来说,0.3 mg·L-1NAA+1.0 mg·L-16-BA的激素浓度配比更有利于黑果腺肋花楸的增殖生长。
表3 NAA浓度对黑果腺肋花楸增殖的影响
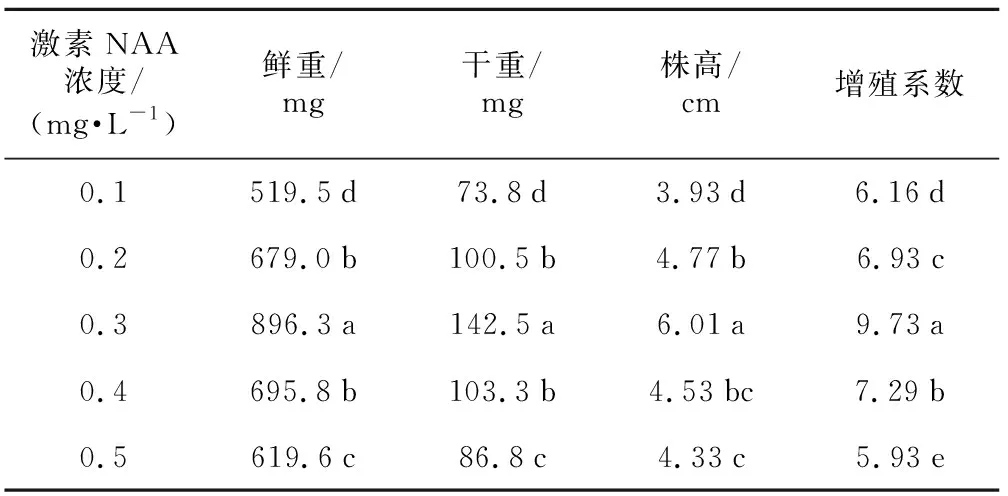
激素NAA浓度/(mg·L-1)鲜重/mg干重/mg株高/cm增殖系数0.1519.5d73.8d3.93d6.16d0.2679.0b100.5b4.77b 6.93c 0.3896.3a142.5a6.01a9.73a 0.4695.8b103.3b4.53bc 7.29b 0.5619.6c86.8c4.33c 5.93e
表6 黑果腺肋花楸组培苗驯化移栽基质筛选试验设计
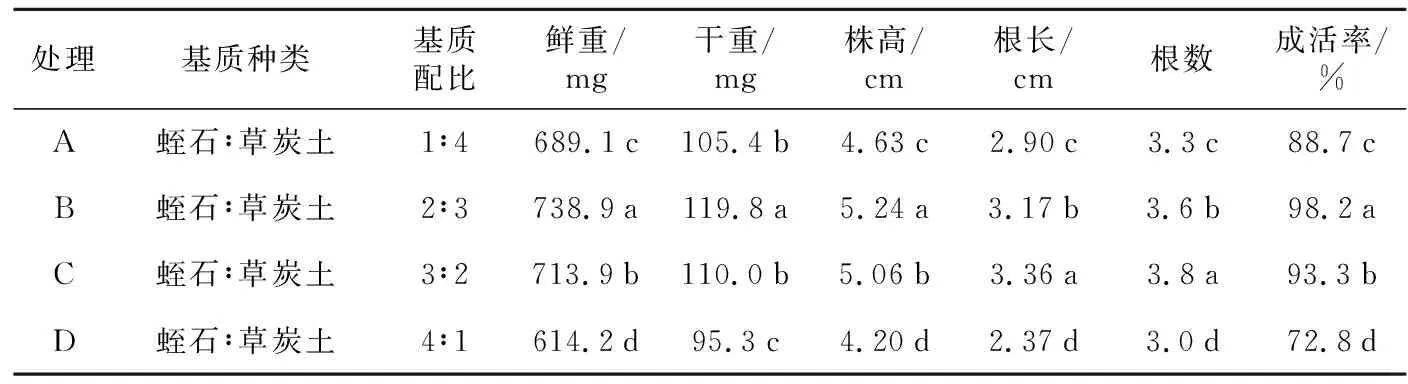
处理基质种类基质配比鲜重/mg干重/mg株高/cm根长/cm根数成活率/%A蛭石∶草炭土1∶4689.1c 105.4b 4.63c2.90c3.3c88.7cB蛭石∶草炭土2∶3738.9a 119.8a5.24a3.17b3.6b98.2aC蛭石∶草炭土3∶2713.9b110.0b5.06b3.36a3.8a93.3bD蛭石∶草炭土4∶1614.2d95.3c4.20d2.37d3.0d72.8d

图3 黑果腺肋花楸芽的增殖生长

图4 黑果腺肋花楸的生根
2.2 黑果腺肋花楸组培苗生根培养基的筛选
2.2.1NAA浓度对黑果腺肋花楸组培苗生根的影响
在一定MS培养基浓度下,NAA浓度有利于黑果腺肋花楸组培苗的生根,NAA浓度为0.2~0.6 mg·L-1时,组培苗的生根率不断提高。1/4 MS培养基上NAA浓度为0.6 mg·L-1时组培苗的生根率达到最大值98.3%,且显著高于其他处理;1/2 MS、3/4 MS培养基的组培苗生根率均达到100%,MS培养基的组培苗于0.6 mg·L-1NAA浓度时的生根率为92.5%,达到最大值。NAA浓度继续增加,为0.8~1.0 mg·L-1,1/4 MS、3/4 MS、MS培养基的根长变短,根数减少,生根率降低。1/2 MS培养基的生根率随着NAA浓度的增加,仍为100%,未呈现降低趋势,但在NAA浓度为0.6 mg·L-1时,组培苗的鲜重、干重、株高、根长、根数均显著高于其他处理,植株生长健壮,叶片舒展,根系完整。因而NAA浓度为0.6 mg·L-1最有利于组培苗根部的生长。
2.2.2MS培养基浓度对黑果腺肋花楸组培苗生根的影响
从表5可以看出,MS培养基浓度对黑果腺肋花楸组培苗生根具有一定的影响。随着MS培养基浓度的增加,组培苗的鲜重、干重、株高呈增长趋势,于MS培养基达到最高值,显著高于其他处理,且各处理间达到显著差异水平。但1/4 MS、1/2 MS、3/4 MS培养基的组培苗生根率分别为98.3%、100%、100%,显著高于MS培养基。且1/2 MS培养基的组培苗的根长、根数显著高于其他处理。因而综合考虑各因素,1/2 MS培养基更适合黑果腺肋花楸组培苗的生根培养。
表5 MS培养基浓度对黑果腺肋花楸生根的影响
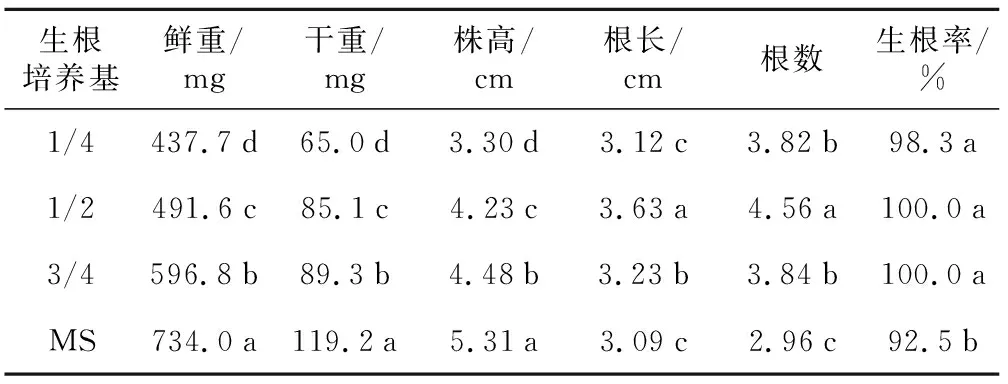
生根培养基鲜重/mg干重/mg株高/cm根长/cm根数生根率/%1/4437.7d65.0d3.30d3.12c3.82b98.3a1/2491.6c85.1c4.23c3.63a4.56a100.0a3/4596.8b89.3b4.48b3.23b3.84b100.0aMS734.0a119.2a5.31a3.09c2.96c92.5b
2.3 移栽基质对黑果腺肋花楸组培苗驯化的影响
如表6所示,将组培苗移栽于黑色育苗盘驯化30 d后,处理D基质配比的成活率仅为72.8%,显著低于其他处理。处理B、C基质配比的成活率分别为98.2%、93.3%,而处理A的成活率为88.7%,略低于处理B、C。在A、B、C 3处理基质配比的移栽苗,植株长势良好,叶片平展,呈嫩绿色,根系较发达,综合比较各指标,黑果腺肋花楸最适宜的组培苗移栽基质为处理B蛭石∶草炭土=2∶3。
3 讨论与结论
通过研究植物生长调节剂对黑果腺肋花楸增殖生长、不定根诱导的影响,以及基质配比对练苗移栽的影响,结果表明:
1) 培养基0.3 mg·L-1NAA+1.0 mg·L-16-BA的激素浓度配比有利于黑果腺肋花楸的增殖生长,最高增殖系数达9.73。与张春雨等[10]、陆爽等[11]认为NAA与BA结合可诱导出黑果腺肋花楸致密的绿色愈伤组织结论相一致,但最佳的NAA与BA配比浓度未得出结论。研究表明,细胞分裂素浓度不是越高越好,浓度过高反而使玻璃化程度加重,成苗率降低[12-13],通过本试验也得到验证,但所采用的激素浓度有所不同,可能与所选取的外植体不同有关,有待于进一步研究。

图5 黑果腺肋花楸组培苗的驯化
2) MS培养基中降低矿物质浓度有利于组培苗的生根[11,14]。黑果腺肋花楸继代苗的生根培养以1/2 MS+0.6 mg·L-1NAA为最佳,最高生根率达到100%。而马冬菁、陆爽等研究[11,15]分别认为1/2 MS+6.0 mg·L-1ABT、1/2 MS+6.0 mg·L-1IBA为最佳生根培养基,不同激素的诱导作用有待于进一步研究。
3) 组培苗的驯化移植,即植株由异养向自养转化的过程,是组培成功的关键环节,为提高黑果腺肋花楸组培苗的成活率,试验对基质进行了筛选。基质B蛭石∶草炭土=2∶3移栽的组培苗长势良好,在鲜重、干重、株高、成活率各方面均显著高于其他基质配比,其根长、根数仅次于处理C蛭石∶草炭土=3∶2,可能与蛭石含量高,基质疏松,孔隙度大,有利于根系的生长有关,有待进一步研究。综合各指标,黑果腺肋花楸最适宜的组培苗移栽基质为处理B蛭石∶草炭土=2∶3。
黑果腺肋花楸的树型美观、叶色多变、果实宿存,四季可赏,是园林景观的优良树种。且其果即可食用,又具有很高的药用价值,应用前景广泛。利用组培方式进行繁育不受季节、时间和环境的限制,可快速提高繁殖系数,缩短植株生长年限,有利于解决黑果腺肋花楸苗木市场短缺的现象,也为规模化生产提供了一定的参考依据。
