人工调控细胞表面受体聚集状态及功能
2020-05-19李婧影杨黄浩
李婧影,陈 琛,李 娟,杨黄浩
(1.福州大学化学学院,食品安全与生物分析教育部重点实验室,2.生物科学与工程学院,福州 350108)
受体是位于细胞表面的跨膜蛋白,可作为连接细胞内环境与外界环境的桥梁,用于接收来源于细胞外的化学或物理刺激,并将产生的信号向细胞内传递[1~3].受体在生理和病理过程中发挥着重要作用,大多数细胞活动都是由不同的受体相关信号传导所控制的,如细胞间通讯、 细胞分裂、 增殖、 迁移和凋亡等[4].值得注意的是,大多数受体并不能以单体的形式发挥功能,而是需要形成聚集体来激活下游信号通路[5,6].在感知细胞外刺激后,许多受体会从离散的单体转变为二聚体甚至更高聚集程度的寡聚体,如整合素、 G蛋白偶联受体(GPCR)、 酪氨酸激酶受体(RTK)及T细胞受体(TCR)[7~11],该过程对细胞的下游信号激活具有重要作用[12~15].因此,人工调控受体聚集可以实现对受体功能和信号通路的精准、 按需调控.
目前,可用于调控受体聚集状态的方法十分有限,比较成熟的技术,如化学诱导二聚化(CID)体系[16]和光遗传学[17],都依赖于基因编辑技术对目标受体蛋白进行改造.尽管此类技术已经在生物分子和细胞调控方面取得了一些进展,但在应用于活细胞受体聚集状态调控时仍存在许多挑战[18],如CID过程不可逆且难以诱导更高聚集程度的寡聚体形成[19].而在光遗传学中,光的组织穿透性是首要考虑的问题,通常需要特制的昂贵设备,如光纤或双光子照明系统[20,21].另外,这类需要基因编辑的技术难以适用于所有受体蛋白,而且可能对内源性蛋白的结构和功能产生干扰.因此,研究者们更多地将目光转向开发无需依赖基因编辑技术的方法上.
本文将聚焦近年来在人工调控受体聚集及功能方面的研究进展.根据采用的主要功能成分的理化性质进行分类: 一类是利用具有刺激响应功能的纳米材料,并依靠光、 电、 磁等外加物理刺激对细胞表面受体的聚集状态进行调控; 另一类是利用具有受体识别功能的生物分子,如核酸、 蛋白及多肽等对受体进行特异性识别,并通过分子组装改变受体的聚集状态(图1).

Fig.1 Schematic representation of artificial regulating receptor clustering on cell surface
1 利用物理刺激的人工调控方法
随着纳米技术的发展,一些具有刺激响应功能的纳米材料,如光敏材料、 磁性材料和温敏材料等,在众多领域发挥了极大的作用[22].利用这些材料可以对生物体施加非侵入式的刺激,尤其适用于活体研究.目前,基于物理刺激响应性纳米材料进行受体聚集调控的研究已取得了一些进展[23~35].
1.1 光调控
光调控由于具有高时空精确度以及生物友好的特点而备受关注.Aida等[23]首次报道了一种光切割分子胶水,并将其用于调控受体二聚化和激活.这种胶水分子含有9个胍离子,可与蛋白分子中的氧阴离子基团形成多价盐桥而黏附在蛋白表面.此外,胶水分子中含有光切割位点,在紫外光照射下黏附在蛋白表面的胶水分子发生光降解,导致分子与蛋白的相互作用减弱并将蛋白从胶水中释放出来.他们选择间质上皮转化(Met)受体的配体肝细胞生长因子(HGF)作为与胶水分子作用的蛋白,用于抑制HGF与Met受体的相互作用.经紫外光照射后,Met受体与HGF的相互作用恢复,诱导Met二聚化并激活,进而实现对细胞迁移的调控[图2(A)].这种分子胶水可以与多种蛋白产生高亲和力的相互作用[24,25],因此,该方法有望推广用于不同受体的聚集调控.但由于该分子只能响应紫外光,而紫外光照射会产生细胞光损伤且紫外光在组织中的穿透性较差,极大地限制了其在生物体系中的应用[26].针对上述问题,Salaita等[27]发展了生物相容性更高的光调控受体聚集方法,设计了一种近红外(NIR)光驱动的光-动转换器.在金纳米棒(Au NRs)外包裹一层热敏感聚合物聚(N-异丙基甲基丙烯酰胺)(pNIPMAm),利用Au NRs的光热转换特性,吸收NIR光产生热驱动外层的热敏聚合物发生收缩,并在表面修饰靶向受体(如整合素或T细胞受体)的分子精氨酸-甘氨酸-天冬氨酸(RGD)或卵清蛋白的多肽-主要组织相容性复合体(OVA pMHC),从而实现了更高精度的受体聚集调控以及对细胞黏附、 迁移和免疫应答的调控.
1.2 磁场调控
由于磁场具有良好的生物相容性,通过磁场刺激对纳米颗粒施加拉力或扭力进行细胞控制的方法已被广泛应用于细胞机械传导的研究中[28].磁场可以对磁性纳米颗粒施加强大的外力,诱导纳米颗粒发生聚集,从而导致纳米颗粒-受体复合物在细胞表面形成聚集体[29,30].通常,磁性纳米颗粒表面需包覆可与受体特异性结合的配体,当细胞置于磁场中时,细胞表面的纳米颗粒受到牵引并通过受体-配体作用传导微弱的拉力,将受体拉近形成聚集体.利用这种方法可以使多种受体发生寡聚化并激活下游通路,进而调控多种细胞行为,如控制T细胞激活[图2(B)]以及细胞凋亡等[31,32].磁调控还可以实现远程及高时空分辨调控受体聚集状态,适用于活体研究.虽然磁调控技术还处在发展初期,仍是一种进行靶标区域内细胞行为调控的有力工具.
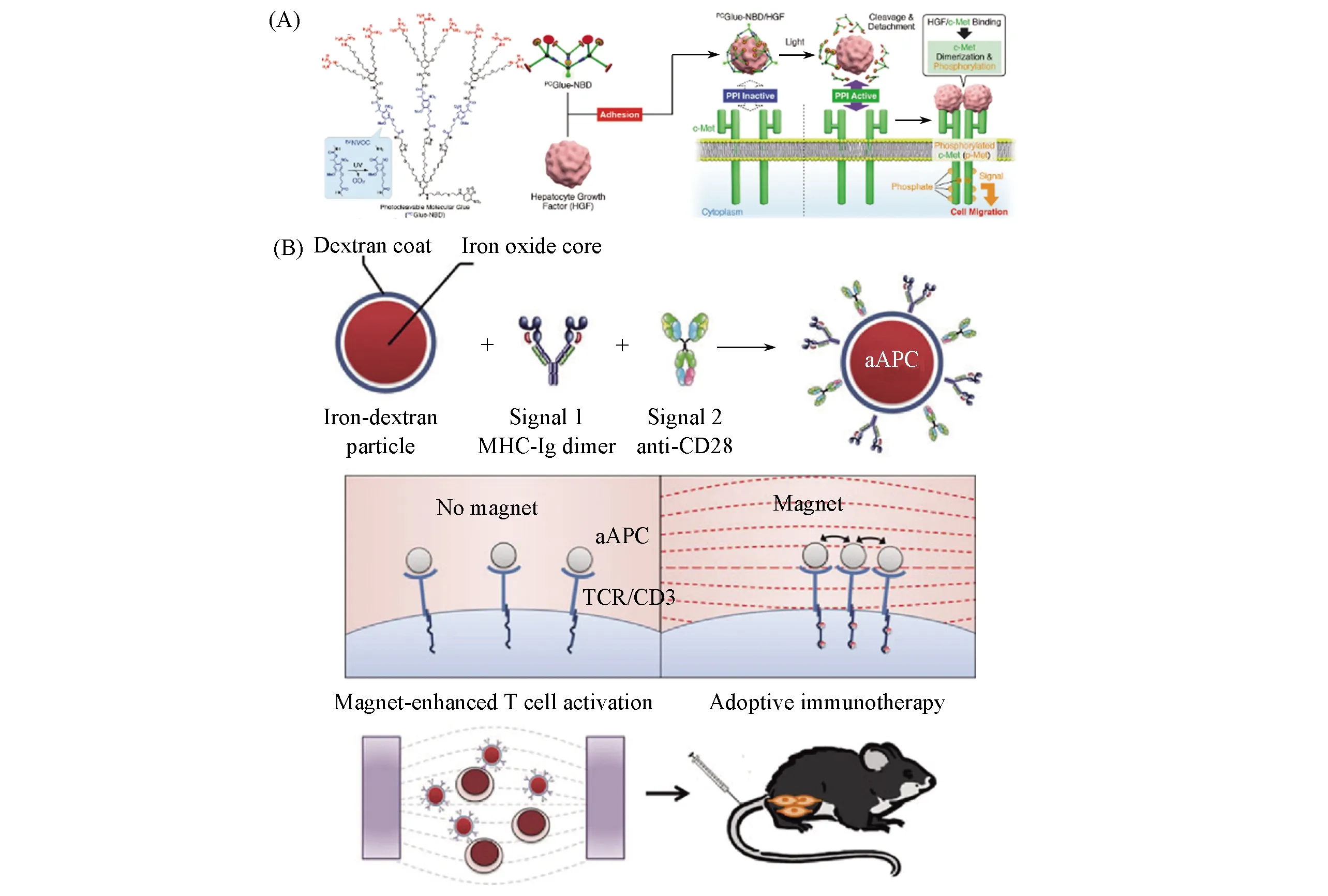
Fig.2 Chemical structure of PCGlue-NBD and schematic illustration of the mechanistic role of PCGlue-NBD for turning off and on Met dimerization caused by the interaction between Met and its ligand HGF(A)[23],schematic representation of nano-aAPC synthesis by coupling MHC-Ig dimers and co-stimulatory anti-CD28 to iron-dextran nanoparticles(B)[31] (A) Copyright 2019,American Chemical Society; (B) Copyright 2014,American Chemical Society.
1.3 温度调控
温度也是常用的物理刺激,它同样具有时空分辨的调控能力以及良好的生物相容性[33].温度敏感的聚合物在调控细胞表面受体聚集方面备受关注,其中最常见的是聚N-异丙基丙烯酰胺(PNIPAAm),在生物医药领域已经得到了广泛应用.PNIPAAm可以随温度改变而在收缩状态和膨胀状态之间切换[34].最近,Wang等[35]利用PNIPAAm与人类表皮生长因子受体2(HER2)靶向多肽形成的共聚物进行HER2受体聚集调控及监测,最终实现了对乳腺癌细胞增殖的有效抑制,该方法将有望应用于分子靶向的肿瘤治疗.
2 利用生物分子的人工调控方法
由于大部分受体都具有天然配体,通常是蛋白、 多肽及核酸等生物分子,因此基于这些具有受体特异性识别功能的分子进行靶向识别,并引入分子组装过程可以实现对目标受体聚集的调控.
2.1 基于核酸分子识别和组装的调控策略
核酸除了作为遗传物质外,近年来也被发现能够作为结构和功能单元应用于生化分析及生物医学等领域[36~38].核酸分子具有结构可编程性和低免疫原性的特点,便于进行精确的分子设计,在生物应用中也更加方便[39~42].核酸适体(Aptamer)对靶标分子具有高亲和性和高特异性的识别能力,因此,常被称为“化学抗体”.相较于抗体,核酸适体的最大优势是合成简单且容易进行化学修饰,因而在生物传感和疾病治疗中具有巨大的应用前景[43].如,受抗体多价效应的启发,利用核酸工程化组装可构建靶向免疫相关受体的多价核酸适体(如T细胞表面受体4-1BB[44]和CD30[45]、 肿瘤凋亡因子受体OX40[46,47]等),用于激活免疫细胞功能,进行肿瘤的免疫治疗.随着针对不同靶标受体的核酸适体被大量发现,利用核酸分子进行人工调控的研究对象也涵盖了越来越多的受体家族,如酪氨酸激酶受体、 整合素等,进而实现了除免疫激活外更多类型的细胞功能的调控.
2.1.1 诱导受体的同源二聚化 Allen等[48]首次将核酸适体用作诱导RTK受体二聚化的分子开关,利用聚乙二醇(PEG)将2个靶向血管内皮细胞生长因子受体2(VEGFR2)的核酸适体连接形成二价核酸适体,它可以作为VEGFR2的激动剂,促进形成内皮细胞毛细血管样管.该研究为进一步开发基于核酸适体的受体激动剂奠定了基础.
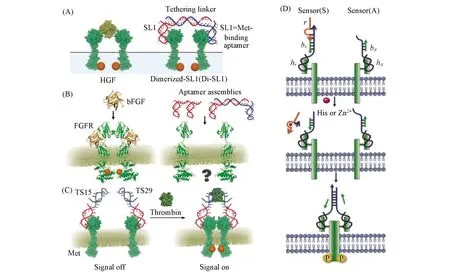
Fig.3 Schematic representation of DNA-based HGF mimetic(A)[49] and FGFR activation induced by FGF(left) or designed aptamer assemblies(right)(B)[50],DRIPaR for inducing thrombin-dependent Met activation,and their influences in the p-Met expression level in A549 cells(C)[51],histidine or Zn2+ DNAzyme-based D-CID of Met activation(D)[52] (A) Copyright 2016,John Wiley and Sons; (B) Copyright 2019,Royal Society of Chemistry; (C) Copyright 2017,American Chemical Society; (D) Copyright 2018,John Wiley and Sons.

Fig.4 Schematic representation of logic-based aptamer-controlled receptor assembly for modulation of cellular signal transduction(A)[53] and photo-controlled DNA assembly approach for the receptor dimerization and signaling activation(B)[54],BAAP strategy to selectively regulate Met receptor function and downstream signaling pathways(C)[56] (A) Copyright 2019,John Wiley and Sons; (B) Copyright 2018,John Wiley and Sons; (C) Copyright 2019,American Chemical Society.
随后,Sando等[49]进行了一系列重要研究.首先,基于核酸适体开发了HGF类似物作为Met受体激动剂,2个Met核酸适体(SL1)单体通过互补链杂交形成Di-SL1双核酸适体,Di-SL1与2个Met受体结合,从而诱导活细胞中Met二聚化及受体激活,并最终产生与HGF激活相似的细胞行为[图3(A)].其次,探讨了二聚的受体间距对受体激活的影响,通过改变2个SL1之间连接链的长度,设计了一系列不同间距的Di-SL1.实验结果表明,Met受体之间的距离是诱导受体激活的一个重要因素,Di-SL1间距的增加会减弱Met受体的激活水平.该课题组[50]利用类似的策略设计了成纤维细胞生长因子受体(FGFR)的人工激动剂,诱导FGFR二聚化,并将其应用于维持人诱导多功能干细胞(hiPSCs)的多功能性和自我更新活性,成为一种作为生长因子类似物的理想化合物[图3(B)].最后,他们[51]充分发挥核酸的可设计性,开发了一种DNA核酸适体介导的改变RTK相互作用对象的策略,简称DRIPaR.该策略采用的双特异性核酸适体中包含了一段结合RTK的核酸片段和一段响应细胞外刺激分子的核酸片段.在加入外界刺激分子后,会与双特异性核酸适体以摩尔比1∶1∶2形成三元复合物,导致RTK二聚化及激活[图3(C)].通过设计核酸序列,可以利用多种外界刺激分子作为激活RTK通路的激动剂,如凝血酶和血小板衍生生长因子.这一灵活多变的设计使得研究者可以根据需求设计不同的DNA开关,进而应用于智能化、 生物相容的再生药物中,实现在特定生物环境中对生长因子信号通路和细胞活性的诱导激活.为了实现在多重环境刺激下受体功能的选择性调控,Nie等[52]设计了动态DNA纳米机器,利用响应性链置换机制来调控受体聚集和激活信号通路.以一种非基因的DNA介导CID策略(D-CID)来激活受体二聚化,并通过化学响应控制细胞行为.与传统的CID相比,D-CID策略可以由不同的识别元件组成,如核酸适体、 脱氧核酶(DNAzyme).因此,D-CID可响应不同的外界刺激,包括三磷酸腺苷(ATP)、 组氨酸(Histine)和金属离子等,通过不同功能化的D-CID可以对细胞迁移进行程序性和选择性的调控[图3(D)].
最近,Li等[53]利用DNA的可编程性,设计了DNA逻辑驱动的组装体系.他们模拟计算机处理器整合处理多个输入信号的过程,创建了一个多输入驱动的DNA逻辑门,实现了细胞对各种输入组合进行编程性应答,进而调控受体聚集和细胞信号传导过程[图4(A)].具体来说,利用核酸适体和DNA逻辑驱动组装,在不同刺激条件下分别引发DNA链置换或光响应的DNA杂交,实现按需控制受体二聚化,最终操控细胞的迁移行为.
为了提高细胞行为调控的时空分辨率,Yang等[54]提出了一种基于核酸适体的光控DNA聚集策略用于光诱导受体二聚化和通路激活.通过引入修饰有光切割基团的DNA探针,实现了光控Met受体二聚化[图4(B)].然而,上述策略中利用的紫外光源具有穿透深度低及生物体系内源性吸收高等缺点,在活体中的应用受到一定的限制.为了克服这些困难,Nie等[55]构建了一个新型的近红外激活DNA激动剂系统(NIR-DA),利用金纳米棒对近红外光响应产生的光热性质,使原先修饰在金纳米棒表面的DNA激动剂被释放,通过DNA杂交诱导Met受体表面事先结合的核酸适体之间发生二聚化,进而实现对Met受体二聚化和通路激活的近红外光调控.由于近红外光具有良好的组织穿透性,该策略被应用于深层组织的细胞功能调控.
2.1.2 诱导受体的异源二聚化以及寡聚化 上述大多数调控策略是通过诱导受体发生同源二聚化调控受体功能.最近,Yang等[56]首次提出了一种双特异性核酸适体诱导人工蛋白配对(BAAP)的策略,通过诱导受体发生异源二聚化选择性地调控受体功能[图4(C)].双特异性核酸适体探针作为分子调节剂分别与靶标受体和配对受体结合,使活细胞膜上的2个不同类型的受体相互靠近.其中,配对受体不仅可以作为肿瘤标志物用于提高该策略的细胞选择性,还可在靶标受体周围形成空间位阻,阻碍靶标受体的天然配体对其激活,从而抑制靶标受体相关的信号通路.利用该策略成功地抑制了Met受体的激活以及细胞的迁移.
利用DNA形成的复杂纳米结构还可诱导受体形成聚集程度较高的寡聚体.Teixeira等[57]通过设计DNA纳米卡尺对肝配蛋白-A5(Ephrin-A5)的空间分布进行精确控制,实现了对细胞表面促红细胞生成素产生肝细胞受体(EphA2)的调控,进而控制乳腺癌细胞的侵袭能力.其中,与受体间距为101.1 nm的纳米卡尺NC100相比,间距为42.9 nm的纳米卡尺NC40具有更高的EphA2激活能力.结合Sando等[49]报道的Met受体间距与受体激活之间的关系,可以推测在受体发生聚集时受体间距越小越有利于受体的激活.而DNA纳米结构的精确性和可设计性为精确调控受体间距提供了极大的便利,如Li等[58]受章鱼腕足结构的启发,通过滚环扩增设计了一个含有多发夹结构的DNA纳米弹簧.利用DNA链置换反应,该纳米结构能够像弹簧一样运动,更重要的是,DNA纳米弹簧上修饰了多个RGD分子,因此可以用于整合素寡聚化的可逆调控,并控制细胞黏附和伸展.
2.2 基于蛋白/多肽类分子的调控策略
由于大多数受体的天然配体都是蛋白质,如肿瘤坏死因子相关凋亡诱导配体(TRAIL),它是死亡受体4和5(DR4和DR5)的配体,是一种Ⅱ型跨膜蛋白[59].近年来,产生了许多TRAIL的模拟分子和抗体被用作死亡受体(DR)激动剂,如AMG655和Apo2L/TRAIL,但均由于效果不如预期而没有完成Ⅱ期临床研究.研究者认为这是由于在水溶液中呈分散状态的激动剂不能充分诱导受体形成聚集状态,导致对受体的激活效率低下,而通过构建激动剂的复合物则可以有效提高肿瘤细胞的杀伤率[60].另外,一些纳米材料也被用于构建多价配体以诱导受体寡聚化,利用多价结合机制提高诱导受体形成聚集体的效率和聚集程度,从而实现更高效的受体聚集调控[61,62].Martinez-Lostao等[63,64]将重组人TRAIL修饰到人工脂质纳米颗粒上,形成LUV-TRAIL,该体系中高度有序的TRAIL寡聚体能够提高诱导DR5寡聚化的效率,并招募死亡诱导信号复合物(DISC),触发胱天蛋白酶级联反应,最终导致细胞凋亡.
然而,这些蛋白或抗体的分子量和尺寸通常较大,并且难以合成、 成本较高.多肽由于尺寸相对较小、 制备简单,在实际应用中更加方便.Kolmar等[65]利用一种重组筛选得到的DR5靶向肽(DR5TP)作为TRAIL的多肽类似物[66],设计了负载多个DR5TP的大分子结构,发现七价DR5TP结构具有显著的诱导细胞凋亡的活性.最近,Kolmar等[67]设计了一种具有空间柔性的多元Fc-右旋糖苷-DR5TP共嵌物,用于诱导DR5寡聚化进而诱导细胞凋亡.此外,一些双功能多肽也被开发用于诱导受体异源寡聚化.如,Galipeau等[68]通过融合粒-局势细胞集落刺激因子(GM-CSF)和白介素γ-链制备了一种新型蛋白,称为GIFT融合因子(GM-CSF白介素转基因融合).GIFT可以作为双特异性配体诱导不同的受体间发生聚集,并导致下游信号通路的径向变化.
除了这些来源于天然配体的多肽外,一些人造的多肽类配体也能够用于选择性结合靶标受体.随机非标准多肽整合发现系统(RaPID)被用于筛选针对不同目标蛋白的大环多肽[69].利用RaPID系统已经发现了与Met受体具有高亲和力的大环多肽.通过将2个大环进行共价连接可以诱导Met受体的二聚化,这种二聚的大环多肽可以模拟HGF的功能并诱导细胞产生相应的行为,包括增殖和迁移[70,71].与天然蛋白或多肽配体相比,这种二聚大环多肽作为治疗性激动剂具有一定的优势,如便于进行化学合成和化学修饰.同时,RaPID系统可以用于多种膜受体蛋白,用于设计和合成人造激动剂以激活受体的寡聚化[72].
3 总结与展望
化学生物学和细胞生物学的快速发展激发了研究者对人为按需调控细胞通路及功能的兴趣.控制细胞表面受体的聚集状态是操纵下游信号级联反应的关键及最初过程.本文综述了近年来发展的一些不依赖基因编辑技术的受体聚集调控策略,可以对更多的内源性受体进行调控,而不会对其原本的结构和功能产生干扰.尽管已经取得了一些令人瞩目的研究成果,但该领域仍存在诸多挑战.首先,由于细胞表面存在非常多不同类型的受体,现有方法无法实现对所有受体家族的调控.这主要是由于识别靶标受体的分子还十分有限,如抗体、 核酸适体等.虽然这些靶向分子的筛选研究在持续进行中,但通常整个过程周期长、 成本高、 产出低,导致进展相对缓慢.因此,开发简便、 高效的靶向分子筛选技术将有利于相关研究的发展.其次,大多数研究仍处于初级阶段,应用还不够广泛.如,对于体内细胞行为的精准控制在许多研究中非常重要,尤其是脑科学和神经科学.因此,就要求开发出具有组织可穿透性的高时空分辨调控策略.即使近红外光在深层组织应用中具有较大潜力,但仍未实现超越毫米尺度上的受体聚集调控乃至单细胞调控.最后,核酸、 多肽和抗体等生物分子的稳定性差以及在活体中的循环时间短,在体内发生的酶解以及蛋白非特异性吸附都会导致受体调控的特异性和效率降低.因此,发展普适、 有效、 适用于复杂生物体系的受体聚集调控策略的需求仍十分迫切.近年来,在人工碱基、 非天然氨基酸等领域的研究已取得了初步进展,有望为构建高生物稳定性的靶标分子提供新的机遇.综上,该领域的研究还处于初期及快速发展阶段,需要更多的投入来克服上述困难以满足实际应用的需求.
