硫化氢催化氧化技术的研究进展
2020-05-19尹梦雪樊飞跃赵龙侯红
尹梦雪,樊飞跃,赵龙,侯红
环境基准与风险评估国家重点实验室,中国环境科学研究院
硫化氢(H2S)是一种无色具有强烈气味、高腐蚀性和高毒性的化合物,是恶臭气体主要成分之一,其广泛存在于天然气、沼气和其他化石燃料加工的尾气中[1]。此外,许多行业,如垃圾填埋场、污水处理厂污泥消化区等也会生成大量的H2S,对人类健康和工业过程产生严重影响[2]。因此,必须优先将其去除,以降低维护成本[2],并避免其对人类健康和环境的威胁[1]。
目前H2S去除的方法主要包括吸附、吸收和催化氧化技术[1]。吸附技术具有快速吸附低浓度H2S、工艺简单、操作温度低等优点,但存在价格高、消耗量大、再生效果差等缺点;吸收技术虽具有设备简单、材料价格低等优点,但其吸收效率低,只能吸收高浓度H2S[3];催化氧化技术具有投资成本低、脱硫精度高(尾气浓度小于10-7molL)、无二次污染等优点,特别适用于低温、低浓度H2S的精脱除[4],受到广泛关注,该技术的核心在于高性能催化剂的开发。笔者综述了近10年H2S催化氧化技术的研究进展,总结了现有催化剂的优缺点,并对未来催化剂的研究方向进行展望,以期为后续研究提供基础资料和研究路径。
1 H2S催化氧化原理
1.1 炭基催化剂
据报道[5-6],在水汽存在的情况下活性炭(AC)材料的脱硫过程分为物理吸附、化学吸附和催化氧化。物理吸附是先将H2S气体吸附在催化剂的微孔中,再将H2S从本体转移到AC的孔或表面〔式(1)〕,最后将吸附的H2S溶解在水膜中〔式(2)〕。

(1)

(2)
化学吸附是将水膜中吸附的H2S离解成HS-和H+,反应式如下:

(3)
催化氧化是被吸附在AC表面上的氧将HS-氧化成S元素和水,反应式如下:

(4)
1.2 金属氧化物催化剂
金属氧化物催化剂通过2种方式与H2S发生反应生成硫化金属:催化剂上负载的金属直接与H2S反应〔式(5)〕;先将氧分子在催化剂表面变成活性氧〔式(6)〕,再与H2S发生反应〔式(7)〕[7]。

(5)

(6)

(7)
2 H2S催化氧化催化剂
根据载体不同,H2S催化氧化材料主要分为炭基催化剂和金属氧化物催化剂,根据催化剂是否负载活性组分又分为负载型催化剂和非负载型催化剂。通过调控材料的结构可以增加载体材料的孔隙率、比表面积和活性位点等。三维有序大孔结构的材料(3DOM)具有相互连接的大孔、高孔隙率和巨大的表面区域等优点,能够与活性颗粒相结合,有利于在中温下实现优异的脱硫性能[1,8],因此成为近年来催化材料研究的热门。AC和金属氧化物载体都可以通过结构改造(如3DOM结构)增加载体催化性能。
2.1 炭基催化剂
AC是比较常见的气体吸附剂,具有巨大的比表面积、大量的微孔结构,表面存在各种活性基团,并易于用物理、化学方法进行修饰[9]。H2S的催化氧化需要微孔与中孔(或大孔)相互连接且总孔体积高的大孔隙炭,使吸附在微孔中的硫易于被氧化[10]。由于AC本身的特性,它既可以单独作为吸附剂,也可以作为载体。
2.1.1无负载AC
无负载AC对H2S的吸附主要是通过微孔和中孔结构,在H2S去除中,AC的比表面积和孔隙率比矿物质含量更重要[6,11-12]。另外,氮原子的掺杂也会增强AC催化剂的催化性能[12]。
Surra等[11]通过CO2物理活化法和不同的化学活化法将玉米穗轴废物(MCW)进行活化,发现物理活化时间较长的样品显示出更高的催化氧化性能,且其H2S吸附能力(15.5 mgg)比商业AC(0.51 mgg)要高。Shi等[6]使用椰壳基AC(ACS-1)作为吸附剂用于H2S选择性催化氧化,发现ACS-1的穿透硫容(H2S出口浓度达到入口浓度的5%时,催化剂上所吸附的硫容量)为64.27 mgg,脱硫效率较高。Sun等[12]通过静电纺丝法制备的具有分级多孔结构的炭纳米纤维(N-PCNF)在室温下表现出优异的H2S选择性催化氧化能力,穿透硫容可达357 mgg。
富氮AC具有高表面密度的催化位点和较高的孔隙体积,当氮含量为8%时,穿透硫容高达2 770 mgg,这可能是因为位于石墨烯片边缘的氮原子具有很强的电子接受能力,有利于吸附氧原子进行氧化反应[10],大气中的H2S和O2被吸附在AC活性位点上,发生催化氧化反应,最终生成硫元素[13]。这种催化剂的制备方法可能对于大规模、低成本地制备结构控制纳米材料催化剂是一种有效途径,在污染治理和环境保护方面具有广泛应用前景。
2.1.2金属负载AC
AC作为载体能够高度分散金属或纳米金属粒子,并作为支撑层,在防止金属纳米金属粒子的聚集中起重要作用[1,7,14]。目前,金属负载AC的制备方法主要有浸渍法、沉淀法、混合法、离子交换法、水热合成法、溶胶-凝胶法、热熔法和电解法等。浸渍法具有载体材料简单易选、利用率较高等特点,是最常用的制备方法。碱金属负载AC通常用浸渍法制备,改性后的AC表面均匀地被碱金属覆盖,其形态和性质(如结晶度和比表面积)也发生改变[15]。浸渍法既能保证活性相的高度分散,又在很大程度上保留了原始AC的纹理特征[16-17]。对载体进行酸处理会增加金属分散度,一般使用硝酸盐或硫酸盐作为合成材料中金属的前体物,对采用浸渍法等方法初步制备好的钝态催化剂进行煅烧会去除挥发性组分(NO2、SO2等)和结合水,只留金属氧化物在载体上,使催化剂活化[18-19],从而可以增加金属的负载成功率。
水分的加入对H2S的去除至关重要[1],O2吸附在AC表面上并通过水膜裂解成活性氧自由基,同时,H2S溶解在水膜中形成HS-,进一步与活性氧自由基反应生成硫元素[10]。Zhang等[20]发现,碱性MgO比常规碱性盐在水膜中的溶解性更好,从而具有更好的催化性能。由于和H2S的竞争吸附作用,CO2的存在会干扰H2S的吸附效果,因此,CuSO4负载AC受干扰程度最大[15]。

催化剂负载金属常用的活性组分为K、Na、Mg、Cu、Zn、Fe等单质及其化合物。用商业椰壳AC(CAC)做载体,若存在CO2,对H2S的催化氧化性能为ZnAc2-CAC>Na2CO3-CAC>KOH-CAC>KI-CAC>CuSO4-CAC>CAC;如果使用合成空气(无CO2),则KOH-CAC催化效果最好[15]。Zhang等[20]也证实常规碱性盐做活性组分时催化效果不如某些碱性金属盐。
Zhang等[20]研发的毫米级中孔炭球(MCS)的催化效果是常用催化剂吸附能力的4~6倍,仅次于8%富氮AC,这是因为MCS的大孔径和3D中性孔有利于反应物和产物的扩散,其高孔隙体积也为产物硫提供了足够的储存室。由于具有高强度、低流动阻力和高耐磨性的独特结构优点,MCS可直接用于H2S去除而无需进一步处理,具有很大的吸附和催化应用潜力。
表1列举了部分单金属负载AC的制备方法和最大穿透硫容等。从表1可以看出,浸渍法为最常用的催化剂制备方法,除碱金属外,最常用的活性组分为Cu、Fe。碱金属-MCS最大穿透硫容为2 460 mgg,催化效果最好;通过静电纺丝聚丙烯腈(ACNF)和Cu前体的混合物制备的Cu/CuxO-ACNF纳米复合材料的最大穿透硫容可达213.8 mg/g;其他复合材料的最大穿透硫容均不超过200 mg/g。Tian等[19]通过使用溶胶-凝胶和浸渍法将Fe纳米颗粒插入中孔炭气凝胶中制备Fe纳米颗粒/炭气凝胶催化剂,发现其在500~650 ℃具有较高的脱硫性能,由于Fe纳米颗粒/炭气凝胶具有良好的脱硫性能,且其制造工艺简单、稳定,因此可用于热煤气脱硫。

表1 不同单金属负载AC对比
目前,对上述催化剂的报道仅停留在实验室阶段,实际应用的有关报道较为鲜见。Sun等[5]用分步浸渍法将FeO和NaOH负载在φ6.0 mm×4~10 mm的AC上,制备新型JTS-01和JZC-80催化剂,发现JZC-80催化剂可有效去除煤气中HCl、HF、HCN、H2S以及灰分中的其他杂质,保证设备的使用寿命,并使系统压降保持稳定。JTS-01和JZC-80催化剂已成功应用于上海宝钢商业化工厂的COREX煤气净化中。与传统干法脱硫工艺相比,JTS-01和JZC-80催化剂具有硫容量较高、压降较低等优点。
负载双活性组分时,双金属氧化物之间有协同作用,增加了H2S的吸附能力,对合成催化剂的形貌和表面结构产生了积极影响,载有双金属的活性位点在吸附H2S后形成2种硫化金属[2,16]。通过浸渍商业AC制备具有固定的总金属含量和可变的Zn∶Cu(摩尔体积比为0∶1~1∶0)催化剂进行H2S动态去除试验,发现Cu和Zn之间有明显的协同作用,Cu有助于防止催化剂吸附H2S时Zn对微孔的严重堵塞,当Cu和Zn等摩尔体积负载时,具有最大穿透硫容(49.64 mg/g),比原始AC的负载效果好很多[16-17]。Lee等[2]用粉末状AC(PAC)作载体,在室温下共同预沉淀Zn2+和Fe3+,合成双金属(Zn-Fe)氢氧化物催化剂,结果表明,当Zn∶Fe(摩尔体积比)为3∶1,pH为9时,催化剂最大穿透硫容为143 mg/g,远高于纯Fe或Zn的穿透硫容,Zn与Fe的协同作用增加了对H2S的吸附能力。
2.2 金属氧化物催化剂
2.2.1金属氧化物催化剂
在O2存在的情况下,H2S选择性催化氧化活性表现为V2O5>Mn2O3>CoO>TiO2>Fe2O3>Bi2O3>Sb6O13>CuO> Al2O3=MgO=Cr2O3,其中,V2O5和Mn2O3被认为是最具选择性的催化剂[10]。由于催化效果不理想,已经建立了多种方法改性金属氧化物,如将Ce、Sb、Nb掺入铁氧化物催化剂中,将Mo、Mg、Fe、Bi、Cr、Ti、Zr、锰酸盐和碱金属掺杂进V催化剂中,均可改善催化剂的选择和催化性能。La-V-Sb催化剂具有优异的催化效果[10]。Ce的顺式取代可以增强催化剂表面碱性并促进表面VO的形成,有利于晶格氧转化为活性氧,并改善H2S吸附性;活性氧的氧化性和Ce的还原性形成氧化还原循环,共同促成了催化剂优异的催化性能[22-23]。将具有明确晶面和层状多孔结构的形状特异性CeO2纳米晶用作催化剂发现,CeO2的缺陷位置和基本性质本质上是由表面晶面决定的,CeO2纳米棒的分层多孔结构的存在阻碍了SO2和硫酸盐的形成,确保了良好的硫选择性和催化剂稳定性[22]。Zhang等[23]使用柠檬酸盐溶胶-凝胶法合成一系列La1-xCexFeO3催化剂,通过改变氧化物的形状和Ce-Fe协同效应,催化剂还原性大大增强。
2.2.2金属氧化物负载催化剂
近年来,金属氧化物负载催化剂(如Mn、Zn、Cu、Ca、Co和Ce的氧化物)去除H2S的研究较多。由于较低的比表面积和孔隙体积,金属氧化物的利用受到限制,并且在吸附过程中形成的硫化物会使孔堵塞,导致H2S去除能力下降[19]。为解决这些问题,将金属氧化物负载在比表面积大、孔隙结构良好的载体上,让载体做结构稳定剂,活性相和载体之间的良好相互作用可以防止活性相的显著烧结[10]。因此,选择合适的载体十分重要。Al2O3、TiO2、SiO2等金属氧化物具有大的比表面积和良好的孔隙结构,是应用最广泛的氧化物载体。
与Al2O3、MgO或Fe2O3不同,吸附在SiO2表面的H2S与O2不会由于温度升高而硫酸化,许多学者已经合成了多种SiO2负载的催化剂,并对其进行了深入研究,如CrOx/SiO2、VOx/SiO2、Fe2O3/SiO2等一系列的以SiO2为载体的催化剂均表现出优异的催化性能[10]。不同结构的SiO2由于孔隙体积和孔径不同,在相同条件下呈不同的催化效果。如将SiO2改成3DOM结构体,发现3DOM-SiO2具有更大的比表面积和高孔隙率,纳米尺寸的活性颗粒的负载也会加强催化性能[4,8]。不同3DOM-SiO2负载ZnO在室温下对H2S的去除性能也有所不同[4]。Huang等[8]采用胶体晶体模板法成功合成了3DOMγ-Fe2O3/SiO2催化剂,并将硅加入到前驱体中,发现与HXT-1(无定形水合Fe2O3)相比,温度超过60 ℃时,γ-Fe2O3对H2S的吸附效果明显增强,而α-Fe2O3几乎没有活性(图1)。3DOMγ-Fe2O3/SiO2催化剂在硫容量和利用率方面表现出较佳性能,当Fe∶Si(摩尔体积比)为8时,硫容量最大。
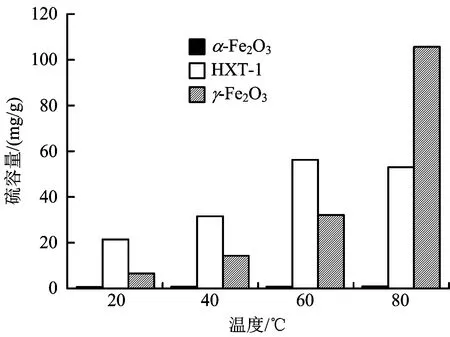
图1 在不同温度下参比γ-Fe2O3α-Fe2O3和 HXT-1的硫容量[8]Fig.1 Sulfur capacity of reference γ-Fe2O3, α-Fe2O3 and HXT-1 at different temperatures
Al2O3由于晶型的不同分为很多种,最常见的为α-Al2O3和γ-Al2O3。γ-Al2O3的比表面积和孔径等相对α-Al2O3较大,且有较好的吸附性,因此是优良的载体,但在不同煅烧温度下,二者会相互转换,如果γ-Al2O3被取代,催化活性将大大降低。
将各种金属氧化物(Fe、Co、Mn和V的氧化物)负载在Al2O3上发现:负载Fe、Co氧化物时,H2S去除率随金属含量增加而增加;负载V氧化物对H2S的去除效果不理想,但当掺入K时,其去除效果较好;负载Mn氧化物对H2S的去除效果较差[10]。通过溶胶-凝胶法制备Ni-ZnO/Al2O3催化剂,研究发现:掺杂Ni后氧空位(VO)的浓度增加,在室温下显著提高了ZnO/Al2O3对H2S的去除能力,且去除能力与VO的浓度密切相关;氧动力学在去除H2S的过程中起双重作用,一方面,通过在ZnO表面提供更高的·OH浓度,有效地促进了H2S的解离,另一方面,VO有效地促进了HS-或S2-和O2-在团块中的反向扩散,补充了ZnO表面离子[24]。以TiO2为载体制备光催化剂发现,与常规紫外线光催化氧化相比,真空紫外线光催化氧化中的H2S去除率大大增强,1%Mn-TiO2对H2S的去除率(89.95%)是在254 nm紫外线照射下的30倍[25]。
V2O5中V5+-O-V5+的存在不仅有利于H2S转化为S,而且有利于连续反应(即S和H2S深度氧化成SO2),V2O5成为载体的热门选择。用水热合成法分别将Na和Cu按照不同比例负载在V2O5上发现:复合催化剂中,V5+和V4+共存,含硫催化剂中V4+具有高稳定性;Na+、Cu2+的掺入有利于降低VO键特性、稳定V4+,将碱金属(Li、Na、K)掺入V2O5中有利于形成通式为MxV2O5的青铜[26-27]。将不同含量的V2O5负载在CeO2上发现:V2O5与CeO2有协同作用,V2O5/CeO2催化剂有良好催化性能;V是高催化活性的原因,而CeO2降低了V2O5的氧化作用[28]。
2.2.3阴离子黏土负载催化剂

Zhang等[29]采用离子交换法合成了一系列Mg/Al-V10O28-LDH化合物,测试了衍生氧化物的H2S选择性催化氧化反应,结果表明:V主要以变形的[VO4]、Mg3V2O8和Mg2V2O7中分离的V5+形式存在,还存在大量V4+(大于25%),主要由钒键形成;10.6%V(8V-LDO)的催化剂催化效果最好,且可连续使用不失活;该类催化剂优异的耐久性可归因于保持中等碱性位点的含量并改善V5+的氧化还原性质。Zhang等[30]采用一步法合成了一系列含Ce的MgAlCeLDHs,并对衍生的混合稀土催化剂进行了H2S选择性催化氧化研究,结果表明:催化剂表面上不存在化学吸附O-空位,而是存在固有缺陷位点;添加的水与低效的S8催化剂竞争占据路易斯酸位点和活性位点,使催化活性降低。以上2种催化剂均遵循两步机制来去除H2S,且在相对较低的反应温度(100~200 ℃)下表现出优异的催化性能、合理的耐久性和出色的硫选择性(100%)。
3 催化剂对比
催化剂在H2S选择性催化氧化中起着至关重要的作用,目前对催化剂所用材料的研发不仅要求具有较高的硫容量,同时还需考虑成本问题。现有研究比较倾向于降低成本,对贵金属的使用量大大减少。
炭材料由于其巨大的比表面积、高孔隙率和可以改性的表面活性位是催化剂或载体的热门选择。表2对炭基催化剂和金属氧化物催化剂性能进行对比。从表2可以看出,炭基催化剂具有相对较低的操作温度和很好的稳定性,但只能处理低浓度H2S,且要求在较低的空速下进行;由于很少能够连续进行反应,催化剂必须定期进行再生。金属氧化物催化剂可以处理高浓度H2S,且在较高的温度(200~300 ℃)下有良好的催化性能,但是由于其反应需要严格的O2、H2S和H2O化学计量比以及较高的温度,且再生性差[30],因此成本略高。

表2 催化剂性能对比
富氮AC含量为8%时,穿透硫容可高达2 770 mg/g;其次是负载碱金属-MCS,其最高穿透硫容为2 460 mg/g;负载Fe的φ4.0 mm×3~8 mm柱状AC穿透硫容为430 mg/g;其他催化剂催化效果并不理想,穿透硫容一般不超过200 mg/g。金属氧化物催化剂的穿透硫容比炭基催化剂小得多,但是金属氧化物催化剂的硫选择性很高(一般能达到90%以上),且能够进行连续反应,催化性能比炭基催化剂稍好。
4 展望
对于H2S低温催化氧化催化剂,国内外学者已经做了大量的研究,开发了多种催化剂,其中部分催化剂已经进行了实际应用,但是目前大部分催化剂并未取得优异的催化效果。虽然很多学者对催化剂的反应机理进行了研究,但目前仍没有一套完善的理论能够解释反应机理。催化剂成本较高,实际工业应用也较少。因此,未来对于新催化剂的开发可从以下几个方面考虑。
(1)反应机理。继续研究完善各种催化剂的催化原理,使用理论计算或其他方法对反应机理进行系统性研究,如水分、孔隙率等对催化剂催化反应的影响需继续研究完善。
(2)催化效果。提高催化效率和催化剂的硫容量,针对特定的催化剂研究最适的处理方式,寻找更合适的载体和负载方式,使载体利用性更强,催化效果更好。
(3)降低成本。考虑废物利用,对于AC类的催化剂考虑采用改造的生物炭,寻找价格便宜的金属代替贵金属作为活性组分。研究每种催化剂的失活原因,据此找出延缓失活的方法以及具体再生方法。
(4)实际可应用性。对催化剂的研发利用不局限于实验室范围,要能够推广应用到污水处理厂、化石燃料加工厂等,根据不同行业尾气的具体成分对催化剂进行进一步改造。如在尾气温度过高或空速过大且成分不稳定的情况下需要改良炭基催化剂,使其能够处理高浓度H2S或能够在高空速的情况下有良好的反应性能;尾气成分稳定但是温度不高且需要连续处理,可以考虑选择在低温情况下同时具有较好催化效果和良好再生性能的金属氧化物催化剂。
