2015—2018年上海地区成年女性HPV感染基因型别分析
2020-05-19冯钦蓓刘春兴徐龙府
冯钦蓓 刘春兴 徐龙府
近几年,我国女性宫颈癌发病呈上升趋势[1],成为威胁女性健康最常见的恶性肿瘤之一。人乳头瘤病毒(human papilloma virus,HPV)尤其是高危型HPV持续感染是导致宫颈癌的主要因素[2]。HPV基因序列的多样性造成基因型别种类繁多,而且各型别感染及分布存在明显的人群差异和地域差异[3],因此,明确地区人群HPV的感染现状是预防宫颈癌的重要措施。本文通过对上海地区成年女性HPV感染及基因型别分布特征分析,以期对该地区HPV感染的现状进行总结,为该地区女性宫颈癌的预防提供客观的数据支持。
1 资料和方法
1.1 研究对象 研究对象来自2015年1月至2018年12月在华东疗养院健康体检并且进行HPV基因分型检测的上海地区成年女性,共12 104例,年龄19~89岁,平均年龄(46.81±10.56)岁,中位年龄47岁。按照年龄分组,其中≤29岁组有420人,30~39岁组有2 940人,40~49岁组有3 921人,50~59岁组有3 329人;60~69岁组有1 253人,≥70岁组有241人。
1.2 试剂与仪器 HPV分型检测试剂由亚能生物技术(深圳)有限公司生产提供,PCR扩增仪采用杭州浪迹科学仪器有限公司生产,ClassⅡ级A2型生物安全柜有山东新华生产,恒温杂交仪由亚能生物技术(深圳)有限公司生产提供。
1.3 HPV基因分型方法
1.3.1 标本的采集 妇科医师以窥阴器暴露宫颈,用棉拭子擦去分泌物,将宫颈刷置于宫颈口,顺时针旋转4~5周,取出宫颈刷,放入装有3 mL保存液的采样管中送检。
1.3.2 HPV分型检测方法 采用PCR反向斑点杂交技术,煮沸法提取DNA后,PCR扩增,然后膜条杂交显色为阳性。可检出17种高危型(HPV16、18、31、33、35、39、45、51、52、53、56、58、59、66、68、73、82)和6种低危型(HPV6、11、42、43、81、83)。
1.4 统计学方法 使用SPSS 19.0对数据进行统计分析,计数资料用率表示,使用卡方检验和秩和检验比较不同组的差异,分析年龄与多重亚型基因感染的相关性使用Spearman秩相关方法,P<0.05为差异有统计学意义。
2 结果
2.1 HPV感染的基因型别分布情况 12 104例样本中HPV阳性共2 137例,感染率为17.7%。全部感染病例中,23个型别均有检出,高危型、低危型和高低危混合型感染率分别是12.9%(1 567例)、2.9%(345例)和1.9%(225例),不同基因型别的感染率占比分布情况(图1);高危型的HPV基因亚型感染率由高到低分别是52、53、58、16、51、68、66、59、56、18、33、39、31、35、45、82、73;低危型感染率由高到低分别是81、43、42、6、11、83。
2.2 不同年龄组HPV感染情况 将研究对象按照年龄分成6组,各组感染情况(表1),各年龄段HPV感染出现两个高峰,第一个出现在≤29岁组,为18.8%,30~39岁组明显下降 (χ2=5.654,P=0.017),阳性率为14.4%;30~69岁各组阳性率呈上升趋势,其中60~69岁组感染率最高,达到21.4%;所有年龄段中≥70岁组感染率最低为12.4%。
2.3 不同年龄组HPV多型别基因感染情况 2 137例感染者中,不同年龄组HPV多型别基因感染情况(表2),单一型别感染1 605例,构成比为75.1%,两个型别感染者为373例,二重感染构成比为17.5%,三型别及以上的多重感染者有159例,多重感染构成比是7.4%,合并感染构成比为24.9%;单一型感染中以单一高危型别为主,感染者有1 279例,感染构成比率为59.9%。70岁以上的多重感染率高于其他各组。年龄与多重型别感染呈线性相关 (rs=0.047,P=0.028),即随着年龄的增高,多重型别感染的概率也会相应增加。
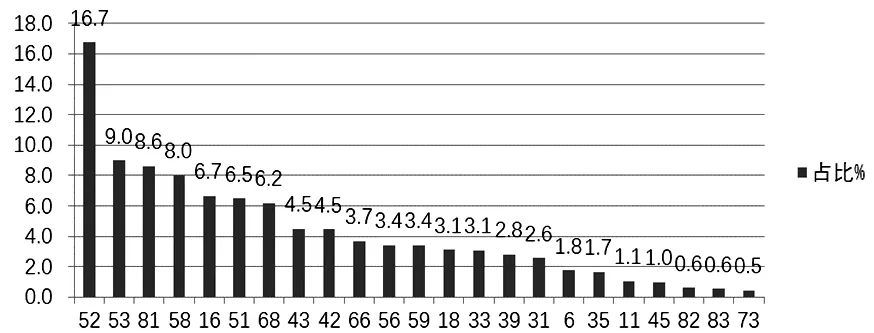
图1 2 137例HPV感染基因型别分布

表1 不同年龄组HPV感染情况[n(%)]
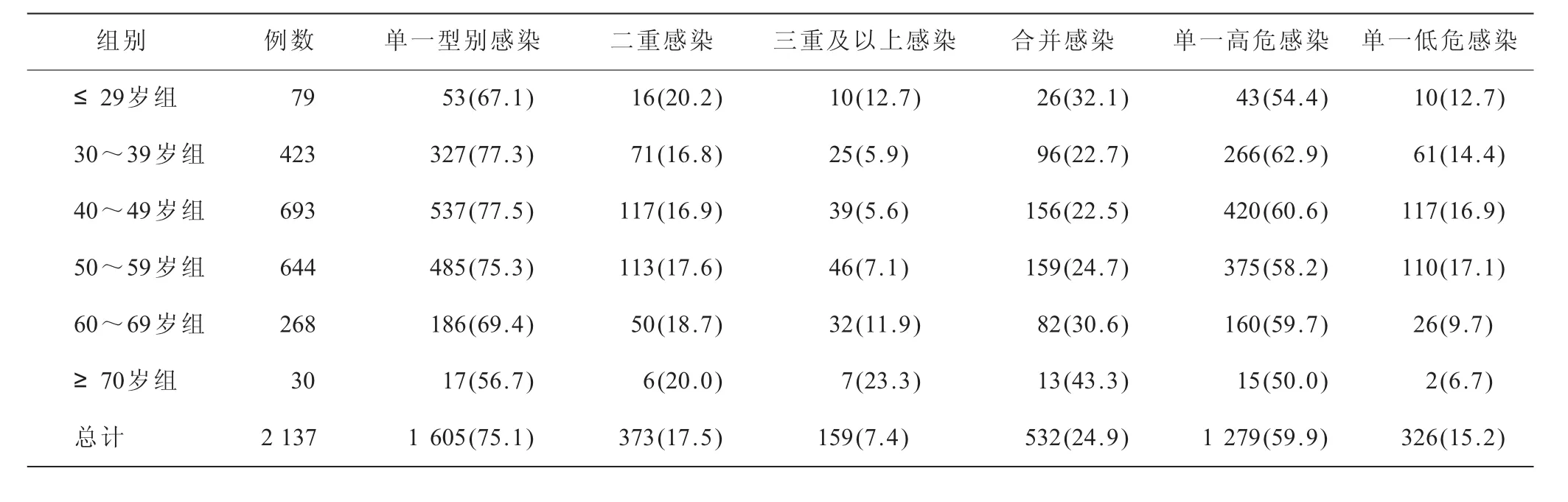
表2 不同年龄组HPV多型别基因感染情况[n(%)]
3 讨论
HPV病毒是一种DNA病毒,可通过性接触、间接接触、外伤感染和母婴传染等方式进行传播,其中性接触是近年来HPV传播的主要方式,有70%~80%的女性一生中至少感染过一次HPV,大部分的HPV感染都是一过性的,会在8~12个月内自行消退。本研究通过对成年女性健康体检数据进行分析,本研究群体的HPV感染率与其他文献报道的差异很大[4-5]。HPV感染主要受两个因素影响,其一是病毒接触,其二是宿主清除能力。30岁之前的女性阳性率出现一个高峰,与严鸣光等人对门诊就诊人群的HPV基因型分布特征相似[6],可能是该年龄段女性性生活比较活跃或者性伴侣多且不稳定[7]有关;30岁以后的女性趋于稳定,阳性率降低,到60~69岁出现第二个高峰,可能是随着年龄的增长,性生活活跃度下降,而且病毒清除能力下降,持续感染增多。70岁以后阳性率最低,而且多重感染升高,此年龄段女性性生活不活跃,接触病毒的概率低,但免疫力低下,一经感染难以自然清除。
HPV持续感染[8]宫颈上皮细胞,病毒染色体整合到宿主细胞基因组上[9]是造成浸润性宫颈癌和宫颈上皮内瘤变的主要原因[10],低危型HPV感染与性病和湿疣有关,高危型HPV感染与恶性病变有关[11],本研究发现,上海地区女性高危型HPV感染率高的型别分别是52、53、58、16、51、68、66、59、56、18、33、39、31、35、45、82、73;值得注意的是HPV52、53、58等有较高的感染率,排在前三位,而HPV18型感染率较低,排在第10位,阳性率3.1%。
宫颈癌的发生和发展主要是从宫颈上皮内瘤变到浸润性癌的过程,其有着连续性的特点,通常情况下,早期宫颈癌患者不会出现显著临床症状,若患者出现比较明显的症状,通常已经进展成了浸润癌,预后不佳。本研究对象均是健康体检人群,采用液基薄层细胞学联合HPV-DNA分型检测来筛查女性宫颈疾病,薄层液基细胞学是宫颈癌筛查常见的方法之一[12],但受限于取材、药物、制片等因素导致假阴性结果,因此,HPV-DNA检测在宫颈内瘤变及宫颈癌的筛查中有举足轻重的作用,对于连续两年以上高危HPV感染阳性的患者应进行阴道镜检查以尽早发现病变并进行治疗,并且针对本地区人群也可应用相应的疫苗提高HPV的防治效果。
