瑞舒伐他汀联合睾酮对T2DM合并CSA患者动脉斑块和血管内皮功能的影响
2020-05-18刘春燕陈云霞朱春景左云赵丹娜高哲王秋桐
刘春燕 陈云霞 朱春景 左云 赵丹娜 高哲 王秋桐
2型糖尿病(T2DM)是一种以高血糖为特征的慢性代谢性疾病,患者长期血糖异常易导致脂代谢紊乱和血管内皮受损,这些均是颈动脉粥样硬化(CAS)的高危因素[1]。研究表明,在T2DM及其心血管并发症发生发展过程中,患者体内睾酮含量逐渐降低,可作为心血管疾病的独立危险因素[2,3]。因此,睾酮补充治疗用于T2DM合并CAS患者有可能产生积极意义。本研究观察了瑞舒伐他汀联合睾酮补充治疗T2DM合并CAS的作用及对动脉斑块和血管内皮功能的影响,并从炎性反应和氧化应激角度进一步探讨其治疗机制。
1 资料与方法
1.1 一般资料 将2017年5月至2018年5月沧州市人民医院收治的T2DM合并CAS患者70例纳入研究范围,随机分为对照组和观察组,每组35例。对照组中,男20例,女15例;年龄31~59岁,平均(51.55±6.46)岁;病程≥5年19例,<5年16例,平均(8.12±1.14)年。观察组中,男19例,女16例;年龄32~57岁,平均(50.82±6.85)岁;病程≥5年20例,<5年15例,平均(9.00±1.25)年。2组基线资料比较差异无统计学意义(P>0.05),具有可比性。见表1。

表1 2组基线资料比较 n=35
1.2 纳入及排除标准
1.2.1 纳入标准:①均符合T2DM、CAS诊断标准[4,5];②发病24 h内入院,未接受过其他治疗者;③患者自愿加入本研究,且签署知情同意书。
1.2.2 排除标准:①合并重要脏器功能障碍者;②1型糖尿病患者;③严重外伤、感染、血液性疾病、免疫性疾病患者;④对本研究药物过敏者;⑤精神疾病患者。
1.3 治疗方法 2组均接受降糖、降脂、溶栓、饮食指导、运动锻炼等常规治疗。对照组给予瑞舒伐他汀片(英国阿斯利康制药有限公司)治疗,10 mg/次,1次/d,睡前服用;观察组在对照组基础上加用十一酸睾酮胶丸(南京欧加农制药有限公司)治疗,80 mg/次,2次/d,疗程3个月。
1.4 观察指标
1.4.1 标本采集:抽取患者空腹静脉血5 ml,离心后取血清待测。
1.4.2 性激素:采用放射免疫法测定血清总睾酮(TT)、性激素结合球蛋白(SHBG)含量。
1.4.3 颈动脉斑块:采用颈动脉彩色超声仪测定斑块面积、斑块数量、颈动脉内膜-中层厚度(IMT)、Crouse积分。
1.4.4 血管内皮功能:采用硝酸还原酶法测定血清一氧化氮(NO)含量;放射免疫法测定血清内皮素(ET-1)含量;血管彩超测定肱动脉血流介导的血管舒张功能(FMD)、含服硝酸甘油后FMD(NID)。
1.4.5 炎性因子:采用酶联免疫吸附实验(ELISA)测定血清白介素6(IL-6)、肿瘤坏死因子(TNF-α)、超敏C-反应蛋白(hs-CRP)含量。
1.4.6 氧化应激:采用ELISA测定血清丙二醛(MDA)、脂质过氧化物(LPO)、超氧化物歧化酶(SOD)含量。
1.5 疗效判定标准 显效:临床症状基本消失,斑块数量和面积减少>80%;有效:临床症状有所改善,斑块数量和面积减少50%~80%;无效:临床症状、斑块数量和面积无变化。总有效率=(显效+有效)例数/总例数×100%。
2 结果
2.1 2组临床疗效比较 治疗后,观察组总有效率明显高于对照组(P<0.05)。见表2。

表2 2组临床疗效比较 n=35,例
注:与对照组比较,*P<0.05
2.2 2组性激素比较 治疗前,2组TT、SHBG比较差异无统计学意义(P>0.05);治疗后,2组TT、SHBG均明显高于治疗前(P<0.05),且观察组TT、SHBG变化幅度大于对照组(P<0.05)。见表3。

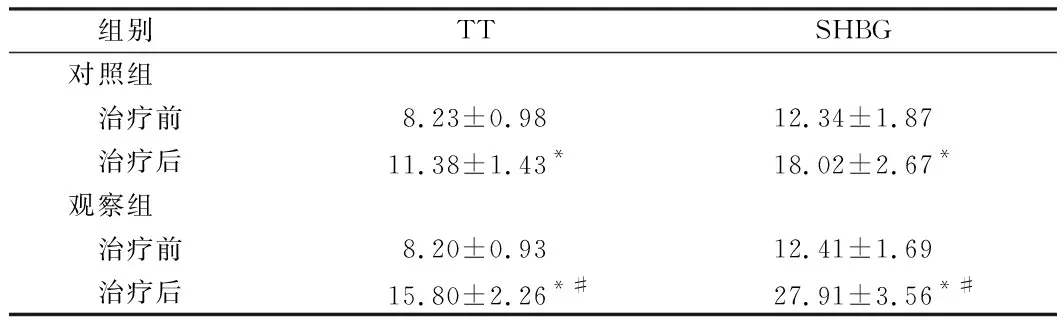
组别TTSHBG对照组 治疗前8.23±0.9812.34±1.87 治疗后11.38±1.43*18.02±2.67*观察组 治疗前8.20±0.9312.41±1.69 治疗后15.80±2.26*#27.91±3.56*#
注:与治疗前比较,*P<0.05;与对照组比较,#P<0.05
2.3 2组颈动脉斑块比较 治疗前,2组斑块面积、斑块数量、IMT、Crouse积分比较差异无统计学意义(P>0.05);治疗后,2组斑块面积、斑块数量、IMT、Crouse积分均明显低于治疗前(P<0.05),且观察组斑块面积、斑块数量、IMT、Crouse积分变化幅度大于对照组(P<0.05)。见表4。
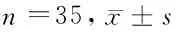

组别斑块面积(cm2)斑块数量(个)IMT(mm)Crouse积分(分)对照组 治疗前26.05±3.856.00±0.851.30±0.217.62±0.66 治疗后16.73±2.31*4.23±0.57*1.14±0.15*4.18±0.56*观察组 治疗前25.89±3.965.96±0.791.27±0.197.65±0.69 治疗后9.49±1.06*#1.99±0.32*#0.90±0.11*#2.70±0.45*#
注:与治疗前比较,*P<0.05;与对照组比较,#P<0.05
2.4 2组血管内皮功能比较 治疗前,2组NO、ET-1、FMD、NID比较差异无统计学意义(P>0.05);治疗后,2组ET-1均明显低于治疗前,NO、FMD、NID均明显高于治疗前(P<0.05),且观察组NO、ET-1、FMD、NID变化幅度大于对照组(P<0.05)。见表5。
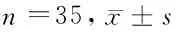

组别NO(μmol/L)ET-1(μmol/L)FMD(%)NID(%)对照组 治疗前23.45±3.7990.45±8.983.63±0.445.77±0.63 治疗后47.89±5.87*70.54±6.23*5.89±0.63*8.92±1.00*观察组 治疗前24.11±3.9987.88±9.453.60±0.485.79±0.73 治疗后68.65±8.34*#38.67±4.90*#9.60±0.95*#12.25±1.46*#
注:与治疗前比较,*P<0.05;与对照组比较,#P<0.05
2.5 2组炎性因子比较 治疗前,2组IL-6、TNF-α、hs-CRP比较差异无统计学意义(P>0.05);治疗后,2组IL-6、TNF-α、hs-CRP均明显低于治疗前(P<0.05),且观察组IL-6、TNF-α、hs-CRP变化幅度大于对照组(P<0.05)。见表6。
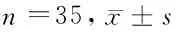
组别IL-6(pg/L)TNF-α(mg/L)hs-CRP(mg/L)对照组 治疗前33.43±4.5462.35±8.8721.35±2.54 治疗后23.87±3.27*41.56±6.23*15.26±2.16*观察组 治疗前34.12±4.6760.77±9.2023.00±3.14 治疗后9.67±1.12*#18.37±2.72*#7.56±0.88*#
注:与治疗前比较,*P<0.05;与对照组比较,#P<0.05
2.6 2组氧化应激比较 治疗前,2组MDA、LPO、SOD比较差异无统计学意义(P>0.05);治疗后,2组MDA、LPO均明显低于治疗前,SOD均明显高于治疗前(P<0.05),且观察组MDA、LPO、SOD变化幅度大于对照组(P<0.05)。见表7。

组别MDA(μmol/ml)LPO(μmol/L)SOD(U/L)对照组 治疗前6.24±0.855.98±0.7262.35±7.38 治疗后4.48±0.63*4.11±0.53*75.68±9.33*观察组 治疗前6.18±0.775.94±0.6863.26±8.12 治疗后2.10±0.32*#2.04±0.28*#89.09±10.23*#
注:与治疗前比较,*P<0.05;与对照组比较,#P<0.05
3 讨论
T2DM是由于胰岛素分泌缺陷或胰岛素信号受损引起的终身性代谢性疾病,随着病程延长和疾病进展,患者动脉内膜下脂质沉积、毛细血管基膜增厚,逐渐发展至动脉粥样硬化(AS),从而导致心、脑、肾等重要脏器缺血[6,7]。IMT是反映AS程度的常用指标,与T2DM患者心血管事件发生风险密切相关[8]。临床研究证实,T2DM合并AS患者IMT、斑块面积等指标显著高于正常人,且其心血管事件发生风险较单纯AS患者增加2~4倍,病死率也随之升高[9]。因此,在降糖、降脂同时遏制或逆转AS形成及发展对于改善T2DM患者预后至关重要。
有研究发现,T2DM导致的心血管病变与多种因素有关,其中性激素含量降低是T2DM及其并发症发生发展的独立危险因素[10]。多项研究表明,T2DM患者体内TT含量降低,通过影响糖脂代谢过程最终导致胰岛素抵抗发生发展,且睾酮补充治疗后胰岛素抵抗指数明显下降[11,12]。另有资料表明,生理水平的TT通过调节血管舒张、抑制血管炎性反应、降低外周阻力等机制延缓AS发生发展[13]。Bourghardt等[14]发现切除睾丸组织的模型大鼠AS斑块形成增加,相反补充TT含量则能够减少AS斑块数量。但睾酮补充治疗是否能够用于T2DM及其心血管并发症的临床治疗中目前尚存在争议。本研究对T2DM合并CAS患者采用瑞舒伐他汀联合睾酮补充治疗,结果显示,治疗后,观察组总有效率明显高于对照组(P<0.05);治疗前,2组TT、SHBG、斑块面积、斑块数量、IMT、Crouse积分、NO、ET-1、FMD、NID比较差异无统计学意义(P>0.05);治疗后,2组TT、SHBG、NO、FMD、NID均明显高于治疗前,斑块面积、斑块数量、IMT、Crouse积分、ET-1均明显低于治疗前(P<0.05),且观察组上述指标变化幅度大于对照组(P<0.05)。说明在他汀类药物降脂同时辅助睾酮补充治疗能够有效稳定动脉斑块,保护血管内皮功能,从而提高治疗效果。但是,联合用药发挥治疗作用的机制尚不清楚。
IL-6是活化的T细胞、成纤维细胞分泌的一种致炎因子,具有促进T、B淋巴细胞活化、增殖等作用;TNF-α具有促进中性粒细胞吞噬、诱导胰岛素抵抗等作用;hs-CRP是一种急性期反应蛋白,可作为反映炎性反应程度和心血管事件发生风险的敏感指标[15]。且资料表明,IL-6、TNF-α、hs-CRP与血清睾酮水平具有负相关性,而采用睾酮补充治疗能够有效降低心血管疾病患者血清炎症因子含量,进而抑制AS发生发展[16,17]。另外,氧化应激是T2DM患者胰岛素抵抗、血管内皮损伤的重要病理机制之一。其中MDA、LPO是反映氧化应激损伤程度的主要指标,而SOD是机体发挥抗氧化作用的酶。本研究结果显示,治疗前,2组IL-6、TNF-α、hs-CRP、MDA、LPO、SOD比较差异无统计学意义(P>0.05);治疗后,2组SOD均明显高于治疗前,IL-6、TNF-α、hs-CRP、MDA、LPO均明显低于治疗前(P<0.05),且观察组上述指标变化幅度大于对照组(P<0.05)。提示瑞舒伐他汀联合睾酮补充治疗T2DM合并CAS能够显著减轻患者机体炎性反应和氧化应激,这可能是其抑制斑块形成并保护血管内皮功能的可能机制之一。
综上所述,瑞舒伐他汀联合睾酮补充治疗T2DM合并CAS疗效显著,能够有效提高性激素含量,稳定斑块并保护血管内皮功能,其机制与抑制炎性反应和氧化应激有关。
