益气化湿通络方对实验性肾功能衰竭大鼠肾脏氧化应激损伤及纤维化的改善作用*
2020-05-18朱晓婷陈志强
朱晓婷,陈志强
(1.河北中医学院 石家庄 050200;2.河北省中医院,石家庄 050200;3.唐山市人民医院,河北 唐山 063000)
肾脏纤维化是慢性肾功能衰竭(chronic renal failure,CRF)的病理改变,是肾小球、肾间质在损伤情况下的形态学表现。随着纤维化的进展,肾功能逐渐丧失至衰竭,而发展成为终末期肾病(end-stage renal disease,ESRD)[1]。研究证实[2],CRF患者存在促氧化状态(pro-oxidant state),氧化应激在病情进展,加重纤维化进程中起关键作用。Hoffman[3]等发现大多数肾病患者存在线粒体功能障碍,随之产生氧化应激,致组织损伤,进展为CRF。氧化应激还可引起TGF-β1的表达增加[4],而TGF-β1蛋白是一种可以通过多种途径促进Ι型和Ⅲ型胶原分泌而增加细胞外基质(ECM)合成,引起肾小球硬化的促纤维化因子。Keap1-Nrf2-ARE信号通路[5]是重要的内源性抗氧化应激通路,具有潜在的抗氧化治疗的临床研究价值。本实验将探讨Nrf2/Keap1信号通路、TGF-β1蛋白与CRF氧化应激、纤维化进程的关系及可能的分子机制。
目前关于CRF患者的临床治疗方法,诊疗指南指出[6]:联合用药及饮食控制。在CRF早、中期主要是保守治疗及针对并发症的治疗等,当发展到GFR﹤15 ml/(min·1.73 m2)时,应实施透析及肾移植等肾脏替代治疗。但临床疗效并不理想。YHT是根据临床经验拟定的经验方,能够有效改善CRF患者症状并延缓其进入透析及肾移植等晚期阶段的进程[7]。本研究采用5/6肾切除大鼠创建的CRF模型,是考虑临床患者肾衰发生发展的整个病理进程与此模型造成的肾功能损伤、病理形态学改变具有高度相似性[8],对此模型的干预具有临床针对性和实际意义。YHT对此肾衰大鼠模型的残存肾脏功能损伤的改善作用及对肾脏纤维化的治疗作用的机制探讨,为传统医学治疗CRF及其并发症提供了进一步可靠的实验依据。
1 材料与方法
1.1 主要试剂与仪器
益气化湿通络方:黄芪25 g、当归12 g、川芎10 g、红花10 g、地龙10 g、水蛭3 g、仙茅10 g、仙灵脾12 g、藿香6 g、佩兰6 g、陈皮12 g、白豆蔻6 g、土茯苓30 g、积雪草30 g组成。中药颗粒剂(广东一方制药有限公司);盐酸贝那普利片(商品名:洛丁新,购于北京诺华制药有限公司);HE试剂盒和SOD、MDA试剂盒(北京博奥森生物技术有限公司);BCA法蛋白定量试剂盒(杭州联科生物技术有限公司);Keap1、Nrf2、NOX4、TGF-β1、collagenl抗体,均购自美国Abcam公司;其余试剂均购自武汉赛维尔生物科技有限公司;酶标检测仪(Rayto)、冷冻离心机(heal force)、扫描仪(EPSON)、双垂直电泳仪(北京六一仪器厂)、转印电泳仪(北京六一仪器厂)。
1.2 实验动物及分组
50只雄性SD成年大鼠,购自北京维通利华实验动物技术有限公司,体重(240±20)g,适应性饲养一周后随机分成两组:造模组40只、假手术组10只。在动物正常休息的白天进行造模,采用Platt法建立5/6肾切除慢性肾衰大鼠模型。用10%水合氯醛(0.35 ml/100 g)腹腔注射麻醉大鼠,使大鼠俯卧从距左脊骨1.5 cm处做外上方切口约1 cm,经后腹膜暴露肾脏,分离肾周脂肪,剥离肾包膜,迅速切除上下极及左肾外侧缘约2/3肾组织,用明胶海绵压迫止血、复位、缝合,1周后切除整个右肾,两次手术共切除5/6肾组织。假手术组只进行剥离两侧肾包膜操作,不切除肾脏。造模后每周大鼠目内眦取血,分离血清检测Scr、BUN含量,其均值显著高于假手术组均值(P<0.01)认为造模成功。(文献显示一般在造模后2周造模成功)[8]。本实验在造模后第二周抽检模型组和假手术组血清Scr、BUN时,模型组均值明显高于假手术组(P<0.01),造模成功。造模过程中死亡18只,造模组剩余24只,假手术组剩余8只,将24只模型大鼠随机抽样分为3组(n=8),Model组、YHT组、BH组。YHT组:将免煎颗粒加入80℃去离子水制成水溶液灌胃,(0.276 g/100 g/d,按1 ml/100 g的剂量,以中药药理研究方法学的大鼠与人药物剂量折算方法折算给药剂量);BH组去离子水溶解贝那普利片(0.09 mg/100 g,1 ml/100 g)灌胃;Sham和Model生理盐水灌胃(1 ml/100 g)。分组后次日即开始灌胃治疗,每天1次,连续12周为疗程结束。治疗结束后代谢笼留取24 h尿液,所有大鼠均麻醉(水合氯醛)腹主动脉取血分离血清,摘取左侧肾脏一部分保存于-80℃冰箱中,一部分保存于4%多聚甲醛中固定,留待检测。
1.3 尿液中24 h尿蛋白测定
第12周治疗结束时收集24 h尿液,计量尿量,通过BCA法蛋白定量试剂盒测定24 h尿蛋白含量。
1.4 血清中肾功能指标测定
第12周治疗结束,麻醉大鼠后,腹主动脉取血(不抗凝),离心分离出血清,通过生化分析仪测定血清中BUN、SCr含量。
1.5 组织病理学观察
第12周治疗结束留取血清后,剖杀大鼠取出左肾并用4%多聚甲醛固定,脱水、石蜡包埋、切片,进行HE、Masson染色,光镜下观察组织病理学变化。
1.6 肾组织匀浆抗氧化酶(SOD)活性和MDA含量测定
第12周治疗结束后取左肾脏组织、加入适量冷裂解液行研磨匀浆,离心(12 000 r/min 15 min)取上清液,按试剂盒说明,通过比色法测定肾脏组织SOD活性和MDA含量。
1.7 Western blot检测Nrf2、Keap1、Nox4、TGF-β1、Collagen1的蛋白表达
取左肾组织,按100 mg/ml加入蛋白裂解液,经组织研磨仪破碎组织后,离心(15 min,4℃)取上清液,用BCA测定蛋白浓度。以50 μg蛋白加入2.5 μl的sample buffer,振荡均匀,置于水浴槽,100℃水浴5 min变性,留待电泳。电泳(电泳仪设置电泳条件80 V,40 min;160 V,90 min)完成后,进行湿转(湿转仪设置湿转条件300 mA,90 min)。按Maker裁剪相应目的蛋白的条带,放置于孵育盒中,5%脱脂牛奶封闭蛋白条带90 min,用TBST清洗三次,每次15 min,加入一抗(1∶1 000)4℃孵育过夜。次日,TBST清洗三次,每次15 min,加入相应二抗(1∶5 000)孵育90 min。TBST清洗三次,每次15 min,应用Fusion FX5 Spectra多功能成像系统(法国Viber公司)发光显色并拍照。采用Quantity One分析软件对每个蛋白的含量进行灰度测定分析。
1.8 荧光检测Nrf2在细胞核内的表达
石蜡切片经脱蜡、梯度酒精复水后,抗原修复、然后漂洗、湿盒内封闭,一抗染色:过夜。加荧光标记的二抗,防荧光淬灭封片剂封片,在荧光显微镜下观察拍照。
1.9 统计学处理
2 结果
2.1 益气化湿通络方对肾衰模型大鼠肾功能的影响
与Sham组相比,Model组大鼠肾功能明显受损。与Model组相比,YHT组肾功能得到改善,能够明显降低大鼠的BUN、SCr、24 h尿蛋白水平,差异具有统计学意义(P<0.01)。YHT组与BH组比较,BUN、SCr、24h尿蛋白未表现出显著差异(表1)。
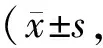

GroupScr(μmol/L)BUN(mg/dl)24hurineprotein(mg/24h)Sham38.67±5.525.98±1.150.010±0.003Model70.00±11.52##10.47±2.11##0.030±0.009##BH53.20±54.29∗8.94±0.90∗∗0.020±0.010∗∗YHT48.00±4.85∗∗6.66±0.96∗∗0.020±0.012∗∗
YHT: Yiqi huashi tongluo Formula; BH: Benazepril hydrochloride
*P<0.05,**P<0.01vsmodel group;##P<0.01vssham group
2.2 益气化湿通络方对5/6肾切除慢性肾衰大鼠残存肾脏组织病理学的影响
HE染色结果显示,Sham组大鼠肾脏结构及病理无明显异常,少量炎症细胞浸润,肾小球结构正常。Model组显示局部肾小球不同程度阶段性萎缩、硬化,系膜细胞及系膜基质增生明显,膜细胞及系膜基质增生明显,并有大量炎症细胞浸润。与Model相比YHT组、BH组有明显改善,病灶区域减少,系膜细胞及系膜基质增生程度和肾小球硬化程度减轻(图1,见彩图页Ⅰ)。
Masson染色结果显示,Sham组没有明显纤维化的表现,胶原染色呈淡蓝色。Model组大鼠肾脏胶原沉积于肾小球、肾间质,弥漫性分布。与Model组相比,YHT组、BH组肾小球、肾间质有丝状胶原沉积(图2,见彩图页Ⅰ)。
2.3 益气化湿通络方对肾脏组织SOD活性和MDA含量的影响
与Sham组相比,Model大鼠肾组织中SOD活性降低和MDA含量升高,与Model组相比,YHT组大鼠的肾脏组织SOD活性增加和MDA含量下降,差异具有统计学意义(P<0.01)。YHT组与BH组比较,未表现出显著差异(表2)。
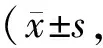

GroupSOD(U/mgprot)MDA(nmol/mgprot)Sham216.3±16.41.76±0.22Model144.3±7.0##3.80±0.44##BH180.2±6.4∗∗2.20±0.18∗∗YHT184.7±13.4∗∗2.16±0.64∗∗
**P<0.01vsmodel group;##P<0.01vssham group
2.4 益气化湿通络方对肾组织中Nrf2、Keap1、Nox4的蛋白表达水平的影响
与Sham组相比,Model组大鼠肾组织中,Nrf2蛋白表达水平降低,Keap1、Nox4蛋白表达水平升高;与Model组相比经过YHT处理后能使Nrf2蛋白表达水平升高,Keap1、Nox4蛋白表达水平减少,差异具有统计学意义(P<0.01,图3,表3)。YHT组与BH组比较,未表现出显著差异。

Fig. 3 Effects of Yiqi Huashi Tongluo Formula on the protein expression levels of Nrf2 Keap1 and Nox4 in renal tissue of rats
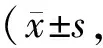
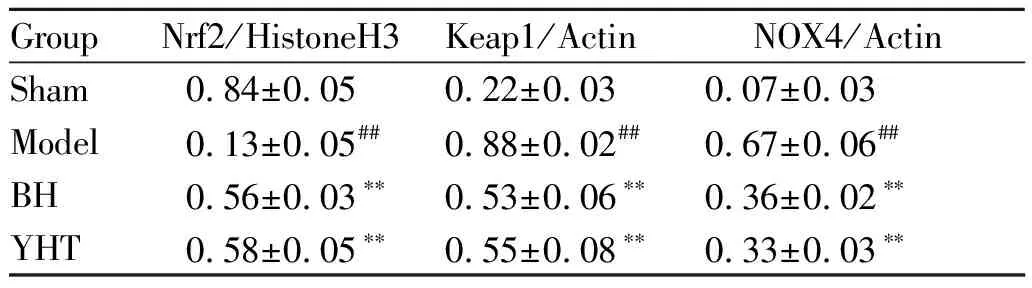
GroupNrf2/HistoneH3Keap1/ActinNOX4/ActinSham0.84±0.050.22±0.030.07±0.03Model0.13±0.05##0.88±0.02##0.67±0.06##BH0.56±0.03∗∗0.53±0.06∗∗0.36±0.02∗∗YHT0.58±0.05∗∗0.55±0.08∗∗0.33±0.03∗∗
**P<0.01vsmodel group;##P<0.01vssham group
2.5 益气化湿通络方对肾组织中TGF-β1、Collagen1的蛋白表达水平的影响
与Sham组相比,Model组大鼠肾组织中,TGF-β1、Collagen1蛋白表达水平升高;与Model组相比,经过YHT处理后能使TGF-β1、Collagen1的蛋白表达水平下降,差异具有统计学意义(P<0.01,图4,表4)。YHT组与BH组比较,未表现出显著差异。
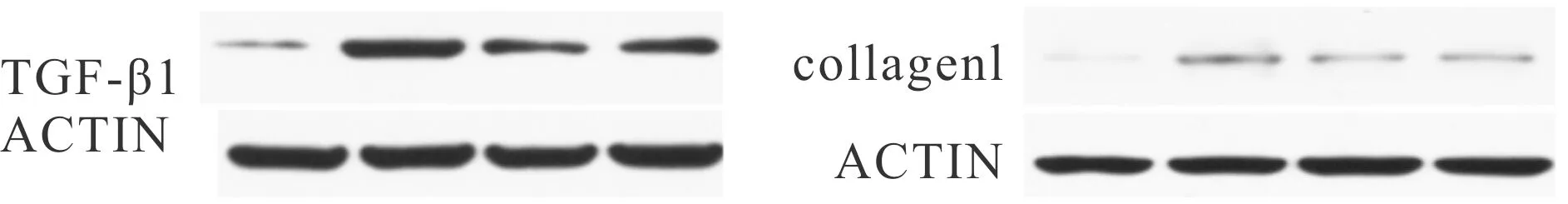
Fig. 4 Effects of Yiqi Huashi Tongluo Formula on the protein expression levels of TGF-β1 and collagenl inrenal tissue of rats
**P<0.01vsmodel group;##P<0.01vssham group
2.6 荧光检测Nrf2在细胞内的表达
免疫荧光结果(图5)显示,与Sham组相比较Model组肾组织细胞核内Nrf2蛋白的表达明显减少,YHT组、BH组较Model组Nrf2的表达增多明显(图中放大的小图指示为Nrf2入核的荧光表现,图5见彩图页Ⅱ)。
3 讨论
肾脏纤维化是ECM过度积累的结果,是CRF发展的主要病理变化之一。伴随ECM大量沉积、肾固有细胞消失,肾小球滤过功能下降、代谢紊乱等病情出现并不断加重,最终整个肾脏出现不可逆损伤,直至衰竭,发展成为CRF[1]。本研究建立5/6肾切除慢性肾衰大鼠模型,残肾出现肾小球、肾小管,间质的增生、纤维化、萎缩、硬化等病理改变。残肾高灌注、高滤过和高压力,超负荷运作,致使残存肾单位进行性丧失,出现肾脏不可逆损伤直至衰竭,与临床患者肾衰发生发展的整个进程相符合[8]。
益气化湿通络方以中医辨证结合CRF的病理特征论治,将氧化应激的产物与中医湿浊、邪毒、瘀积相联系。运用泄浊化毒中药(藿香、佩兰、陈皮、白豆蔻、土茯苓、积雪草)治疗。CRF患者肾脏纤维化引起功能代谢下降的复杂病症,以泻浊化瘀通络中药(当归、川芎、红花、地龙、水蛭)治疗。CRF患者久病体虚,以益气健脾补肾中药(黄芪、仙茅、仙灵脾)治疗。YHT有效地改善CRF患者因病理变化、功能代谢下降等引起的临床症状。
氧化应激是CRF病情进展的一项重要诱因,贯穿疾病始终。研究证明[9]氧化应激可直接使肾小球基底膜过氧化,通透性增加,诱导足细胞凋亡,增加细胞外基质累积,加快肾脏纤维化。CRF病程中存在活性氧(ROS)的损伤,ROS使脂质分解而形成MDA,MDA随着过氧化反应增多而升高,引起氧自由基增多,氧自由基损伤肾脏。ROS还可影响内皮细胞转化为间充质细胞(EMT),从而使得成纤维细胞表达增加,进而损伤肾小球系膜细胞,加速肾脏纤维化。SOD可阻断ROS造成的损害[10]。但CRF中SOD等抗氧化作用显著降低。本研究检测肾衰模型大鼠残肾,发现MDA产生增多,SOD活性下降,提示此模型存在氧化应激反应增强而抗氧化反应减弱。
抗氧化应激是影响肾脏纤维化的关键调节反应[11-12]。激活抗氧化应激的重要通路,Nrf2-Keap1通路,可影响ROS的表达,从而减轻肾损伤,减缓肾纤维化的进程。Nrf2是重要的氧化还原转录因子。其活性主要受Keap1的调控[13]。正常条件下,Nrf2通过keap1介导的cullin-3(Cul3),依赖泛素化持续降解并向蛋白酶体转移而保持稳定。然而,在氧化应激条件下,Nrf2脱离Keap1的控制,进入细胞核,增加抗氧化反应元件(ARE)靶基因的表达,这些靶基因编码调控下游抗氧化蛋白的表达[14]。Nox4[15]是下游抗氧化蛋白中的一种,当机体遭受损伤,Nrf2上调Nox4,增加机体抗氧化损伤的能力,从而减轻损伤,减缓CRF进程。另外,Nrf2、Nox4均可通过阻抑TGF-β1的表达而减轻纤维化[16-17]。TGF-β1被公认是导致CRF、肾纤维化的一个强有力的中介。TGF-β1与EMT在肾小管细胞的表达及肾组织中ECM积累密切相关,TGF-β1诱导EMT及直接刺激ECM蛋白质如胶原、纤粘连蛋白的表达,加剧了肾脏损伤及纤维化的进程。激活Nrf2-Keap1信号通路不但减轻氧化应激带来的直接损伤,并使TGF-β1表达减少,达到阻抑肾脏损伤及纤维化进程的效果。因此激活Nrf2-Keap1通路是保护肾脏的有效方法[18]。
本研究发现,经YHT或BH治疗后肾衰竭模型大鼠肾脏损伤、纤维化程度均明显减轻(图1,2)。BUN、SCr、24 h尿蛋白水平明显降低(表1)。SOD活性增加、MDA含量降低(表2)。这些结果表明残余肾脏肾功能得到改善,氧化应激现象得到缓解。YHT治疗后Nrf2在细胞核内表达水平升高,说明组织抗氧化能力增强,Keap1、Nox4、TGF-β1、Collagen1的蛋白表达水平明显下降(图3,4,5),表明YHT有效地减轻了残肾的氧化应激反应及纤维化进程,机制可能是YHT激活了抗氧化应激通路Nrf2-Keap1及下调TGF-β1蛋白的表达。
本实验结果还显示YHT与BH治疗效果相当。有研究指出[19,20],ACEI类药物可通过抑制肾衰模型大鼠的NAD(P)H氧化酶,继而上调Nrf2,而改善肾脏的氧化应激和肾功能,减缓CRF进展。本研究从分子机制层次证实YHT有类似于ACEI类药物的作用机制,可通过影响Nrf2/Keap1信号通路减轻残肾组织的氧化应激反应,增强抗氧化能力,减轻肾纤维化,为寻找YHT的临床疗效作用的分子靶点提供依据。
综上所述,本研究证实5/6肾切除慢性肾衰大鼠模型存在氧化应激及肾纤维化,肾功能障碍。YHT可能是通过影响Nrf2/Keap1信号通路,下调TGF-β1蛋白表达,从而改善CRF大鼠因氧化应激及肾脏纤维化引起的结构功能损伤,改善肾功能保护肾脏,为CRF及并发症的中医药防治提供新的思路与试验依据。
