纳米二氧化铈对神经细胞PC12及SH-SY5Y活力的影响*
2020-05-18许逸岚赵镘娜朱诗涵韩瑜颖章佳瑜沈铄恒俞樟森
许逸岚,赵镘娜,朱诗涵,韩瑜颖,章佳瑜,沈铄恒,俞樟森,张 衡
(绍兴文理学院医学院基础医学部,浙江 绍兴 312000)
近年来,纳米材料由于其独特的表面效应、小粒径、高反应活性、强吸附能力等倍受关注[1],其抗氧化性是新型抗氧化药物研发的一大关注点。其中,二氧化铈(Ceria,CeO2)纳米材料因优异的氧化还原能力在生物抗氧化领域应用最为广泛。它独特的萤石立方结构,使铈离子可以在+3和+4两种价态间可逆转换, 从而实现氧的储存和释放[2-4]。将CeO2的尺寸从体相减小至纳米尺度后,能使其催化活性增强,成为具有良好水溶性和生物相容性的高效抗氧化材料[5]。
然而纳米CeO2能否应用于治疗疾病却一直存在较大争议。Azari等[6]人发现,纳米CeO2能够减轻丙烯酰胺诱导的细胞氧化损伤。Wang等[7]人研究证明,CeO2纳米颗粒可以保护INS-1细胞免受H2O2诱导的氧化应激损伤,表明其在糖尿病治疗中具有潜在应用价值。Wahba等[8]人发现,GAL@Ce-HAp可以下调阿尔茨海默症(Alzheimer’s disease, AD)大鼠脑中的氧化应激标记物,抑制其海马中的神经元退化。然而,俞淼等[9]人研究发现,CeO2-SFPM能够导致小鼠单核巨噬细胞发生凋亡。Monika等[10]人发现,纳米CeO2能够诱发IMR32细胞氧化应激反应,产生一定的毒性。欧阳璐等[11]人研究发现,纳米CeO2对大鼠具有一定的肺毒性,能够导致其肺发生纤维化。之前有报道表明,纳米二氧化硅(SiO2)能够通过抑制海马齿状回长时程增强,导致大鼠的学习记忆损伤[12]。因此,对纳米材料的毒性研究至关重要。本研究选用模拟神经细胞系SH-SY5Y细胞与PC12细胞为研究样本,探讨纳米CeO2对两细胞系的细胞活力的影响,为今后进一步修饰纳米CeO2,从而运用于神经退行性疾病如阿尔茨海默病的治疗提供一定理论基础。
1 材料与方法
1.1 仪器
二氧化碳培养箱(上海力申科学仪器有限公司),荧光倒置显微镜(MODEL IX70-S1F2,日本OLYMPUS公司),磁力搅拌器(河南爱博特科技发展有限公司),酶标仪(美国BIO RAD公司),透射电子显微镜(日本电子公司),X-射线衍射仪(荷兰帕纳科公司)
1.2 试剂
胎牛血清(Gibco公司),DMEM 培养基(Hyclone公司)、胰蛋白酶(biosharp公司),青霉素及链霉素(上海吉诺公司),DMSO(碧云天公司),噻唑蓝溴化四唑(MTT试剂,阿拉丁公司),活性氧检测试剂盒(碧云天公司),硝酸铈六水合物(阿拉丁公司),聚乙二醇(阿拉丁公司),乙二醇(阿拉丁公司),氢氧化钠(阿拉丁公司)
1.3 纳米CeO2的合成及表征
称取0.326 g(0.75 mmol)Ce(NO3)3·6H2O、1.0 g PEG置于烧杯中,加入15 ml乙二醇,磁力搅拌器搅拌并加热至60℃溶解,直至反应液完全澄清。然后加入0.06 g(1.5 mmol)NaOH,继续搅拌30 min。再加入25 ml乙二醇继续搅拌10 min,将全部溶液转移至反应釜中,将反应釜置于180℃的烘箱中反应24 h。反应产物经12 000 r/min离心20 min,并用去离子水洗涤,离心、洗涤3次后,将产物分散于PBS溶液中,4℃保存备用。利用透射电子显微镜(TEM)和X-射线衍射仪(XRD)对得到的纳米CeO2进行表征。利用纳米CeO2与3%H2O2发生氧化还原反应,溶液颜色是否发生变化,进行其抗氧化性能初步评估。
1.4 细胞培养
人神经母细胞瘤细胞SH-SY5Y和大鼠嗜铬细胞瘤细胞PC12(来源于浙江大学孙秉贵教授实验室)分别接种于含有10% 胎牛血清和 1% 双抗(青霉素 105U/L,链霉素 105U/L)的 DMEM培养基中,放入37℃,5% CO2培养箱中培养。当细胞贴壁生长到 80%~90% 后用胰蛋白酶消化传代至新的培养瓶中。
1.5 MTT实验检测细胞活力
取处于对数生长期的SY5Y和PC12细胞,用磷酸盐缓冲液洗涤,经胰酶消化后,用含有 10% 胎牛血清和 1% 双抗的DMEM培养液悬浮细胞,并将细胞的密度调整为1×105cells/ml,分别接种于96孔细胞培养板中(每孔100 μl),将细胞置于37℃,5% CO2培养箱中培养。细胞过夜培养至合适密度,分别用不同浓度的纳米CeO2(终浓度为1、2.5、5、10、25、50、75、100、150 μg/ml)处理细胞,每个浓度分别设置5个复孔,另设对照组(加入等量培养液处理细胞)。加药后24 h时,向各个培养孔中加入MTT溶液(5 mg/ml)10 μl /孔,37℃孵育4 h,弃去上清后,每孔加入150 μl DMSO,用酶标仪检测490 nm处吸光度值(OD)。
1.6 DCFH-DA探针法检测细胞内ROS
取处于对数生长期的SH-SY5Y和PC12细胞,用磷酸盐缓冲液洗涤,经胰酶消化后,用含有 10% 胎牛血清和 1% 双抗的DMEM培养液悬浮细胞,并将细胞的密度调整为2×104cells/ml,分别接种于24孔细胞培养板中(每孔500 μl),将细胞置于37℃,5% CO2培养箱中培养。细胞过夜培养至合适密度,分别用不同浓度的纳米CeO2(终浓度为25、50、75、100 μg/ml)作用于细胞,每个浓度分别设置4个复孔,另设对照组(加入等量培养液处理细胞)、CeO2(终浓度为100 μg/ml)+活性氧清除剂NAC(5 mmol/L)共同处理组,加药24 h后,吸去孔板中培养液,并在每孔中加入浓度为10 μmol/L的 DCFH-DA探针150 μl,置于37℃细胞培养箱内孵育20 min后,用无血清细胞培养液洗涤细胞2次,最后置于荧光显微镜下观察,并选定26~33个视野观察区域统计分析不同组别单个视野观察区域细胞的平均数目用于表征细胞活力,进行统计分析。
1.7 统计学处理
统计处理用GraphPad Prism 5.0软件进行分析,各组采用单因素方差(one-way ANOVA)分析,并用Newman-Keuls检验进行组间比较。
2 结果
2.1 纳米CeO2的表征
透射电子显微镜检测纳米CeO2的形态及粒径分布,其颗粒近似圆球形,有凝集现象,粒径大小均匀(图1)。然后分别加入5 μl、10 μl和20 μl的浓度为3%H2O2与纳米CeO2反应,可见颜色明显发生改变,表明两者之间发生了氧化还原反应,CeO2具有一定的抗氧化能力(图2)。利用X-射线衍射仪对纳米CeO2进行物相鉴定(图3),所制备纳米CeO2的衍射峰主要位于立体萤石结构的(111)、(200)、(220)、(311)晶面,无其他杂峰存在,表明样品为纯CeO2颗粒,无其他杂质存在。

Fig. 1 TEM micrograph of CeO2nanoparticles

Fig. 2 The effect of CeO2nanoparticles on H2O2

Fig. 3 XRD patterns of CeO2nanoparticles
2.2 纳米CeO2对SH-SY5Y和PC12细胞活力的影响
MTT法检测结果显示(表1),纳米CeO2对SH-SY5Y细胞的活力有明显的抑制作用,在一定范围内,纳米CeO2对SH-SY5Y细胞活力的抑制作用与它的浓度成正比,在纳米CeO2浓度达到25 μg/ml时,它对细胞活力的抑制作用不再随浓度的增加而增强。
MTT法检测结果显示(表1),纳米CeO2对PC12细胞的活力有类似于SH-SY5Y细胞的明显抑制作用,不同浓度的纳米CeO2对PC12细胞活力的抑制与对照组相比差异明显,但各浓度组之间作用无明显差异。
2.3 纳米CeO2对诱导SH-SY5Y细胞和PC12细胞产生ROS的影响
用不同浓度的纳米CeO2(终浓度为25、50、75、100 μg/ml)作用于细胞,并设置对照组(加入等量培养液处理细胞)、活性氧清除剂NAC预孵育100 μg/ml CeO2处理组,处理24 h后,经过DCFH-DA探针染色后,置于荧光倒置显微镜下观察各组细胞荧光强度(图4),结果表明,随着纳米CeO2浓度的增加,SH-SY5Y细胞荧光的强度不断增加,而加入活性氧清除剂NAC后,荧光强度明显下降,表明在CeO2处理细胞的过程中,诱导了ROS的产生。
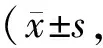

CellControl 12.5510255075100150SH-SY5Y97.33±2.22 -83.65±4.89∗∗77.69±5.88∗∗#75.38±4.02∗∗##70.43±1.99∗∗##69.17±3.60∗∗69.72±2.29∗∗65.42±2.89∗∗65.57±1.30∗∗PC1294.82±3.6778.14±3.50∗∗73.27±5.59∗∗74.70±4.25∗∗71.37±1.18∗∗73.46±8.36∗∗69.79±3.24∗∗75.55±5.43∗∗70.83±1.42∗∗78.76±1.47∗∗
**P<0.01vscontrol;#P<0.05,##P<0.01vs2.5
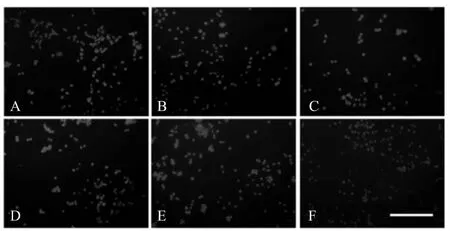
Fig. 4 ROS fluorescent staining of SH-SY5Y cells(DCFH-DA staining ×100)
A: Control; B: 25 μg/ml CeO2; C: 50 μg/ml CeO2; D: 75 μg/ml CeO2; E: 100 μg/ml CeO2; F: 100 μg/ml CeO2+NAC
经过DCFH-DA探针染色后,置于荧光倒置显微镜下观察各组细胞荧光强度(图5),随着纳米CeO2浓度的增加,PC12细胞荧光的强度不断增加,加入活性氧清除剂NAC,细胞的荧光强度有一定程度下降。显微镜下显示,不同浓度的纳米CeO2对PC12细胞的形态有影响,且浓度越大,细胞形态的改变程度越大。加入活性氧清除剂NAC后,PC12细胞形态在一定程度上恢复正常。

Fig. 5 ROS fluorescent staining of PC12 cells(DCFH-DA staining ×100)
A: Control; B: 25 μg/ml CeO2; C: 50 μg/ml CeO2; D: 75 μg/ml CeO2; E: 100 μg/ml CeO2; F: 100 μg/ml CeO2+NAC
2.4 活性氧清除剂NAC不影响纳米CeO2对SH-SY5Y细胞活力抑制
经过不同浓度纳米CeO2处理后,在显微镜下统计SH-SY5Y细胞的数目,选定26~31个视野观察区域统计分析不同组别单个视野观察区域细胞的平均数目用于表征细胞活力,发现纳米CeO2对SH-SY5Y细胞活力有明显抑制作用(表2)。CeO2超过50 μg/ml抑制作用达到平台期。NAC与纳米CeO2共同处理后,统计分析后,发现SH-SY5Y细胞数量与单独CeO2100 μg/ml组没有差异。
2.5 活性氧清除剂NAC减弱了纳米CeO2对PC12细胞的活力抑制
经过不同浓度纳米CeO2处理后,在显微镜下统计PC12细胞的数目,选定30~33个视野观察区域统计分析不同组别单个视野观察区域细胞的平均数目用于表征细胞活力,纳米CeO2对PC12细胞活力有明显抑制作用(表2)。当加入NAC与纳米CeO2共孵育处理时,PC12细胞数量相对于单独CeO2100 μg/ml组明显增加。
3 讨论
纳米材料在医药卫生领域的应用一直备受关注,有关纳米CeO2是否能应用于治疗疾病的问题报道不一。本研究显示纳米CeO2能够抑制神经细胞的活力,其机制极有可能是诱导细胞内产生了过量的活性氧(reactive oxygen species, ROS),从而损伤细胞线粒体等重要结构,加速细胞的损伤。我们的研究表明,在没有经过修饰的情况下,纳米CeO2在比较低的浓度时对神经细胞PC12和SH-SY5Y细胞产生明显的毒性作用,并且诱导了ROS的产生,表现出氧化损伤细胞的特性。然而,加入活性氧清除剂后,两种神经细胞的反应明显不同。与纳米CeO2单独处理组相比,纳米CeO2与活性氧清除剂共孵育处理组PC12的细胞形态和数目都明显恢复,而SH-SY5Y细胞形态和数目均没有明显差异。有研究表明,纳米CeO2进入细胞后有两种去向,一方面是进入溶酶体体现出氧化毒性[13-15],另一方面是进入线粒体表现出抗氧化的特性[16-21],这有可能是导致两类神经细胞不同表现的原因。我们推测,纳米CeO2处理时,PC12细胞中CeO2可能有部分进入线粒体,部分进入溶酶体;而SH-SY5Y细胞中,CeO2可能全部进入溶酶体导致细胞毒性过大,导致活性氧清除剂NAC无法有效清除全部ROS。然而,其中的机制有待于将来进一步的研究。

Tab. 2 Effects of different concentrations(μg/ml)of CeO2 nanoparticles on the number of SH-SY5Y and PC12 cells
*P<0,05,**P<0.01vscontrol;##P<0.01vs25;△△P<0.01vs50;▲▲P<0.01vs75;○○P<0.01vs100
阿尔茨海默症(Alzheimer's disease,AD)是一种常见的中枢神经系统退行性疾病,目前仍无有效药物可治愈该疾病。其典型病理特征为细胞外β-淀粉样蛋白(amyloid β-protein, Aβ)沉积导致的老年斑(senile plaques,SPs)[22,23]。虽然目前关于Aβ诱导的AD病理变化机制尚不明确,许多研究表明,Aβ 的积累会加剧氧化应激反应[24],导致细胞内产生大量ROS,ROS能够直接损伤蛋白质、DNA、脂质等生物大分子,进而导致神经细胞凋亡和缺失[25]。陈建国等发现,Deoxygedunin可通过激活TrkB信号转导通路显著抑制Aβ沉积,减少氧化应激损伤,从而改善D-半乳糖联合AlCl3诱导的认知缺陷,为Deoxygedunin用于减轻AD样病理功能障碍提供理论基础[26]。因此,通过减少AD发病过程中ROS的产生有可能会减缓AD的发病进程,从而达到治疗AD的目的,但是仍需要进一步的研究。
Hyek等人发现TPP修饰的纳米CeO2定向进入线粒体,,可以有效地清除线粒体中的ROS,减缓氧化应激反应。将TPP修饰的纳米CeO2使用脑立体定位仪注射到AD大鼠的脑中,发现AD大鼠的神经元细胞数量有明显的恢复[18]。Kim等人发现,锰铁氧体/二氧化铈共同修饰的纳米粒子也能够有效清除ROS[27]。Samai等发现,叶酸和聚丙烯酸功能化的纳米氧化铈具有显著的抗淀粉蛋白活性,表明它能够有效抑制AD等神经退行性疾病中Aβ的形成,从而抑制ROS的形成,保护神经细胞免受氧化应激损伤[28]。以上研究表明对纳米CeO2进行修饰后,能够改变其作用性质,从诱导ROS产生损伤细胞转变为清除ROS提高细胞活力。通过上述分析可知,经过修饰的纳米CeO2在清除ROS方面具有巨大的潜力,这为寻求AD的新型治疗药物提供了新方向。同时,纳米材料在越来越多领域被广泛应用,如机械、纺织、化工、家用电器、化妆品和医药卫生等与我们日常生活密切相关的领域,其毒性对人类身体健康的影响不容小觑[12]。因此,本研究主要研究了纳米CeO2对神经细胞活力的影响及其机制,为进一步修饰CeO2,使其表现出抗氧化特性的研究打下基础,同时为预防由纳米CeO2引起的神经疾病提供科学依据。
