化脓隐秘杆菌间接免疫荧光方法的建立及应用
2020-05-18刘威何深宏任绍科李小燕杨雪芬程方俊周作勇曹立亭
刘威,何深宏,任绍科,李小燕,杨雪芬,程方俊,周作勇,曹立亭
(1.西南大学动物科学学院,重庆 402460;2.重庆市兽医科学工程研究中心,重庆 402460)
化脓隐秘杆菌(Trueperella pyogenes)是隐秘杆菌属(Arcanobacterium)成员中致病力最高的病原菌,寄生在动物的乳房、泌尿生殖道、呼吸道黏膜和胃肠道黏膜上,常与厌氧菌、大肠埃希菌、链球菌等混合存在[1–4]。该菌主要通过创伤感染,引起组织器官发生化脓性病变,严重时发生脓毒血症,导致动物死亡[5]。该病还可引起动物流产、子宫炎、关节炎、心内膜炎、乳房炎、肺炎、骨髓炎、不孕不育[6],给畜牧生产带来巨大损失,并且难以防控。张素辉等[7]、李章程等[8]多次从重庆地区患病山羊体内分离到化脓隐秘杆菌,表明该菌已在重庆地区引起了一定的流行,严重影响了山羊的生长性能及经济效益。
在生产实际中,常采用金标准分离法和PCR法检测化脓隐秘杆菌。现有方法在研究化脓隐秘杆菌的病原特性方面发挥了重要作用,但在血清学检测方面仍没有重大进展[9]。间接免疫荧光技术是在血清学、免疫学、生物化学的基础上发展起来的,将特异性抗体与抗原结合,再用荧光素标记的不同来源动物的第二抗体与特异性抗体结合,以此来检测抗原的分布[10]。间接免疫荧光技术由于敏感、特异、直观、检测快速、可大量操作等优点,在组织病理学、临床检验、病原检测等方面得到广泛应用[11]。本研究中,用从发病山羊体内分离的1株化脓隐秘杆菌 FL–1来制备兔抗化脓隐秘杆菌高免血清,建立检测化脓隐秘杆菌间接免疫荧光方法(indirect immunofluorescence assay,IFA),旨在为化脓隐秘杆菌感染的临床诊断、感染动物体内的化脓隐秘杆菌抗原定位和动态分布提供有效的检测手段。
1 材料与方法
1.1 材料
从患病山羊体内分离得到的化脓隐秘杆菌FL–1株(登录号为KX462008)、伪结核棒状杆菌、金黄色葡萄球菌、猪链球菌、大肠埃希菌、沙门氏菌等,由西南大学动物科学学院预防兽医实验室鉴定和保存;羊抗兔IgG–FITC购自美国KPL;DAPI(4,6–二脒基–2–苯基吲哚)和脱脂奶粉购自生工生物工程(上海)股份有限公司;牛血清白蛋白(BSA)购自Genview;正电荷粘附玻片购自江苏世泰实验器材有限公司;2.0~2.5 kg新西兰白兔和6周龄昆明系小鼠购自西南大学荣昌校区动物科。
1.2 化脓隐秘杆菌高免血清的制备
用McFarland比浊管调整化脓隐秘杆菌悬液浓度约为1×1010cfu/mL,用甲醛灭活后,作为抗原使用。经兔的耳静脉注射抗原0.3 mL(首免),7、14、21、28 d后进行二免、三免、四免、五免,分别经耳静脉注射0.5、1.0、1.5、2.0 mL抗原,五免后第7天经耳静脉注射抗原2.0 mL,加强免疫。最后1次免疫14 d后,经耳静脉采血检测,试管凝集试验测兔血清效价达 1∶640以上时,停止动物进食,进行心脏采血,分离血清,再经56 ℃水浴10 min去除血清内的补体,分装,备用。
1.3 化脓隐秘杆菌抗原片制备
取1 mL化脓隐秘杆菌菌液(菌液浓度为8×108cfu/mL) 12 000 r/min 离心10 min,收集沉淀,弃去上清液,加入1 mL 0.9%NaCl溶液,反复重悬3次,取20 μL滴加到干净的载玻片上,自然晾干。其他细菌的抗原片均照此制备。
1.4 IFA的检测程序
化脓隐秘杆菌抗原片固定后,放入PBS(磷酸缓冲盐溶液)中水化2 min,用吸水纸将抗原片上残留的液体擦干,再用封闭液进行封闭,倾去抗原片上的封闭液,勿洗;加入按一定比例稀释的一抗(兔抗化脓隐秘杆菌高免血清)100 μL,湿盒内孵育;一抗孵育结束后,用PBS振荡洗涤3次,每次5 min,擦干,加入稀释的二抗(羊抗兔FITC)100 μL,在湿盒内避光孵育;孵育结束后倾去二抗,接着滴加100 μL 1∶200稀释的DAPI于抗原片上,室温孵育2 min;DAPI孵育后用PBS避光振荡洗涤3次,每次5 min,擦干玻片上的液体,滴加90%缓冲甘油封片,置于荧光显微镜下观察。
1.5 IFA检测条件的优化
参照文献[12]的方法,对以下各因素进行间接免疫荧光条件的筛选和优化。
1) 固定方法。分别采用甲醇室温固定1 h、4%多聚甲醛室温下固定1 h、冷丙酮4 ℃固定30 min,玻片干透后过火焰3次,加强固定。
2) 封闭液。分别采用3%BSA、5%脱脂奶粉、10%山羊血清37 ℃封闭1 h。
3) 洗涤液。分别采用0.01 mol/L pH 7.4 PBS和含有0.05% Tween–20的0.01 mol/L pH 7.4 PBS进行洗涤。
4) 抗体稀释度。用含1%BSA的PBS稀释一抗,设 1∶25、1∶50、1∶100、1∶200、1∶300 共5 个稀释度,用含1%BSA的PBS稀释FITC标记的羊抗兔二抗,设 1∶50、1∶100、1∶150、1∶200共 4个稀释度,采用棋盘法进行稀释度筛选,根据特异性荧光信号的强弱确定一抗和二抗稀释度。
5) 一抗孵育时间。分别在37 ℃下孵育1、2、3、4 h,4 ℃过夜。
6) 二抗的孵育时间。分别在室温下孵育1、2、3 h。
7) 衬染处理。分别采用草酸铵结晶紫衬染菌体3 min和不作衬染处理。
1.6 特异性试验
1) 阴性对照。用正常兔血清代替化脓隐秘杆菌高免血清进行试验。
2) 吸收试验。用化脓隐秘杆菌菌体与制备的兔抗化脓隐秘杆菌高免血清等量混合,37 ℃孵育4 h,8 000 r/min离心10 min,取上清代替一抗进行间接免疫荧光试验。
3) 替代试验。用 PBS替代兔抗化脓隐秘杆菌高免血清孵育抗原片。
4) 对其他细菌的检测。制作溶血隐秘杆菌、伪结核棒状杆菌、金黄色葡萄球菌、大肠埃希菌、沙门氏菌、猪链球菌等细菌的抗原片,进行间接免疫荧光检测。
5) 标本自发荧光对照。标本不加一抗和二抗,只加PBS,缓冲甘油封片。
1.7 敏感性试验
用PBS将化脓隐秘杆菌菌液(菌液浓度为8×108cfu/mL)按 10 倍梯度进行稀释(10–1、10–2、10–3、10–4、10–5、10–6、10–7共 7 个稀释度)以检测该 IFA 方法的敏感性,以出现明显特异性荧光的最大稀释倍数的细菌稀释度为其检测的最高灵敏度。
1.8 重复性试验
参照文献[13]的方法,用不同时间制作的化脓隐秘杆菌抗原片进行重复试验,观察试验结果是否稳定,该方法是否可以重复。
1.9 应用IFA对人工感染化脓隐秘杆菌的小鼠组织进行检测
24只6周龄左右昆明系小鼠分为2组,其中对照组4只,试验组20只。对照组腹腔注射0.2 mL 0.9%NaCl溶液;试验组腹腔注射 0.2 mL浓度为1×109cfu/mL的化脓隐秘杆菌菌液,记录并观察小鼠发病及死亡情况。无菌采集死亡小鼠的心脏、肝脏、肺脏、肾脏、脾脏5个器官,制作石蜡切片。利用建立的IFA对人工感染化脓隐秘杆菌死亡的小鼠各组织进行检测,同时进行特异性试验以保证试验结果的可靠。将本试验建立的IFA检测方法同“金标准”细菌分离培养法平行用于试验组和对照组的肝组织检测,比较2种方法的检出率。
1.10 IFA的临床应用
利用本试验建立的IFA方法对西南大学动物科学学院预防兽医实验室保存的经细菌分离鉴定确诊为化脓隐秘杆菌感染的山羊肺脏、脾脏、肝脏、胸腺、腹股沟淋巴结、肩前淋巴结等 31份病料进行检测。
2 结果与分析
2.1 IFA检测条件的优化结果
经优化的IFA检测条件为:1) 用冷丙酮作固定剂,同时过火焰3次加强固定,细菌菌体形态完整,不易脱片,且荧光亮度强,背景染色浅;2) 用10%山羊血清作封闭液,37 ℃封闭1 h,可有效降低背景染色,大大减少非特异荧光;3) 含0.05% Tween–20的0.01 mol/L PBS作洗涤液,可提高抗原的暴露程度,增加荧光亮度,减少非特异着色;4)用草酸铵结晶紫衬染菌体后,化脓隐秘杆菌菌体被染成紫色,更容易在显微镜下找到菌体,从而判断荧光是否特异;5) 采用一抗 1∶50 稀释,37 ℃孵育 2 h,二抗 1∶100稀释,37 ℃孵育2 h,DAPI孵育2 min,荧光显微镜下可见到短杆状的化脓隐秘杆菌发出的特异性绿色荧光,荧光亮度高,背景清晰,非特异荧光着色少,菌体多为单个存在,个别菌体成团聚集(图1–a),化脓隐秘杆菌经DAPI染色后发出蓝色的荧光(图1–b),将同一视野下的荧光染色图片和DAPI染色图片用photoshop合并到一起,可见2张图片高度重合(图1–c),证明化脓隐秘杆菌菌体荧光染色良好。
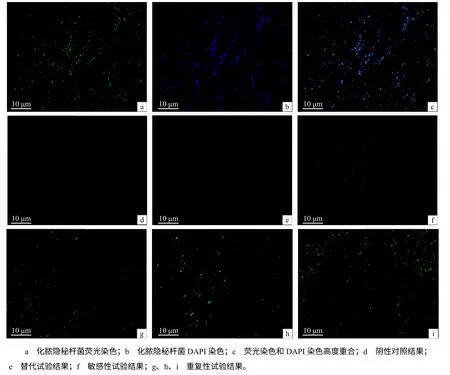
图1 化脓隐秘杆菌荧光图片Fig.1 Trueperella pyogenes fluorochrome picture
2.2 特异性试验结果
阴性对照(图1–d)、吸收试验、替代试验(图1–e)、标本自发试验及对其他细菌的检测结果均未出现特异性荧光,呈阴性。
2.3 敏感性试验结果
用PBS将化脓隐秘杆菌菌液稀释到10–7,此时细菌的浓度为 80 cfu/mL,在荧光显微镜下仍可观察到典型的特异的绿色荧光(图1–f)。
2.4 重复性试验结果
如图1–g、图1–h、图1–i所示,重复性试验的荧光强度未见明显改变,试验结果稳定,可重复。
2.5 对人工感染化脓隐秘杆菌的小鼠组织检测的结果
人工感染化脓隐秘杆菌死亡小鼠的心脏、肝脏、脾脏、肺脏、肾脏均能检测到阳性信号。在心肌纤维之间出现散在分布的强阳性信号(图2–a);阳性信号主要分布在肝细胞的细胞质内和细胞膜表面(图2–b);脾脏的白髓区和红髓区均弥散分布着大量强阳性信号(图2–c);肺泡腔、肺泡囊和肺泡隔上可见散在分布的强阳性信号(图2–d);阳性信号主要集中在肾小管管腔内、近曲小管上皮细胞的胞质内,肾间质内也可见大量散在分布的强阳性信号(图2–e)。心脏、肝脏、脾脏、肺脏、肾脏阴性对照的特异性试验结果均未出现特异性荧光(图2–f、g、h、i、j),呈阴性。IFA和细菌分离结果显示,20只攻毒小鼠的肝组织均能检测到化脓隐秘杆菌,而对照组小鼠的肝组织均未能检测到化脓隐秘杆菌。2种检测方法的符合率为100%。

图2 人工感染化脓隐秘杆菌发病死亡小鼠器官的IFA检测结果Fig.2 The results of organs of dead mouses experimentally infected with Trueperella pyogenes using IFA
2.6 IFA的临床应用结果
用IFA对31份感染化脓隐秘杆菌的山羊病料进行检测,均检出了化脓隐秘杆菌抗原,检出率为100%。
3 结论与讨论
本研究建立的间接免疫荧光方法特异性强,灵敏度高,能够对抗原进行精确定位,可避免在采样过程中因各组织交叉污染而造成检测结果的可靠性降低问题,对化脓隐秘杆菌在感染动物组织细胞中的定位具有良好效果,有利于全面和系统地了解化脓隐秘杆菌的发病机理和流行状况。
影响免疫荧光试验结果的因素较多,包括抗体的特异性和浓度、孵育时间、固定液、固定方式、封闭液、抗原修复方法等,因此,必须要对试验条件进行优化并设置相应对照,才能保证试验结果的准确可靠[14]。一抗的特异性是免疫荧光试验成功的关键。本研究中,按免疫程序,经耳静脉免疫家兔制备化脓隐秘杆菌高免血清,制作方法简便;特异性检测结果表明,建立的IFA只对化脓隐秘杆菌呈现阳性结果,说明该一抗(兔抗化脓隐秘杆菌高免血清)具有良好特异性。非特异性着色的消除对试验结果的判定有重要影响。本研究中用丙酮固定化脓隐秘杆菌抗原片,丙酮本身具有通透作用,便于抗体到达抗原部位,同时可以除去菌体表面妨碍抗原抗体结合的类脂,大大降低荧光染色背景,减少非特异性着色。相比丙酮,用多聚甲醛作固定剂时,虽然极少脱片且更易保持细菌形态结构,但其容易造成分子间桥连,导致抗原封闭,阻碍抗原抗体结合,增强非特异性着色,同时会降低细菌某些组分的抗原性,不利于抗原检测。在应用该方法对小鼠组织及临床样本的检测过程中,选择用二抗同源血清(10%山羊血清)预先孵育组织切片,血清中动物自身的抗体能预先和组织中有交叉反应的位点发生结合,以封闭抗原片和组织切片上的非特异性结合位点,减少抗体非特异性结合[15];同时在保证理想试验结果的情况下,尽可能稀释抗体,减少背景染色,提高特异性荧光亮度。本研究结果显示,当一抗稀释度为1∶50、37 ℃孵育2 h和一抗1∶200稀释、4 ℃过夜2种处理均获得了较好的试验结果,阳性信号强,背景染色低。为节省时间,采用一抗1∶50稀释,37 ℃孵育2 h。用本研究建立的IFA方法对小鼠样本和山羊临床样本进行检测,均能检测到抗原,说明该方法应用性良好。
