加工部位及提取工艺对沙棘油品质特性及主要脂质伴随物油相迁移的影响
2020-05-16曾凡正邓乾春
曾凡正,邓乾春,禹 晓
(1.国家市场监督管理总局 食品审评中心,北京100070; 2.中国农业科学院油料作物研究所,武汉430062; 3.郑州轻工业大学 食品与生物工程学院,郑州450001)
沙棘油提取自沙棘果实或种子,因具有改善心血管疾病、炎症、视网膜损伤等生物活性而受到越来越多的关注[1-2]。高含量的α-亚麻酸(ALA)是其发挥生物活性的重要物质基础[3]。研究表明,酚类化合物、生育酚、植物甾醇、类胡萝卜素等极性或非极性脂质伴随物,能够与功能性脂质组分协同改善年龄相关退行性疾病[4]。因此,为最大限度地增加沙棘油中关键脂质伴随物的富集,探讨沙棘油的提质制取技术显得尤为重要。
研究发现,不同加工部位来源的沙棘油在主要脂肪酸组成及脂质伴随物如植物甾醇、生育酚、类胡萝卜素含量上存在明显差异[5-8]。此外,提取工艺可能是影响沙棘油品质特性的另一关键因素。目前沙棘油提取工艺主要包括传统溶剂提取法、超临界CO2流体萃取法、水酶法、超声波和微波辅助提取法[9-13]。与传统溶剂提取法相比,超临界CO2流体萃取等方法在提高沙棘油得率方面具有明显的优势。加速溶剂萃取是在较高的温度和压力下用溶剂萃取固体或半固体样品的处理方法[14],已逐步应用于功能性脂质提质制取研究。加速溶剂萃取具有溶剂用量小、萃取率高等优点,但对沙棘油提取的影响鲜有报道。
尽管目前关于沙棘油的提取工艺已开展了较多的研究,但不同加工部位及提取工艺对沙棘油品质及生物活性脂质伴随物如生育酚、类胡萝卜素、植物甾醇等的影响仍缺乏较为系统的研究。基于此,本研究以沙棘籽、果肉和全果为对象,探讨传统溶剂提取、微波预处理+溶剂提取、超声波辅助溶剂提取和加速溶剂萃取对沙棘油得率、品质特性及主要脂质伴随物油相迁移的影响规律,旨在获得一种适合沙棘籽、果肉及全果油的提质制取工艺。
1 材料与方法
1.1 实验材料
沙棘全果(水分5.22%,杂质2.10%),购自青海康普生物科技股份有限公司,经低温干燥、低速粉碎、过筛和手动分拣后获得沙棘果肉和沙棘籽。
福林酚、5α-胆甾烷、植物甾醇、α-生育酚、γ-生育酚、叶黄素、番茄红素、β-胡萝卜素,购自美国Sigma-Aldrich公司;Tri-SiL (HMDS-TMCS-Pyridine, 2∶1∶10)试剂,购于美国Pierce公司;正己烷、无水甲醇、异丙醇均为色谱纯,购自德国Merck公司;其他试剂均为分析纯,购自国药集团化学试剂有限公司。
GM200粉碎机,德国Retsch公司;密闭式微波消解仪,美国CEM公司;ASE100加速溶剂萃取仪,美国DIONEX公司;RV 10D旋转蒸发仪,德国IKA集团;DHG90A电热恒温干燥箱,上海索谱仪器有限公司;XS205万分之一电子天平,瑞士Mettler Toledo公司;KQ5200DB型数控超声波清洗器,昆山市超声仪器有限公司。
1.2 实验方法
1.2.1 原料预处理
将沙棘全果、沙棘籽及沙棘果肉进一步粉碎,过40目筛,4℃贮藏备用。
1.2.2 沙棘油提取
(1)传统溶剂提取(SE):准确称取一定量的沙棘籽、沙棘果肉及沙棘全果粉,根据实验室前期优化的提取参数,按料液比1∶10加入正己烷,45℃搅拌提取2 h,经离心、旋转蒸发及氮吹,分别获得沙棘籽油、果肉油及全果油。
(2)微波预处理+溶剂提取(MPE):根据实验室前期优化的微波预处理参数,将沙棘籽、沙棘果肉和沙棘全果粉调至水分含量为12%,4℃条件下调质24 h。称取一定量样品平铺于玻璃平皿中,置于微波炉转盘上。设置微波频率2 450 MHz,功率560 W,分别微波处理2、2、3 min。再称取适量经微波处理后的沙棘籽、沙棘果肉及沙棘全果粉,按料液比1∶10加入正己烷,45℃搅拌提取2 h,经离心、旋转蒸发及氮吹,分别获得沙棘籽油、果肉油及全果油。
(3)超声波辅助溶剂提取(UAE):准确称取一定量的沙棘籽、沙棘果肉及沙棘全果粉,按料液比1∶10加入正己烷,置于超声波清洗器中。根据实验室前期优化的超声波辅助提取参数,在超声波功率750 W、水浴温度50℃的条件下,搅拌提取1 h,经抽滤、旋转蒸发及氮吹,分别得到沙棘籽油、果肉油及全果油。
(4)加速溶剂萃取(ASE):准确称取一定量的沙棘籽、沙棘果肉及沙棘全果粉,放入加速溶剂萃取仪的萃取釜中,加入一定体积正己烷,按照实验室前期优化萃取参数进行萃取,获得沙棘籽油、果肉油及全果油。沙棘籽油为萃取压力10 MPa、萃取温度90℃、静态萃取时间5 min、萃取次数2次。沙棘果肉油为萃取压力10 MPa、萃取温度90℃、静态萃取时间7 min、萃取次数3次。沙棘全果油为萃取压力10 MPa、萃取温度100℃、静态萃取时间7 min、萃取次数3次。
1.2.3 沙棘油得率计算
沙棘油得率=m/M×100%
式中:m为沙棘籽油、沙棘果肉油或沙棘全果油的质量,g;M为沙棘籽粉、沙棘果肉粉或沙棘全果粉的干重,g。
1.2.4 基本理化指标测定
酸价和过氧化值测定分别参考GB/T 5530—2008和GB/T 5538—2008方法;p-茴香胺值测定参考AOCS Method Cd 18-90方法;K232、K270值测定参考IUPAC (1979)方法。脂肪酸甲酯化采用GB/T 17376—2008方法,脂肪酸甲酯分离采用气相色谱法,参考禹晓等[15]的方法。
1.2.5 生育酚含量测定
生育酚含量的测定采用AOCS Official Method Ce 8-89的方法。称取约2 g(精确至0.001 g)油样于25 mL容量瓶内,正己烷定容,混匀,过0.22 μm滤膜,进行HPLC分析。HPLC条件:流动相为正己烷-异丙醇(体积比99.5∶0.5),进样量20 μL,流速1.0 mL/min。外标法定量。
1.2.6 植物甾醇含量测定
植物甾醇含量测定参照Azadmard-Damirchi等[16]的方法,并稍作修改。称取30 mg油样于10 mL塑料离心管中,加入3 mL 2 mol/L的氢氧化钾-乙醇溶液、150 μL 0.5 mol/L的5α-胆甾烷内标溶液,置于90℃、160 r/min水浴摇床皂化20 min,冷却至室温,再加入2 mL去离子水和1.5 mL正己烷,旋涡提取5 min,5 000g离心10 min,上清液进行气相色谱分析。气相色谱分析条件:Agilent 6890N型气相色谱仪,Agilent 7683B自动进样器,氢火焰离子化检测器;Agilent DB-5HT毛细管色谱柱(30.0 m×320 μm×0.10 μm);进样量2 μL,进样口温度260℃;柱箱温度60℃保持1 min,程序升温为40℃/min升到310℃,保持6 min,然后升至380℃,保持4 min;载气为氦气,流量2.0 mL/min,分流比25∶1,分流流量50 mL/min。外标法定量。
1.2.7 类胡萝卜素含量测定
参照Kha等[17]的方法,并稍作修改。称取一定量的油样于10 mL棕色容量瓶,三氯甲烷定容,混匀,0.22 μm滤膜过滤,滤液用于HPLC分析。HPLC条件:Inertsil C18色谱柱(4.6 mm×250 mm, 5 μm, Tokyo, Japan),紫外检测器;流动相为乙腈-甲醇-二氯甲烷(体积比50∶40∶10),流速1.0 mL/min;检测波长450、470 nm;进样量10 μL。以β-胡萝卜素、叶黄素和番茄红素为标准品,外标法定量。
1.2.8 总酚含量测定
总酚提取参考Khattab等[18]的方法,并稍作修改。准确称取1.25 g油样于10 mL离心管中,加入1.5 mL正己烷和1.5 mL 80%甲醇水溶液,旋涡提取5 min,5 000g离心 10 min,重复提取3次,合并提取液。总酚含量采用Folin-Ciocalteau法(1959)测定,结果以芥子酸当量表示,即mgSAE/100 g。
1.2.9 统计分析
采用SPSS12.0软件包进行数据统计分析,结果以“均值±s”表示。采用单因素方差分析(ANOVA)进行统计学差异检验,显著性水平p<0.05。
2 结果与分析
2.1 加工部位及提取工艺对沙棘油得率的影响(见图1)
由图1可知,就不同加工部位沙棘油而言,沙棘籽油得率最高,为6.83%~7.94%,其次为沙棘全果油(5.93%~6.92%)和沙棘果肉油(5.42%~6.12%)。这与沙棘籽的含油量较高有关。就提取工艺而言,MPE所得沙棘籽油得率最高,为7.94%;ASE所得沙棘果肉油得率最高,为6.12%,其次为MPE(5.73%);ASE和MPE所得沙棘全果油得率最高,分别为6.92%和6.91%。经湿热调质处理后的沙棘籽粉能够充分地吸收电磁波而产生热量,破坏细胞壁,可能有利于溶剂提取过程中脂滴溶出[19]。加速溶剂萃取诱导的沙棘果肉细胞壁组分高温高压下的热降解则有利于脂滴与提取溶剂接触,促进其溶出[20]。但提取工艺对沙棘果不同部位的特定适用性仍待进一步研究。
2.2 加工部位及提取工艺对沙棘油品质特性的影响(见图2~图4)
由图2A可知,沙棘果肉油和全果油酸价明显高于沙棘籽油,这可能与果肉中存在较高含量的有机酸有关[21]。不同的提取工艺对沙棘油酸价有较大的影响。其中,ASE在提高沙棘油得率的同时,也显著增加了油脂的酸价。以沙棘全果油为例,ASE所得油脂酸价(KOH)较SE(8.03 mg/g)增加62%(p<0.05)。一方面,ASE提取过程中高温高压环境可能更容易诱导果肉中的有机酸溶出;另一方面,ASE更可能诱导了甘油三酯的水解,进而释放较多含量的游离脂肪酸在油相中[14]。从图2B可以看出,沙棘果肉油过氧化值显著高于沙棘籽油和全果油(p<0.05)。推测这种氧化易感性可能与沙棘果肉中脂质存在的特异性有关。就不同的提取工艺而言,UAE和ASE所获得的沙棘籽油和全果油过氧化值最低,分别为1.12 mmol/kg和1.39 mmol/kg,1.63 mmol/kg和1.58 mmol/kg,其次为SE和MPE。相比较而言,SE所得果肉油过氧化值明显低于MPE、UAE和ASE,分别为2.59、2.86、2.81 mmol/kg和2.87 mmol/kg。这表明,MPE、UAE和ASE提取过程中所产生的热效应一定程度上加剧了果肉油脂质过氧化。因此,针对沙棘果肉油较高的氧化易感性,应选择温和的提取工艺。
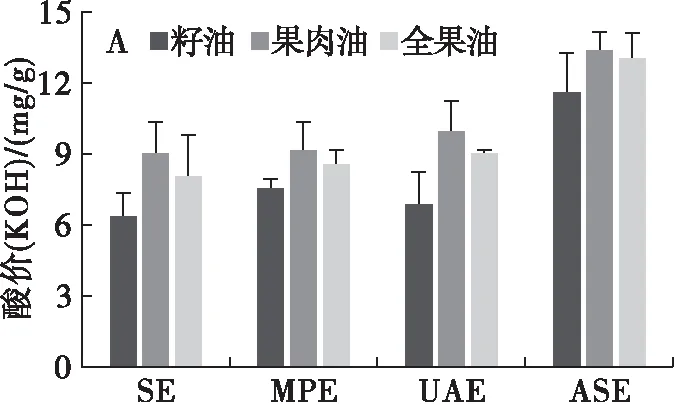
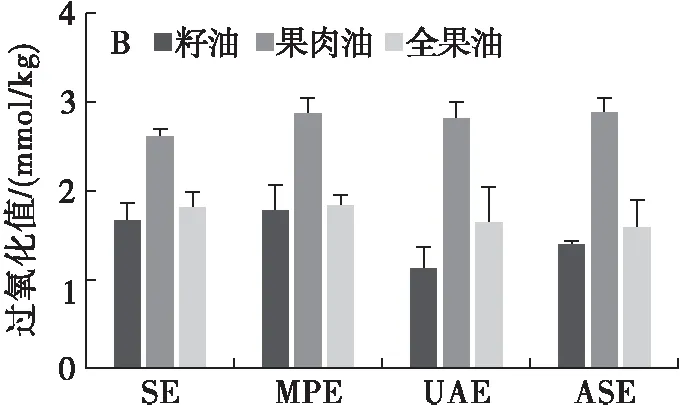
图2 加工部位及提取工艺对沙棘油酸价和过氧化值的影响

图3 加工部位及提取工艺对沙棘油p-茴香胺值的影响
由图3可知,就同一提取工艺而言,沙棘全果油p-茴香胺值最高,其次为沙棘果肉油和籽油。这一结果表明以沙棘全果形式制油过程更容易引起脂质过氧化产物的分解,其潜在的原因仍待进一步探讨。就不同的提取工艺而言,与SE(8.94)相比,ASE和MPE所得沙棘全果油p-茴香胺值分别增加14.37倍和6.74倍(p<0.05),达到137.44和69.21;与SE相比(6.07),ASE和MPE所得沙棘果肉油p-茴香胺值分别增加11.75倍和3.56倍(p<0.05),达到77.38和27.67;与SE(4.05)相比,ASE、MPE和UAE所得沙棘籽油p-茴香胺值分别增加2.47倍、0.77倍和0.56倍(p<0.05),达到14.09、7.19和6.32。因此,不同提取工艺对沙棘全果油、果肉油和籽油脂质过氧化具有不同程度的影响。其中,以ASE制取的沙棘全果油脂质过氧化程度最为明显,这可能与ASE高温高压的萃取条件有关。


图4 加工部位及提取工艺对沙棘油K232和K270值的影响
共轭二烯(K232)和共轭三烯(K270)作为脂质过氧化的早期标志物,能够一定程度上反映油脂初级和次级氧化产物的含量。由图4可知,就不同加工部位而言,沙棘籽油K232值最低(2.46~5.84),而果肉油最高(6.98~9.20)。不同加工部位沙棘油K270值也表现出类似的趋势。就不同的提取工艺而言,SE、MPE和UAE对沙棘籽油、果肉油和全果油K232和K270值无明显影响,而ASE使沙棘籽油、果肉油和全果油中K232和K270值显著增加。与SE(2.46、6.98和5.12)相比,ASE使沙棘籽油、果肉油和全果油K232值分别增加137.4%、31.8%和85.9%(p<0.05),达到5.84、9.20和9.52;与SE(0.75、7.58和4.79)相比,ASE使K270值分别增加70.7%、42.3%和167%(p<0.05),达到1.28、10.79和12.79。
结合图1,与SE相比,MPE和ASE均能够不同程度提高沙棘油得率,但ASE同时对沙棘油尤其是全果油和果肉油脂质氧化有较强的促进作用,MPE诱导脂质氧化的潜力则相对较弱。
2.3 加工部位及提取工艺对沙棘油主要脂肪酸组成的影响(见表1)
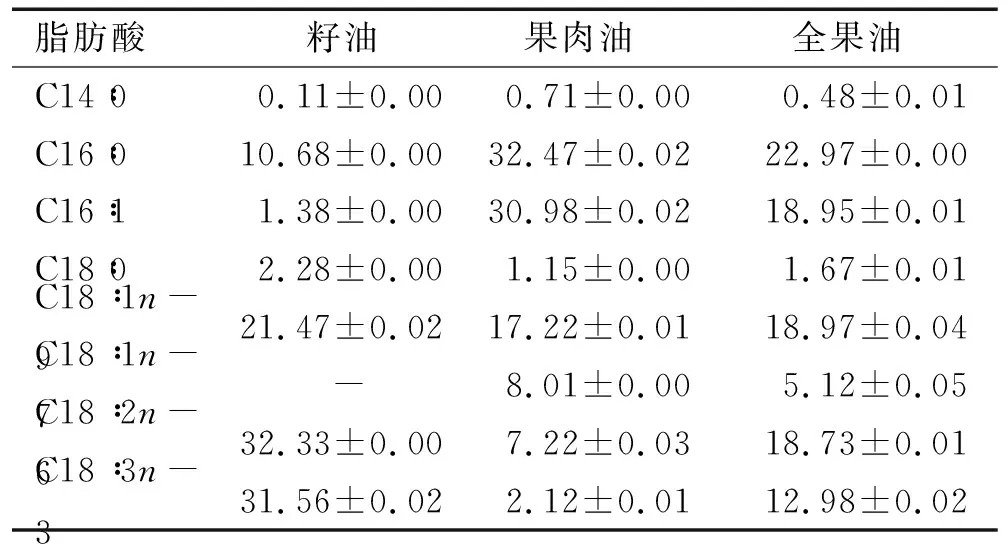
表1 沙棘油主要脂肪酸组成 %
由表1可知,不同加工部位对沙棘油主要脂肪酸组成具有重要影响。其中,C18∶2n-6、C18∶3n-3和C18∶1n-9是沙棘籽油的主要脂肪酸,占比分别为32.33%、31.56%和21.47%;C16∶0和C16∶1是沙棘果肉油主要脂肪酸组成,占比分别为32.47%和30.98%;C16∶0、C16∶1、C18∶1n-9、C18∶2n-6和C18∶3n-3是沙棘全果油主要脂肪酸组成,占比分别为22.97%、18.95%、18.97%、18.73%和12.98%。这与Yang[3]、薄海波[22]等的研究基本一致。我们的研究发现,不同提取工艺对沙棘油主要脂肪酸组成无明显影响,因此对于同一加工部位沙棘油而言表1仅列出了不同提取工艺主要脂肪酸组成的平均值。但Cenkowski等[8]指出,与氯仿/甲醇提取相比,超临界CO2流体萃取和螺旋压榨所获得的沙棘籽油C18∶3n-3含量明显增加。这种制取工艺对沙棘油脂肪酸组成的影响是否具有品种特异性仍待进一步证实。
2.4 加工部位及提取工艺对沙棘油植物甾醇含量的影响(见表2)
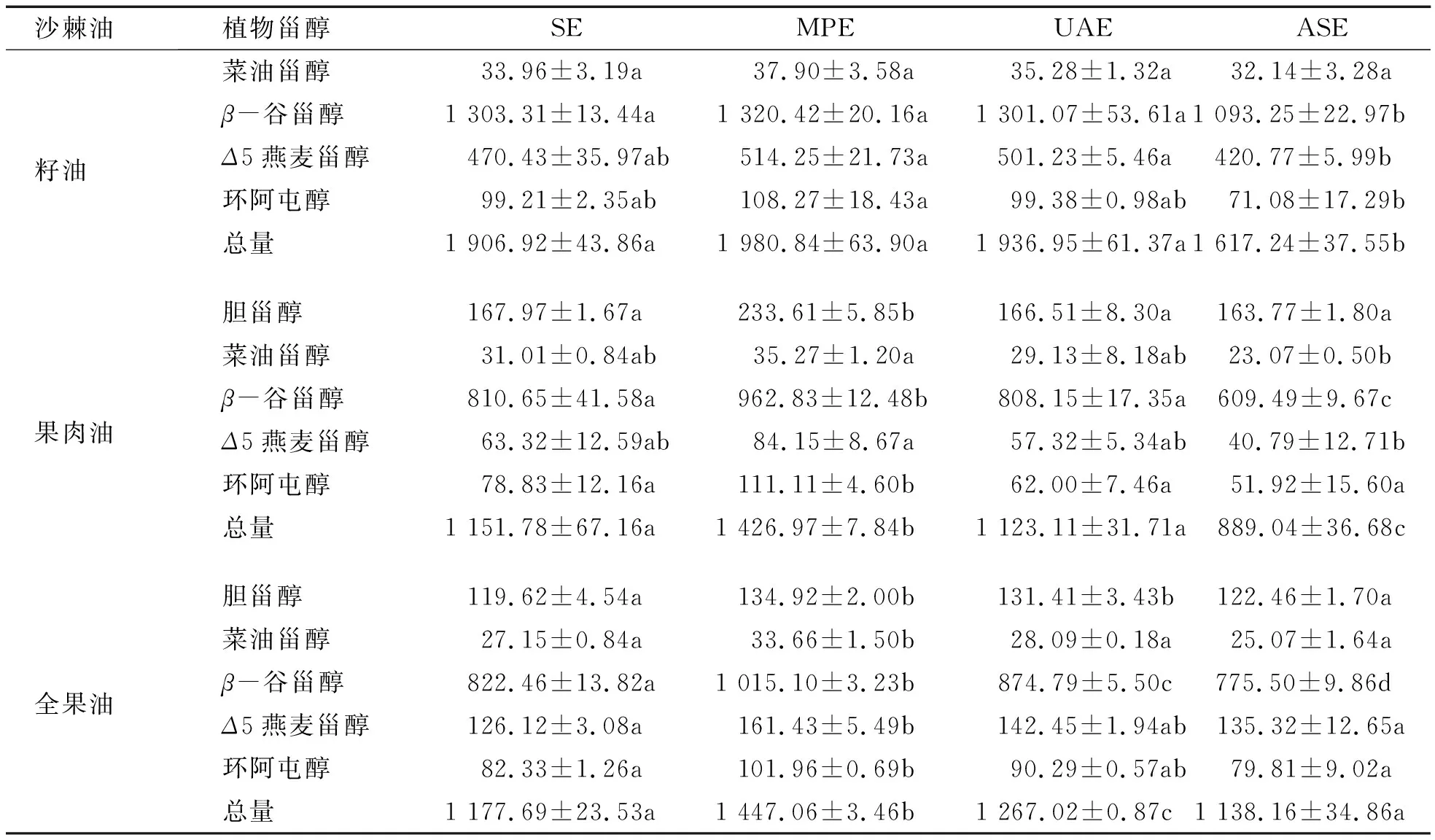
表2 加工部位及提取工艺对沙棘油植物甾醇含量的影响 mg/100 g
注:同一行字母不同表示具有显著性差异(p<0.05)。下同。
由表2可知,沙棘籽油中植物甾醇含量明显高于沙棘果肉油。此外,不同加工部位沙棘油植物甾醇组成也具有特异性。其中,沙棘籽油中植物甾醇主要为β-谷甾醇和Δ5燕麦甾醇;沙棘果肉油中植物甾醇主要为β-谷甾醇和胆甾醇。不同提取工艺对沙棘油主要植物甾醇含量也具有重要影响,且具有部位特异性。就沙棘籽油而言,与ASE相比,MPE和UAE所得沙棘籽油具有较高含量的β-谷甾醇和Δ5燕麦甾醇(p<0.05),这可能与微波诱导的沙棘籽细胞壁降解效应以及超声波辅助提取诱导的空穴效应有关[19]。与SE、UAE和ASE相比,MPE所得沙棘油中β-谷甾醇、Δ5燕麦甾醇和环阿屯醇含量最高。基于水介质这一微波能量的传递材料,微波湿热调质能够进一步破坏植物细胞壁结构,进而诱导植物甾醇从细胞壁的释放和溶出[19],且对沙棘籽和果肉细胞壁的破坏效应具有通用性。
2.5 加工部位及提取工艺对沙棘油生育酚含量的影响(见表3)
由表3所示,沙棘果肉油生育酚主要以α-生育酚为主,含量明显高于沙棘籽油,二者分别为257.26~275.59 mg/100 g和93.04~107.09 mg/100 g,全果油α-生育酚含量则介于两者之间。此外,沙棘籽油中生育酚主要为ɑ-生育酚和γ-生育酚,而果肉油中生育酚则主要为α-生育酚,这与Kallio等[7]的研究结果基本一致。不同提取工艺对沙棘油生育酚含量也具有影响,且具有加工部位特异性。就沙棘全果油而言,ASE所得油脂生育酚含量明显高于SE、MPE和UAE(p<0.05)。表明ASE提取过程中高温高压环境有利于全果中非极性生育酚释放和油相迁移。但整体而言,沙棘籽油和果肉油中生育酚含量受加工工艺影响的程度相对较弱,这可能与生育酚在沙棘籽油和果肉油制取过程中的迁移特性有关。

表3 加工部位及提取工艺对沙棘油生育酚含量的影响 mg/100 g
2.6 加工部位及提取工艺对沙棘油类胡萝卜素含量的影响(见表4)
由表4可知,不同加工部位沙棘油中类胡萝卜素含量顺序为沙棘果肉油>沙棘全果油>沙棘籽油。这与Yang等[3]的研究结果基本一致。不同提取工艺对沙棘油类胡萝卜素含量的影响具有加工部位特异性。与SE相比,MPE、UAE和ASE显著增加了沙棘籽油中类胡萝卜素含量,其中以番茄红素和β-胡萝卜素的增加最为显著(p<0.05)。MPE所得沙棘果肉油中叶黄素含量最高(92.06 mg/100 g),UAE所得果肉油中番茄红素含量最高(68.07 mg/100 g),SE和MPE所得果肉油中β-胡萝卜素含量最高(104.82、111.01 mg/100 g)。就沙棘全果油而言,与SE相比,MPE所得油脂中叶黄素和番茄红素增加最为显著(p<0.05),而UAE所得油脂中β-胡萝卜素含量最高(77.30 mg/100 g)。这种加工工艺对不同加工部位沙棘油中番茄红素、β-胡萝卜素和叶黄素的差异性迁移规律仍待进一步探讨。

表4 加工部位及提取工艺对沙棘油类胡萝卜素含量的影响 mg/100 g
2.7 加工部位及提取工艺对沙棘油总酚含量的影响(见图5)
由图5可知,不同加工部位沙棘油中总酚含量顺序为沙棘全果油>沙棘果肉油>沙棘籽油。不同提取工艺对沙棘油总酚含量具有重要影响。4种提取工艺中,ASE所得沙棘油总酚含量最高。与SE(13.98、39.97、48.24 mg/100 g)相比,ASE所得沙棘籽油、果肉油和全果油总酚含量分别增加3.37、3.34、3.76倍(p<0.05),达到47.07、133.36 mg/100 g和181.34 mg/100 g。总之,ASE高温高压环境可能诱导沙棘籽、果肉和全果中酚类化合物的解聚及油相迁移。目前关于沙棘油中酚酸组成的研究还鲜有报道,不同提取工艺对不同加工部位沙棘油结合态、游离态酚酸含量和组成的影响仍待进一步研究。
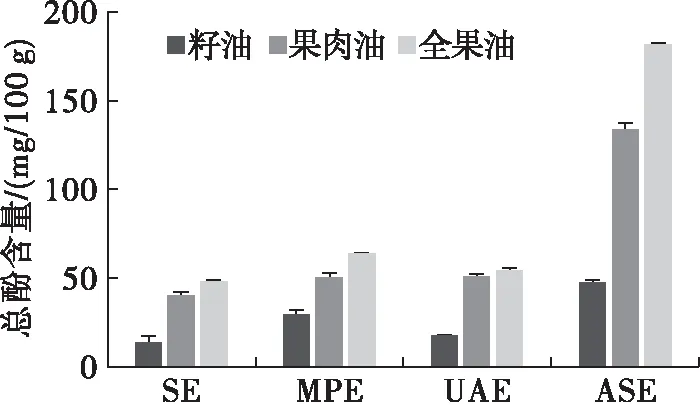
图5 加工部位及提取工艺对沙棘油总酚含量的影响
3 结 论
本研究比较分析了加工部位及传统溶剂提取、微波预处理+溶剂提取、超声波辅助溶剂提取和加速溶剂萃取对沙棘油得率、理化品质和典型脂质伴随物含量的影响,得出如下结论:
(1)沙棘籽油具有较低的酸价、过氧化值、p-茴香胺值、K232值和K270值,较高的得率、C18∶3n-3和植物甾醇含量;沙棘果肉油和全果油则具有较高的生育酚、类胡萝卜素和总酚含量。
(2)微波预处理+溶剂提取和加速溶剂萃取均能够显著增加沙棘油得率,但加速溶剂萃取同时增加了沙棘油尤其是沙棘果肉油脂质过氧化程度。
(3)微波预处理+溶剂提取能够增加沙棘油中植物甾醇和类胡萝卜素的油相迁移;加速溶剂萃取则更有利于生育酚和总酚的溶出和释放。
从兼顾沙棘油品质和活性脂质伴随物含量的角度,微波预处理+溶剂提取能够实现不同加工部位沙棘油的提质制取。但加速溶剂萃取作为一种有效富集沙棘油脂质伴随物的方法,微波预处理+短时加速溶剂萃取将能够进一步提高沙棘油的营养品质。
