水溶性抗氧化剂迷迭香酸在大豆油中溶解特性研究
2020-05-16李鹏娟LEEWanjunTANChinping
李鹏娟,LEE Wanjun, TAN Chinping, 李 颖,汪 勇
(1.暨南大学 食品科学与工程系,广东省油料生物炼制与营养安全国际联合研究中心,广州510632;2. 暨南大学-马来西亚博特拉大学“油脂加工与安全”联合实验室,广州 510632;3. 马来西亚博特拉大学 食品科学与技术系,马来西亚 雪兰莪州 沙登 43400)
油脂在煎炸过程中会发生水解、氧化和聚合等化学反应,使油脂酸价升高、黏度增大、生成氧化聚合物,严重影响了油脂品质和食用安全[1-4]。通常通过添加抗氧化剂来减缓食用油脂的氧化,如合成抗氧化剂包括丁基羟基茴香醚(BHA) 、二丁基羟基甲苯(BHT)、没食子酸丙酯(PG)和特丁基对苯二酚(TBHQ),以及天然抗氧化剂包括维生素E和迷迭香提取物等[5-7]。研究发现,迷迭香提取物应用于油脂中具有良好的抗氧化效果[8-9]。迷迭香提取物中主要包括水溶性的迷迭香酸及油溶性的鼠尾草酸和鼠尾草酚[10]。迷迭香酸含有多个酚羟基,亲水性强。水溶性迷迭香酸热稳定性好,应用于油脂中抗氧化效果优于油溶性鼠尾草酸[11]。
目前,已有学者对迷迭香酸在水、甲醇和乙醇等极性溶剂中的溶解度进行模拟研究,发现在293.15~318.15 K(20~45℃)下,其溶解过程与修正后的Apelblat模型有着良好的拟合性[12]。同时,Apelblat模型也被发现适用于茱萸碱、1,6-双[3-(3,5-二叔丁基-4-羟基苯基)]丙酰胺基己烷、二苯并噻吩和胆固醇等固体物质在不同液体溶剂中的溶解过程[13-16]。然而,对于水溶性物质在油脂中的溶解过程模拟及其相关热动力学特性却鲜有报道。
本研究对293.15~318.15 K下水溶性迷迭香酸在大豆油中的溶解度进行探究,通过Apelblat模型和阿伦尼乌斯方程对其溶解过程进行拟合分析,通过研究其在不同温度下溶解度与热力学变量的关系,为水溶性迷迭香酸在油脂抗氧化,尤其是煎炸过程中的抗氧化应用奠定理论基础。
1 材料与方法
1.1 实验材料
精炼大豆油,益海嘉里;迷迭香酸(分子式C18H16O8,相对分子质量360.31,纯度98%),安耐吉公司。Agilent 7820A气相色谱仪(配置氢火焰离子化检测器),Agilent公司;SynergyTMH1型光栅型多功能微孔板检测仪,美国Bio-Tek公司。
1.2 实验方法
1.2.1 大豆油相对分子质量的测定
利用气相色谱仪测定大豆油中甘油三酯组成和含量,以此估算大豆油的相对分子质量。气相色谱仪配置氢火焰离子化检测器和高温气相色谱柱(Rtx-65TG,30 m×250 μm×0.1 μm),测定条件:柱初始温度250℃,以20℃/min升温至280℃,以10℃/min升温至340℃,最后以1℃/min升温至350℃,保持20 min;载气为氢气,流速40 mL/min;检测器和进样口温度分别为360℃和350℃[17]。根据本实验室前期研究成果及相关研究[17-18]确定大豆油中甘油三酯组成及含量。大豆油相对分子质量根据其甘油三酯组成和含量估算。
(1)
式中:MS为大豆油相对分子质量;n为大豆油中甘油三酯的数量;MTAG为甘油三酯相对分子质量;Pi为对应甘油三酯的相对含量。
1.2.2 迷迭香酸在大豆油中溶解度的测定
按照质量浓度为100、50、25、12.5、6.25 mg/L将迷迭香酸溶解在大豆油中,使用超声波辅助将其完全溶解后于362 nm下测定吸光度[19],绘制迷迭香酸在大豆油中的溶解度标准曲线。
为了确定迷迭香酸在大豆油中的溶解达到平衡所需的时间,将迷迭香酸与大豆油混合成300 mg/L溶液,在常温下1 500 r/min连续搅拌6 h,每小时取样,经5 000 r/min 离心10 min后于362 nm下测定吸光度,然后根据标准曲线计算溶解度。通过单因素实验确定搅拌时间后,探究20、25、30、35、40、45℃下迷迭香酸在大豆油中的溶解情况。
以摩尔分数表示的迷迭香酸在大豆油纯溶剂中的溶解度(XRA)的计算公式如下。
(2)
式中:mRA和mS为迷迭香酸和大豆油的质量;MRA和MS分别为迷迭香酸和大豆油的相对分子质量。
1.2.3 基于溶解度的理论模型
1.2.3.1 Apelblat模型
lnXRA=A+B/T+ClnT
(3)
式中:T为反应温度,K;A、B和C为经验常数,通过实验数据代入可拟合得到。
1.2.3.2 阿伦尼乌斯模型
通常食品中成分在加热或储藏过程中的降解以零级、半级、一级甚至更高级的动力学模型来表示。迷迭香酸在大豆油中溶解过程的反应级数通过以下一般速率定律得到。
(4)
式中:Kx为反应级数常数;n为反应级数;t为反应时间;Xt为在特定时间t时迷迭香酸的摩尔溶解度(XRA)。
反应级数方程通过将方程(4)中的n指定为0、0.5、1和2,分别对应零级、半级、一级及二级反应。通过整理方程,得到:
零级:Xt=X0+Kxt
(5)
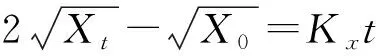
(6)
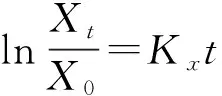
(7)

(8)
式中:X0为反应起始迷迭香酸的摩尔溶解度。
阿伦尼乌斯模型是反应过程中反应速率随温度变化的规律,方程如下:
(9)
式中:K为反应速率常数;Ea为反应所需的活化能,J/mol;R为摩尔气体常数,8.314 J/(mol·K);T为反应温度,K;C为指前因子的自然对数。
1.2.3.3 热动力学模型
固体物质在某一溶剂中的溶解过程与其相关热力学性能之间的变化相关。通过下列方程表示迷迭香酸在大豆油中溶解的热力学特性。
ΔsolGi=-RTlnXi
(10)
(11)
(12)
式中:ΔsolGi为吉布斯自由能,kJ/mol;ΔsolHi为焓值,kJ/mol;ΔsolSi为熵值,J/(mol·K)。
1.2.4 数据分析及模型检验
所有的数据均重复3次。使用回归变量(ANOVA)分析迷迭香酸在大豆油中随温度变化的溶解度。通过调整拟合方程的相关误差系数(RD)、绝对平均相关误差系数(AARD)以及决定系数(R2)可得拟合度更高的方程。其中R2越大,RD和AARD越小,说明方程拟合度越好。
RD=|Xcal-Xexp|/Xexp
(13)
(14)
式中:Xcal为通过模型计算得到的迷迭香酸摩尔溶解度理论值;Xexp为通过实验得到的迷迭香酸摩尔溶解度实际值;n为实验个数。
2 结果与分析
2.1 迷迭香酸在大豆油中溶解度标准曲线
迷迭香酸在大豆油中的溶解度标准曲线方程为Y=0.002X+0.031 2,R2=0.991 8。该方程在0~100 mg/L下能较好表示迷迭香酸的溶解度。
2.2 搅拌时间对迷迭香酸在大豆油中溶解度的影响
图1表示在室温下随着搅拌时间延长迷迭香酸在大豆油中溶解度的变化。由图1可见,迷迭香酸在大豆油中的溶解度在0~4 h内不断升高,在4~6 h基本达到平衡,无显著性差异。由此可见,迷迭香酸在大豆油中溶解度较低,需要长时间搅拌分散。考虑到温度对迷迭香酸在大豆油中的溶解度有影响,因此采用6 h作为搅拌时间继续进行实验,以保证迷迭香酸在不同温度下能够充分溶解。
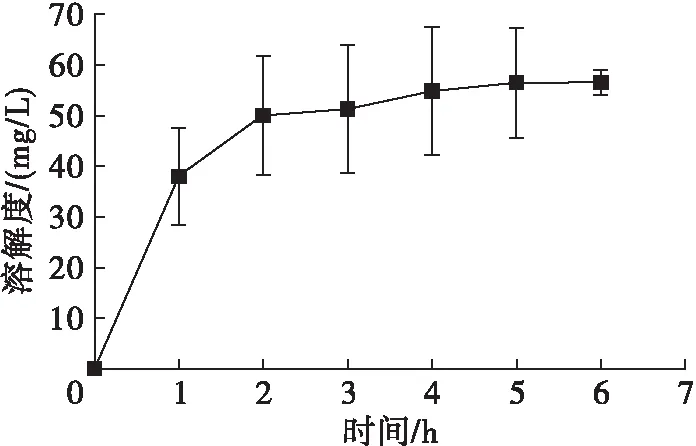
图1 迷迭香酸在大豆油中的溶解度与搅拌时间的关系
2.3 温度对迷迭香酸在大豆油中溶解度的影响
将迷迭香酸与大豆油混合成300 mg/L溶液,分别在20、25、30、35、40、45℃下按1.2.2方法进行溶解,考察温度对迷迭香酸在大豆油中溶解度的影响,结果见图2。
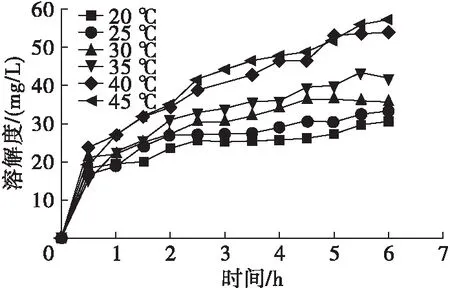
图2 迷迭香酸在大豆油中的溶解度与温度的关系
由图2可见,迷迭香酸在大豆油中的溶解度随着温度的升高而增加。不同温度下,搅拌1 h内迷迭香酸在大豆油中的溶解度都明显升高,1 h后,随着搅拌时间的延长,迷迭香酸在大豆油中溶解度的增长幅度较低,最终达到一个相对稳定的状态。在40、45℃下,在2~5 h之间迷迭香酸仍有一定幅度的增长,但在5~6 h之间,迷迭香酸在大豆油中的溶解度较稳定。
2.4 基于溶解度的理论模型
2.4.1 Apelblat模型
Apelblat模型应用中需要根据各物质质量及相对分子质量计算迷迭香酸的摩尔质量。迷迭香酸相对分子质量为360.31,大豆油的相对分子质量根据其甘油三酯含量估算870。
Apelblat模型是半经验模型,通常用来表示和预测液固相平衡数据[20]。根据不同温度下迷迭香酸在大豆油中的摩尔溶解度实验值拟合Apelblat模型,结果如下:
lnXRA=-670.27+27 986.55/T+99.93lnT(R2=0.97,RD=0.031)
(15)
迷迭香酸在大豆油中摩尔质量实验值与Apelblat模型计算理论值对比及相关误差结果如表1所示。由表1可见,在293.15~318.15 K范围内随着温度的升高,迷迭香酸在大豆油中的溶解度不断增大。同时,通过Apelblat模型计算得到与实验值相同的趋势,说明Apelblat模型与迷迭香酸在大豆油中的溶解特性有较好的相关性。
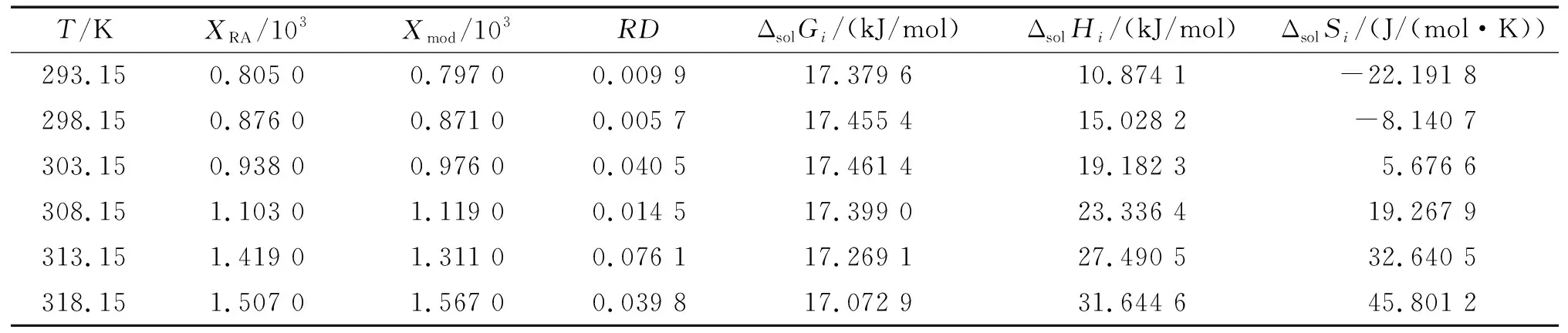
表1 不同温度下大豆油中迷迭香酸摩尔溶解度及热动力学变量
注:Xmod指由Apelblat模型计算的溶解度。
2.4.2 阿伦尼乌斯模型
阿伦尼乌斯方程是反应速率常数随温度变化的方程。首先,根据阿伦尼乌斯方程测算不同级数反应与迷迭香酸在大豆油中溶解度的相关性,结果见表2。由表2可见,零级反应AARD最小(< 20),说明零级反应能较好地表达迷迭香酸在大豆油中的溶解过程。反之,半级和一级反应的AARD较大,说明其表达该溶解过程的效果较差[21]。

表2 不同级数反应与迷迭香酸在大豆油中的溶解拟合度
注:NC为non-converged points(非收敛点)。
根据上述结果,将阿伦尼乌斯方程应用于零级反应,整理得到方程:
(16)
利用阿伦尼乌斯方程和零级反应的转化方程(15)对迷迭香酸在大豆油中的溶解度随反应温度和搅拌时间的变化进行分析,得到实验值与理论值变化关系曲线,结果见图3。由图3可见:同一反应温度下随着搅拌时间的延长,迷迭香酸在大豆油中的溶解度不断增加;同时,同一搅拌时间下随着反应温度的升高,迷迭香酸溶解度也不断升高。该结果与前期单因素实验结果一致,并且方程(16)对溶解度的估算误差不超过±10%,这说明阿伦尼乌斯方程和零级反应能较好地预测迷迭香酸在大豆油中的溶解过程。
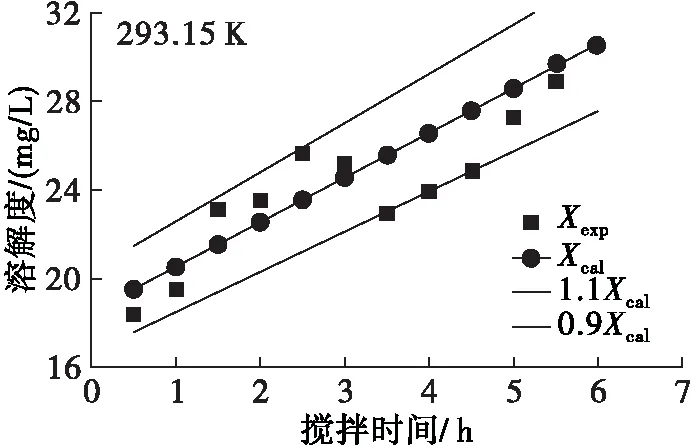
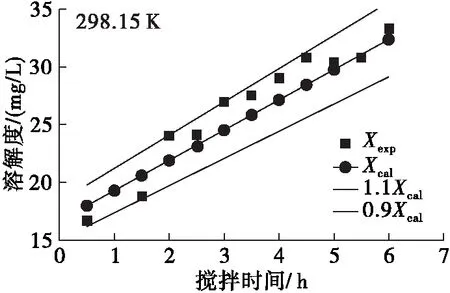
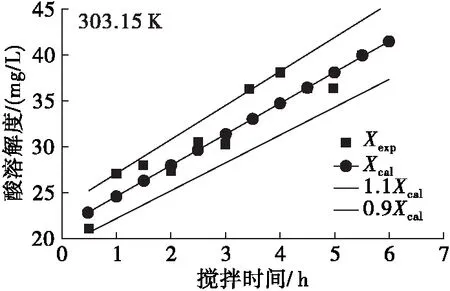
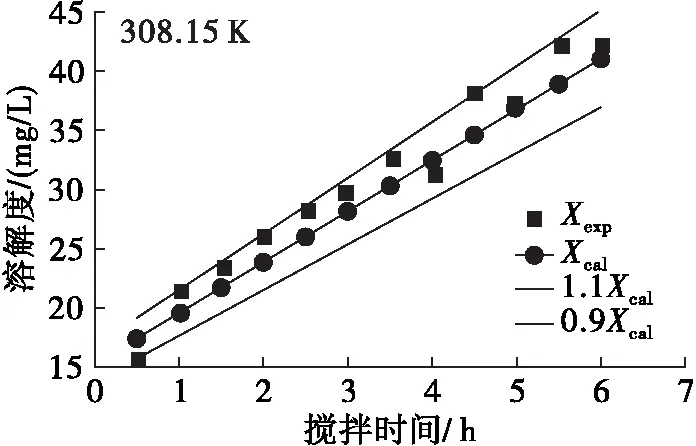

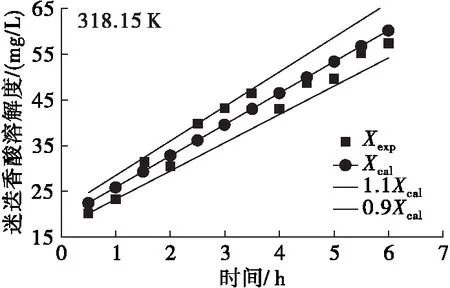
图3 不同温度下迷迭香酸在大豆油中溶解度实验值与应用阿伦尼乌斯方程和零级反应模型后计算值拟合曲线
2.4.3 热动力学模型
固体在液体中的溶解与某些热力学参数的变化有关。任意固体在液体中的溶解可以用热力学变量ΔsolGi、ΔsolHi和ΔsolSi表示。通过模拟发现迷迭香酸在大豆油中的溶解度符合Apelblat模型,因此将该模型应用于热力学变量ΔsolGi、ΔsolHi和ΔsolSi中,可以得到以下方程:
ΔsolGi=-RT(-670.27+27 986.55/T+99.93lnT)
(17)
ΔsolHi=-R(27 986.55-99.93T)
(18)
ΔsolSi=R(-670.27+99.93lnT+99.93)
(19)
方程(18)中假设热容量为常数,则熔融焓是温度的函数。利用等式(17)~(19)可计算出迷迭香酸在大豆油中溶解的热力学参数ΔsolGi、ΔsolHi和ΔsolSi(见表1)。关于热力学参数的准确性,由导数计算的方程准确性没有由测定值直接计算的方程准确性高[21]。这说明ΔsolHi和ΔsolSi(由导数计算得到)预测精度不及ΔsolGi(由测定溶解度计算得到)。虽然ΔsolHi和ΔsolSi在预测过程中存在不确定性,但当前溶解度测定的热力学参数值与文献[12, 22-24]中同类测定值一致,说明在本实验中ΔsolGi、ΔsolHi和ΔsolSi的测定值具有可信度。在温度从293.15 K上升至318.15 K的溶解过程中,ΔsolGi从17.379 6 kJ/mol降至17.072 9 kJ/mol,且一直为正值,说明迷迭香酸在大豆油中的溶解过程为非自发过程,需要外界提供能量。该结论也与前期实验结果一致,在溶解过程中随着温度的升高,迷迭香酸在大豆油中的溶解度增大。同时,随着温度升高,ΔsolGi下降,说明温度升高易促使迷迭香酸在大豆油中溶解行为的发生。ΔsolHi从10.874 1 kJ/mol升高至31.644 6 kJ/mol,这说明该反应是一个吸热的过程,亦论证了温度升高溶解度增大的实验现象。ΔsolSi从-22.191 8 J/(mol ·K)上升至45.801 2 J/(mol ·K),说明随着温度的升高,迷迭香酸在大豆油中的溶解度增加,溶液的稳定性增加。
3 结 论
在本研究中,通过测定293.15~318.15 K温度范围内迷迭香酸在大豆油中的溶解度变化,发现迷迭香酸的溶解度随着温度的升高而增大。同时,通过Apelblat模型、阿伦尼乌斯方程对该溶解过程进行拟合,理论值与实验值具有较好的相关性。利用溶解度对反应过程中的热力参数进行分析,迷迭香酸在大豆油中的溶解属于非自发吸热且稳定性不断增加的过程。本研究以水溶性抗氧化剂迷迭香酸为例,其在大豆油中的溶解度变化规律和热力学特性结果将为其他水溶性抗氧化剂在油脂抗氧化应用方面提供理论基础。
