iTRAQ蛋白质组学方法发现高同型半胱氨酸诱导的鸡胚神经管畸形中存在氧化磷酸化通路异常
2020-05-15张勤李丹白宝玲万春蕾肖宗慧
张勤 李丹 白宝玲 万春蕾 肖宗慧
随着中国二胎政策的实施, 控制出生缺陷, 提高人口质量, 越来越成为民生关注的重点问题。神经管畸形(Neural tube defects,NTDs)是由于神经管闭合(neural tube closure,NTC)失败或闭合过早引起的重度先天复杂畸形,包括无脑儿、颅脊柱裂、脊柱裂、脑膨出、脊髓脊膜膨出等多种疾病表型, 是致死、致残率极高的一类出生缺陷。新生儿中NTDs 畸形率高达1‰~5‰,2018年发表的一项研究表明全球2015年NTDs畸形率是1.86‰[1]。与其他国家相比,中国是NTDs 的高发地区,特别是中国北部山西省NTDs 的发病率最高。流行病学调查发现,2014 年山西省NTDs 的发病率为3.15‰[2],是世界范围内NTDs 发病率最高的地区之一。NTDs是中国排名前10的重度高发出生缺陷[3], 绝大多数的NTDs患儿发生自然流产、人工终止妊娠、死产和新生儿死亡,极少数非开放性脊柱裂的患儿能幸存,但往往伴随终身的发育障碍和残疾,给个人、家庭和社会带来严重的精神和经济负担[4]。深入研究 NTDs 的发病机制及防治办法对提高人口质量有重要的意义。近年的一些研究提示同型半胱氨酸(homocysteine,Hcy)的代谢异常与NTDs的发生密切相关, 高Hcy可导致NTDs的发生[5-10]。但是Hcy升高增加出生缺陷的机制目前仍不明确。
基于质谱(MS)的定量蛋白质组学能够发现差异蛋白,为疾病的机制研究提供线索。作为定量蛋白质组学方法中的重要研究手段,iTRAQ同位素标记定量技术广泛应用于差异表达蛋白质的鉴定。既往研究表明,高Hcy可诱导鸡胚产生NTDs表型。本研究采用Hcy代谢物同型半胱氨酸硫代内酯(homocysteine thiolactone,HTL)处理鸡胚可诱导明显的脊柱裂表型。本研究利用此动物模型,采用iTRAQ技术,对高HTL处理的鸡胚脑组织和正常未处理的鸡胚脑组织差异蛋白进行比较,以发现差异蛋白富集通路并解释神经管畸形发生机制。
材料与方法
一、材料
白色莱杭鸡种蛋购于中国农业大学小牧场;试剂包括L-Homocysteine Thiolactone hydrochloride(同型半胱氨酸硫内酯,sigma,USA);台式液(1 mM葡萄糖,3.5 mM氯化钾,100 mM氯化钠,0.02 mM磷酸二氢钠,12 mM碳酸氢钠,北京化工厂);酚红(北京化工厂); Trypsin(Promega,USA)。iTRAQ试剂盒购置于美国AB SCIEX;Urea试剂、DTT试剂、四乙基溴化铵(TEAB)和碘乙酰胺试剂购自美国Sigma; Bradford kit试剂盒, C18脱盐柱、真空浓缩仪和超声清洗仪由Eppendorf公司提供; NanoLC高效液相(UltiMate 3000 RSLCnano System,Dionex)和Q Exactive HF2.8 质谱(Thermo)购置于美国;孵化器购置于日本Showa Furanki公司。
二、方法
1. 动物模型的制备:收集经人工授精的白来航种鸡鸡蛋120枚,孵化器中进行孵育,孵育条件为孵化温度为38 ℃, 相对湿度为55%~65%, 90°转角, 30分间隔自动翻蛋, 继续孵化,此时记为第0天(E0)。将孵化约27 h的鸡种蛋取出用酒精棉擦拭表面消毒后, 使用牙科钻磨去直径约3~4 mm左右的蛋壳,用镊子揭去蛋壳膜, 暴露胚胎。镜下检出活胚,弃除未受精蛋6枚及未发育蛋4枚后,将剩余110枚蛋按照随机数表法分成2组, 其中正常组50枚, 处理组60枚。处理组进行0.5 μL 0.5 mM HTL(溶解于台式液中)神经沟注射,其中5枚未正确注射到神经沟,最终获得处理组55枚。同时对50枚正常组种蛋进行0.5 μL台式液(不含HTL)神经沟注射,其中2枚未正确注射到神经沟,最终获得正常组48枚。然后将所有的种蛋放回孵化器,钝端向上,继续孵化。在神经管闭合后的E5时取胚胎。用摄子敲除鸡胚外壳后用弯头镊小心剥离鸡胚胚胎外膜并将鸡胚放置于体视显微镜下检测胚胎有无畸形和死亡,畸形判断参照《鸡胚发育的一系列正常阶段》[11]。体视显微镜下判断为神经管畸形样本脑组织以3个合并为1份样本,共纳入8份样本作为NTDs组,正常组中选择发育正常脑组织也以3个合并为1份样本,共15份样本作为正常组,冻存于-80℃冰箱。
2. 一步法提全蛋白:采用One Step Animal Tissue Active Protein Extraction Kit(生工,货号:C500006)提取全蛋白,主要步骤如下:选取NTDs组与对照组鸡胚脑组织各3份样本,每份称取100 mg,加入1 mL 预冷的抽提试剂(使用前加入1 μL的蛋白酶抑制剂,5 μL的蛋白酶抑制剂,1 μL的DTT和10 μL的PMSF)后用匀浆器将组织磨碎后超声破碎,每次30 秒,8~10次,每次间隔1min 14 000 g,离心15 min并将上清转移到另一个新的预冷低吸附EP管中,进行下一步FASP超滤浓缩实验。
3. FASP超滤浓缩:提取的鸡胚总蛋白用3 KD filter进行超滤浓缩, 每个样本100 ug总蛋白, 加入300 μL 尿素溶液,14 000 g离心30 min; 加入30 uL 10 mM DTT(297 μL UA+ 3 μL 1 M DTT), 金属浴37℃ 1 h; 加入15 μL 1M的碘乙酰胺 , 在黑暗处室温静置20 min,14 000 g离心45 min; 加入300 μL 尿素溶液洗涤3次; 加入300 μL NH4HCO3 洗涤3次; 最后加入100 μL TEAB溶液于超滤管中溶解并收集总蛋白。
4. iTRAQ标记:取50 μL FASP样品(约100 μg酶解产物),其中NTDs组2份,正常组2份,加入iTRAQ四标试剂(114,115,116,117)中的一个标记组分,混合均匀后将标记肽段用分级柱分级以进行质谱分析。
5. Nano-HPLC/MS/MS分析:各分级样品通过连接到UltiMate 3000 RSLCnano系统的自动进样器上样并用Q Exactive HF Orbitrap质谱仪进行质谱分析。离子喷雾电压保持在2.2 kV,毛细管温度320℃,S-Lens射频水平为60。在数据依赖性采集模式下,以60 000的分辨率进行一级质谱 (mass spectrum,MS) 扫描(m/z 300~1 500),分离出20个最强烈的母离子,在HCD碎裂模式下,iTRAQ标记的肽段被打成片段后,以30 000的分辨率进行二级质谱 (MS/MS) 扫描。
6. 质谱数据分析:使用Proteome Discoverer软件(版本2.1.0.81,Thermo Fisher Scientific)进行数据分析,以Uniprot上下载的鸡全蛋白数据库进行搜索(www.uniprot.org)。检索条件为:蛋白经胰蛋白酶消化后,允许最大的漏切位点数为2,前体质量偏差容忍度为10 ppm,碎片质量偏差容忍度为0.02 Da,相对峰度根据信噪比(S/N)来计算,应用Total peptide mount对各标记之间进行均一化。固定修饰为iTRAQ 4-plex (N,K) 和Carbamidomethyl (C),可变修饰为iTRAQ 4-plex (Y) 和Oxidation (M)。当P<0.05和FDR(错误发现率)<0.01时数据可信。搜库完成以后,将数据以Excel的形式导出做后续分析。
7. 生物信息学分析:将NTDs组与对照组差异倍数大于等于1.2倍的蛋白定义为差异蛋白,因此选择1.2倍的阈值条件对差异蛋白进行筛选。 FC≥1.2为上调(up), FC≤0.833为下调(down)。应用京都基因和基因组百科全书数据库(Kyoto Encyclopedia of Genes and Genomes database,KEGG),确定差异蛋白所参与的物质代谢途径和信号转导通路。使用在线免费分析工具DAVID (www.david.abcc.ncifcrf.gov) 对差异蛋白质进行Gene Ontology (GO) 分析。根据GO的三个分析方面即生物过程 (biological process)、细胞成分 (cellular component)和分子功能(molecular function)对蛋白进行注释和分类,以判断这些差异表达蛋白在哪些生物学过程中发挥作用。
8.PRM分析:将前述正常组和NTDs组各3份鸡胚脑组织经FASP后的样本进行常规质谱分析,选择感兴趣的蛋白的质谱信息,提取m/z和RT时间信息,并在此基础上将RT时间 ±3.5 min,做成目标母离子,并将母离子信息添加到质谱分析的母离子列表中进行重点碎裂。质谱上机检测同Nano-HPLC/MS/MS,获得的质谱数据经PD 2.1软件分析后,导出目标蛋白的肽段信息,导入到Skyline(版本3.5.0.9319;AB Sciex)中选择“Import PRM Peptide Search”模块,进行参数设置后进行比较分析,其参数设置如下:Cut-off score: 0.95;precursor charges: 2,3,4;ion charges: 1,2;ion type: y.p.b;ion match tolerance: 0.05;pick 3 product ions;precursor mass analysis: obitrap;max missed cleayages: 0。
结 果
一、 HTL诱导鸡胚产生NTDs表型
正常对照组鸡胚存活率为95.8%(46/48),仅1例出现畸形为NTDs,神经管畸形率2.1%(1/48)。处理组鸡胚存活率为67%(37/55),24例 NTDs,神经管畸形率为43.6%(24/55)。24例NTDs包括脑发育异常合并脊柱裂2例,脑膨出3例,中脑萎缩7例,后脑发育缺陷2例,间脑发育缺陷3例,脑泡皱褶3例,脊柱裂4例。其余畸形包括心脏缺损2例,面部畸形1例,短尾畸形1例。另有发育迟缓5例,死胎8例。14例鸡胚发育正常。图1A显示E8典型的开放性脊柱裂表型,1B为E5开放性脊柱裂表型。
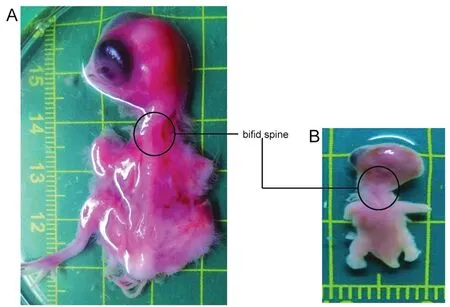
图1 HTL诱导的脊柱裂表型Figure 1 The bifid spine induced by HTLA: HTL处理后E8天的脊柱裂表型;B:HTL 处理后E5天的脊柱裂表型A:The bifid spine of E8 induced by HTL;B:The bifid spine of E5 induced by HTL
二、iTRAQ定量获得HTL诱导的鸡胚NTDs脑组织蛋白质组的差异表达
质谱获得的数据经PD分析,鸡胚胎脑组织中共鉴定到4 305种蛋白质,其中差异表达蛋白共369个,有256个表达水平上升,113个表达下降。将差异蛋白采用DAVID软件分类,其中包括细胞质蛋白33个,金属结合蛋白33个,运输蛋白27个,核苷酸结合蛋白27个,细胞骨架蛋白9个,氧化还原酶9个,SH3结合域蛋白8个,微管蛋白6个,血红素蛋白5个等。
三、 鸡胚NTDs脑组织蛋白质组的差异表达的生物信息学分析
进一步对选出的差异蛋白进行分析,根据现有的数据库注释和生物信息学分析工具,对鉴定出的369个差异蛋白进行功能分析。从KEGG(图2A)通路分析来看,差异表达蛋白富集在代谢通路、氧化磷酸化通路、内吞通路和核糖体通路。图3A显示差异蛋白在氧化磷酸化通路的富集,蓝色为富集的蛋白,分别为ATP5L、ATP5MF、ATP5H、COX3和ATP6,提示氧化磷酸化通路参与HTL诱导的NTDs发生。从GO分析的结果来看,从生物过程(图2B)注释情况来看,差异表达蛋白主要参与生物粘附、生物调节、生长和代谢过程等过程。从细胞组成(图2C)分布情况来看,差异表达蛋白主要分布在细胞膜、大分子复合物和细胞器中。从分子功能(图2D)注释情况来看,差异表达蛋白多为连接蛋白、酶相关、蛋白受体和转运活性蛋白。
四、 NTDs鸡胚脑组织PRM结果显示氧化磷酸化通路ATP5H和ATP5MF表达下降
为明确氧化磷酸化通路蛋白ATP5H和ATP5MF的表达水平,运用靶向定量PRM技术定向检测ATP5H和ATP5MF的表达水平。Skyline软件分析发现与正常组比较,HTL处理的鸡胚模型中的蛋白ATP5H和 ATP5MF的定量肽段“IAEYEQQLQK”(P=0.02)和“SVYAHFPINVVIQDNGSLVEIR”(P=0.03)表达水平降低(图3B),差异有统计学意义,这与高Hcy鸡胚NTDs脑组织中iTRAQ表达趋势一致,提示氧化磷酸化通路蛋白在HTL诱导的NTDs中表达降低。
讨 论
NTDs是由于神经管闭合失败或闭合过早引起的重度先天复杂畸形,由多基因和环境交互作用导致产生。近年的一些研究提示同型半胱氨酸的代谢异常与NTDs的发生密切相关。流行病学研究发现怀孕期间母体高同型半胱氨酸血症与子女发生NTDs风险增加相关[5-7]。在早孕期维生素B12相匹配的实验中,在NTDs受累的孕妇中,同型半胱氨酸水平显著高于对照组[8]。前期本课题组在中国山西NTDs高发区调查也发现,NTDs孕妇血清中叶酸水平降低,同时一碳循环的中间代谢产物Hcy升高[9-10]。在荷兰的一项研究中,与曾生下正常婴儿的对照组相比,曾生下NTDs患儿的非孕期妇女在空腹状态和摄取甲硫氨酸负荷6 h后的血浆总同型半胱氨酸水平都显著升高,而且部分NTDs畸形儿的羊水中Hcy水平高于正常胎儿[12]。这些研究结果提示母体高Hcy血症与NTDs的发生成正相关,Hcy蓄积是NTDs的危险因素之一, 但是Hcy升高增加出生缺陷的机制目前仍不明确。
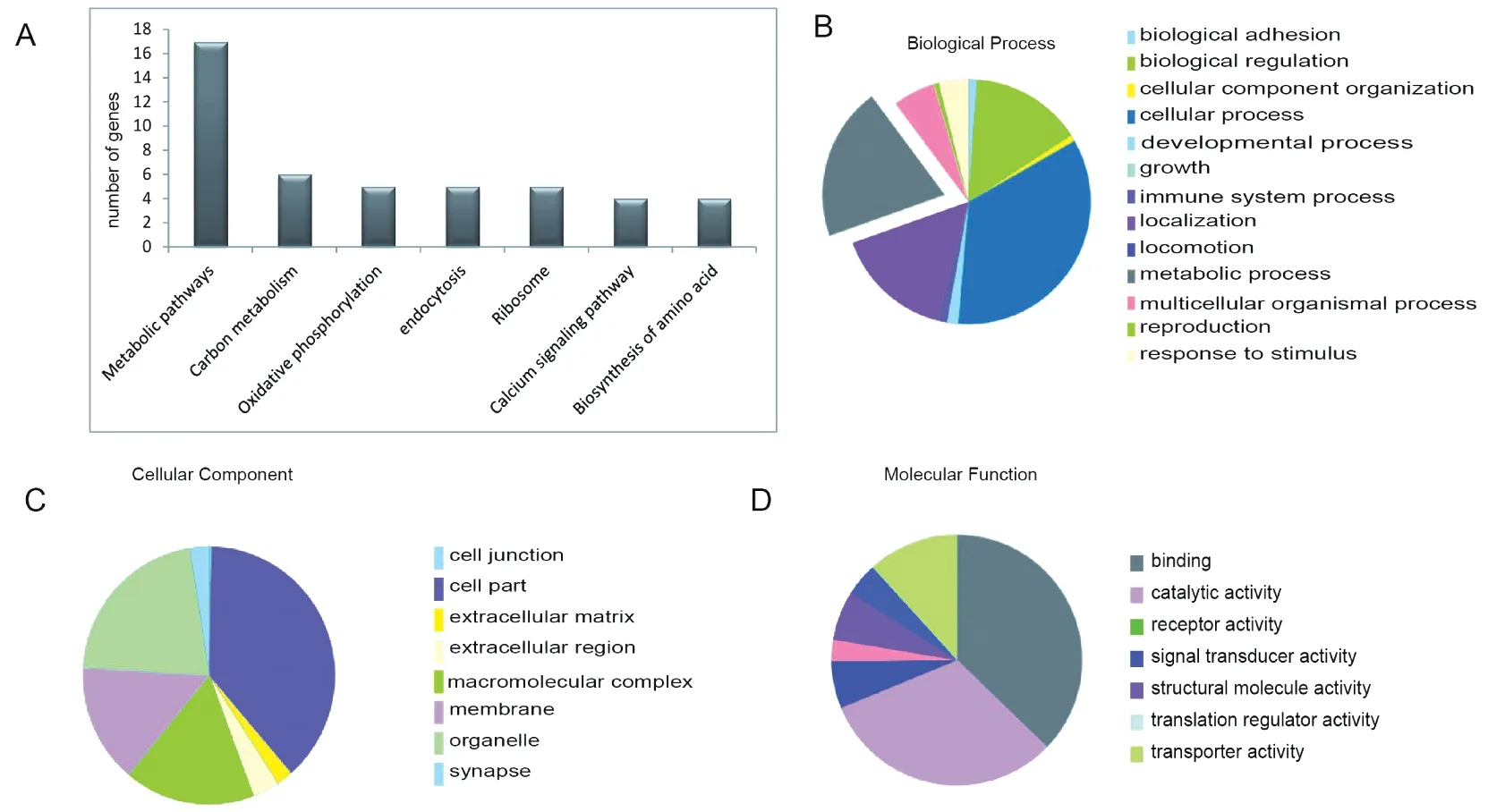
图2 差异表达蛋白GO和KEGG分析Figure 2 GO and KEGG analysis of differentially expressed proteinA:KEGG分析差异蛋白的通路富集情况;B:GO分析差异蛋白在生物过程中的富集;C:GO分析差异蛋白在细胞组成中的富集;D:GO分析差异蛋白在分子功能上的富集。A:KEGG analysis of differential proteins pathway enrichment; B: GO analysis of differential proteins enrichment in biological processes; C: GO analysis of differential proteins enrichment in cell composition; D: GO analysis of differential proteins enrichment in molecular function.
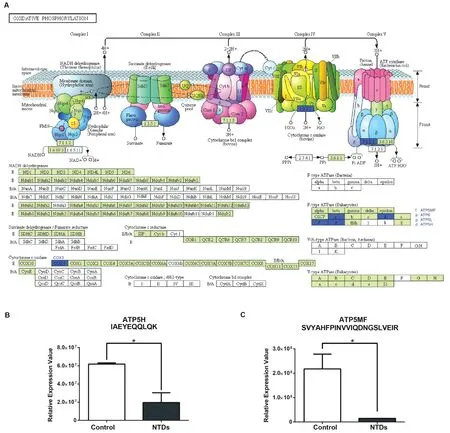
图3 氧化磷酸化通路富集的差异蛋白Figure 3 The differentially expressed proteins enriched in oxidative phosphorylation pathwayA:图示氧化磷酸化通路上富集的差异蛋白,蓝色标记为富集差异蛋白;B:PRM验证氧化磷酸化蛋白ATP5H肽段IAEYEQQLQK和ATP5MF肽段SVYAHFPINVVIQDNGSLVEIR在NTDs中表达降低A:The differential protein enriched in the oxidative phosphorylation pathway. The differential protein marked blue. B: PRM validated that IAEYEQLQK and SVYAHFPINVVIQDNGSLVEIR of ATP5H and ATP5MF were down-regulated in NTDs
实验动物模型在探讨疾病的发生发展机制中有着重要的作用,而鸡胚由于有培育周期短,成本低,发育过程清楚等优点,已作为胚胎发育研究的常用动物模型。一个多世纪以来,鸡胚在研究颅面发育和疾病发病机制的研究中发挥了重要作用[13]。鸡是研究神经管发育的合适动物模型,具有胚胎发生时间短、成本低等优点,且神经管闭合基因在鸡和人胚胎中的表达模式相似。研究表明,Hcy对神经胚形成期和器官形成期的胚胎均有显著的致畸性并与剂量呈正相关,鸡胚发生NTDs的主要表现是露脑、裂脑和脊柱裂。注射5 μg叶酸可明显拮抗Hcy的致畸性,NTDs发生率显著下降[14]。最近一个Hcy诱导NTDs鸡胚模型研究表明Hcy处理可能通过影响神经细胞的增殖和分化从而参与NTDs的发生[15]。同时还有研究表明在鸡胚发育的早期用Hcy的代谢物HTL干预也可导致鸡胚产生NTDs[16]。采用HTL注射鸡胚发现明显的无脑和脊柱裂表型, 并以此动物模型为基础研究高Hcy导致的NTDs的发病机制。
利用高HTL诱导的鸡胚NTDs脑组织,用itraq标记的蛋白组方法比较NTDs的脑组织差异蛋白,结果表明差异蛋白富集在氧化磷酸化通路,且全部显示为下调。氧化磷酸化,发生在真核细胞的线粒体内膜或原核生物的细胞质中,是物质在体内氧化时释放的能量通过呼吸链供给ADP与无机磷酸合成ATP的偶联反应。生物体内95%的ATP来自这种方式,特别对高耗能的脑组织。ATP是细胞内含有高能磷酸键的化合物,是细胞内能直接利用的能源。ATP合成量不足,可诱发不可逆的细胞坏死。
研究发现鸡胚NTDs中氧化磷酸化通路中ATP5L、ATP5MF、ATP5H、ATP6和COX3表达下降,其中ATP5L、ATP5MF、ATP5H、ATP6为ATP合成酶的组成成分。ATP合成酶是生物体能量代谢的关键酶。ATP合成酶可以在跨膜质子动力势的推动下,利用ADP和Pi催化合成生物体的能量“通货”—ATP。一般来说,机体所需的大多数ATP都是由ATP合酶产生的。ATP合酶功能紊乱与多种疾病相关, 例如ATP5A1缺失可导致致命的新生儿线粒体脑病[17]、 ATP5E突变可导致线粒体ATP合酶缺乏症[18]、ATP5D表达下调与肌萎缩侧索硬化症相关[19];而ATP合成酶β亚基功能失常对多种代谢疾病的发生至关重要,如糖尿病、肥胖等。ATP5L、ATP5MF、ATP5H、ATP6的表达异常可导致ATP合成酶异常而导致ATP合成量不足,这可能是导致HTL诱导NTDs的产生原因之一,而其具体导致NTDs发生的机制还需要进一步研究。
